Содержание
- 2. Литература: 1. Ершов, Ю. А. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов /
- 3. План: Предмет химия, роль в медицине. Основные этапы развития химии; Атомно-молекулярное учение; Основные понятия и законы
- 4. Химия - наука о веществах, их строении, свойствах и превращениях
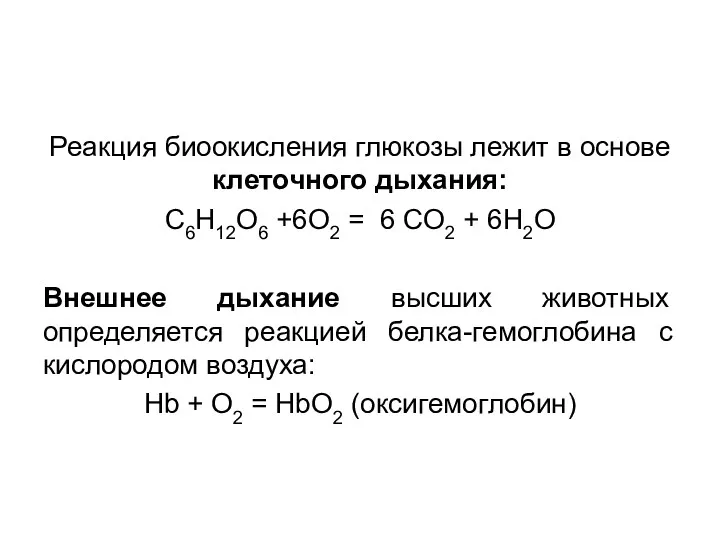
- 5. Реакция биоокисления глюкозы лежит в основе клеточного дыхания: C6H12O6 +6O2 = 6 CO2 + 6H2O Внешнее
- 6. Медик без довольного познания химии совершенен быть не может (М.В. Ломоносов)
- 7. Основные этапы развития химии: Алхимический период (с древних времен до конца XVIв.). Возник в Египте; 2.
- 8. 2. Любая современная химия начинается с атомно-молекулярного учения М.В.Ломоносова. Основные положения атомно-молекулярного учения: 1) Все вещества
- 9. Атом – наименьшая электронейтральная частица химического элемента, являющаяся носителем его свойств и далее ни химически, ни
- 10. Молекула – это наименьшая электронейтральная частица вещества, обладающая его характерными химическими свойствами.
- 11. Ион – электрически заряженная частица, которая образуется при отдаче или приобретении электронов атомами или молекулой.
- 12. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Для обозначения химических элементов применяются символы:
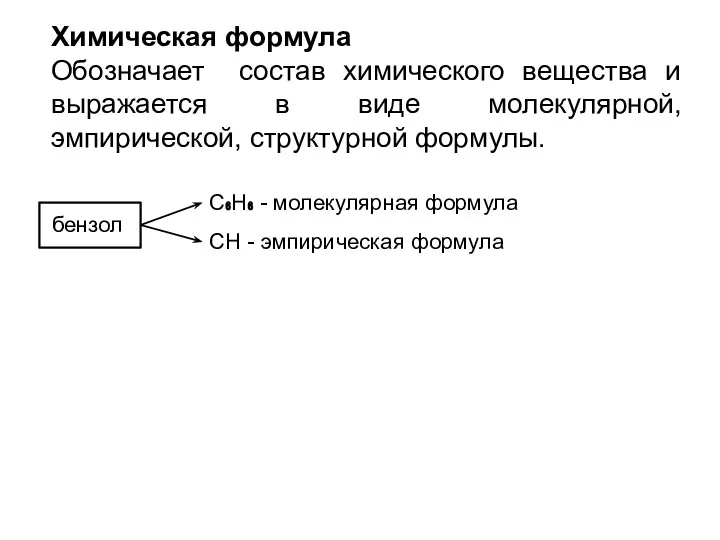
- 13. Химическая формула Обозначает состав химического вещества и выражается в виде молекулярной, эмпирической, структурной формулы. бензол C₆H₆
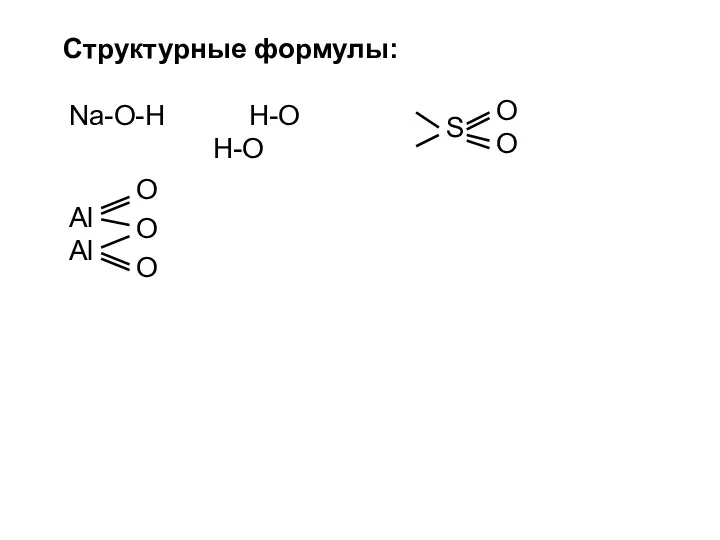
- 14. Na-O-H H-O H-O S O O Al Al O O O Структурные формулы:
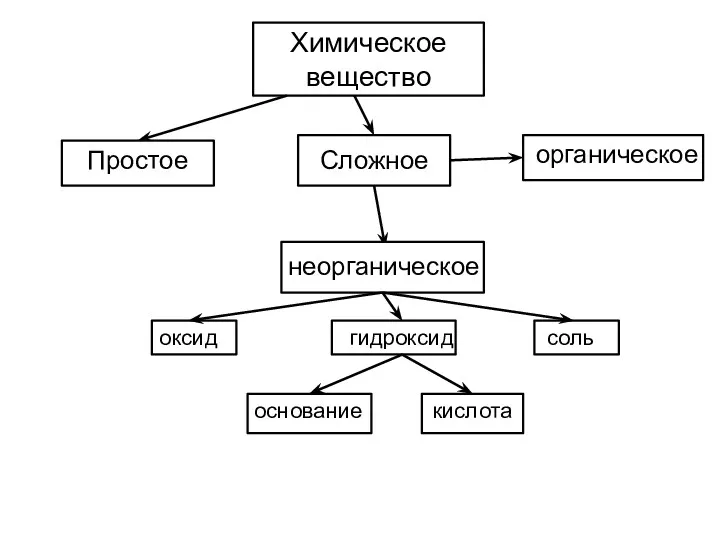
- 15. Химическое вещество Простое Сложное органическое неорганическое оксид гидроксид соль основание кислота
- 16. 3. Закон сохранения массы веществ (1748г., М.В.Ломоносов). Масса веществ, вступивших в химическую реакцию, равна массе веществ,
- 17. Значение закона в химии: - является основой количественного и качественного анализа; - исходя из него можно
- 18. Закон постоянства вещества (1808г., Ж.Пруст) Вещества имеют постоянный качественный и количественный состав независимо от способа получения.
- 19. Состав H2O: 1)качественный состав – из H и O 2)количественный состав - 11,11% водорода; 88,89% кислорода.
- 20. Способы получения получения воды: природная синтез: 2H₂+O₂=2H₂O реакция нейтрализации: HCl+NaOH=NaCl+H₂O из кристаллогидратов: Na₂CO₃·1OH₂O Na₂CO₃+1OH₂O H₂O t
- 21. Дальтониды – это соединения постоянного состава (H2O; HCl; CH4; SO2; C6H6). Бертоллиды – соединения переменного состава
- 22. Закон объемных отношений (1804-1808г.г., Дж. Дальтон) Объемы вступающих в реакцию газов относятся друг к другу и
- 23. Закон Авогадро (1811г.) В равных объемах различных газов при одинаковых условиях (T,P) содержится одинаковое число молекул
- 24. Следствия закона Авогадро 1) Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объем. Этот
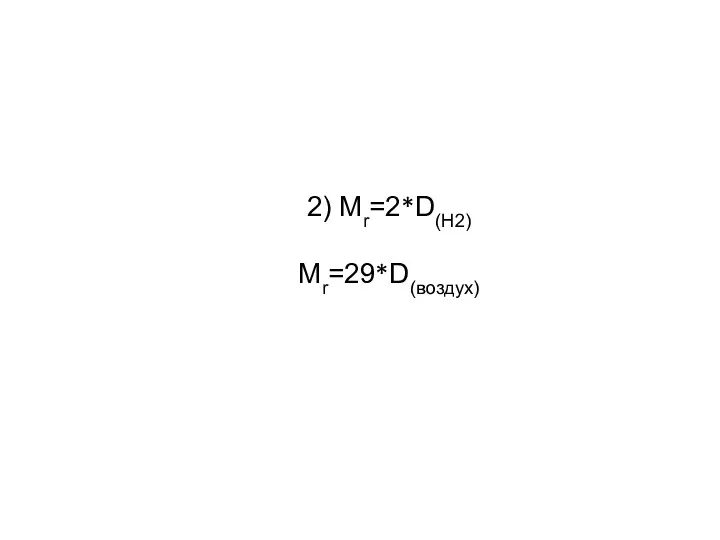
- 25. 2) Mr=2*D(H2) Mr=29*D(воздух)
- 26. Закон эквивалентов (1792г.) Массы (объемы) реагирующих друг с другом веществ пропорциональны их эквивалентным массам (эквивалентным объемам)
- 27. б) для газов с известным объемом V1 и V2 – объемы реагирующих газообразных веществ; V ₁V
- 28. Эквивалент – такое количество вещества, которое присоединяет или замещает 1 моль атомов водорода в химических реакциях.
- 29. Следствия закона эквивалентов а) Вещества реагируют друг с другом равным числом эквивалентов (эквивалентных масс): (3) где
- 30. б) Для растворов с известной нормальной концентрацией: (4) где CH1и CH2 – нормальные концентрации этих растворов;
- 31. Рациональное решение задач сводится к правильному выбору формул (1 – 4): m/Э=V/VЭ=CH*V=nэ
- 32. СПАСИБО ЗА ВНИМАНИЕ!
- 33. Способы выражения концентрации растворов. 1)Массовая доля (посмотри слайд 29) – это отношение массы данного компонента в
- 34. 2) Молярная концентрация или молярность (См или М) показывает количество молей растворенного вещества в 1л. раствора:
- 35. 3) Нормальная концентрация или нормальность (CHили Н) показывает количество эквивалентов растворенного вещества (в молях) в 1л.
- 36. CH CM CH = CM * (B*n), где B-валентность n- число атомов Алгоритм перевода С% CM
- 38. Скачать презентацию






























 Металлы – простые вещества
Металлы – простые вещества Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения Органическая химия
Органическая химия Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Коррозия и защита материалов
Коррозия и защита материалов Изучение физико-химических показателей качества макаронных изделий
Изучение физико-химических показателей качества макаронных изделий Хром. Строение атома
Хром. Строение атома Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi
Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi Виды деструкции
Виды деструкции Химиялық тепе-теңдік
Химиялық тепе-теңдік Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Количество вещества. 8 класс
Количество вещества. 8 класс Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Периодический закон и периодическая система Д.И. Менделеева
Периодический закон и периодическая система Д.И. Менделеева Общая и неорганическая химия
Общая и неорганическая химия Амины. Анилин
Амины. Анилин Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Поняття про неорганічні та органічні речовини
Поняття про неорганічні та органічні речовини Atomic mass
Atomic mass Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Зелёная химия
Зелёная химия Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс)
Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс) Химия и производство
Химия и производство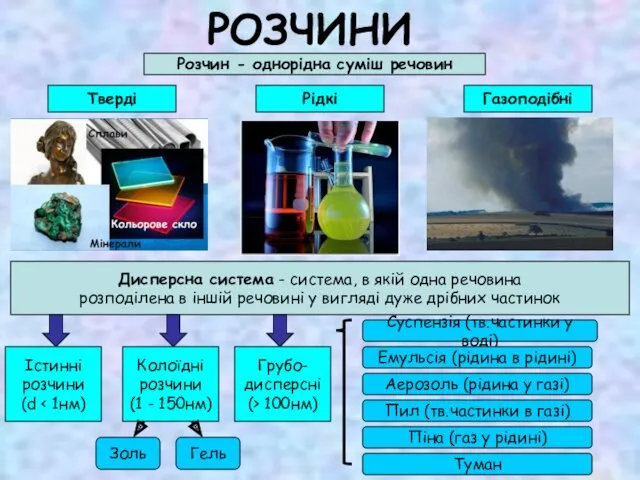 Розчини
Розчини Реакции SR в ряду алканов
Реакции SR в ряду алканов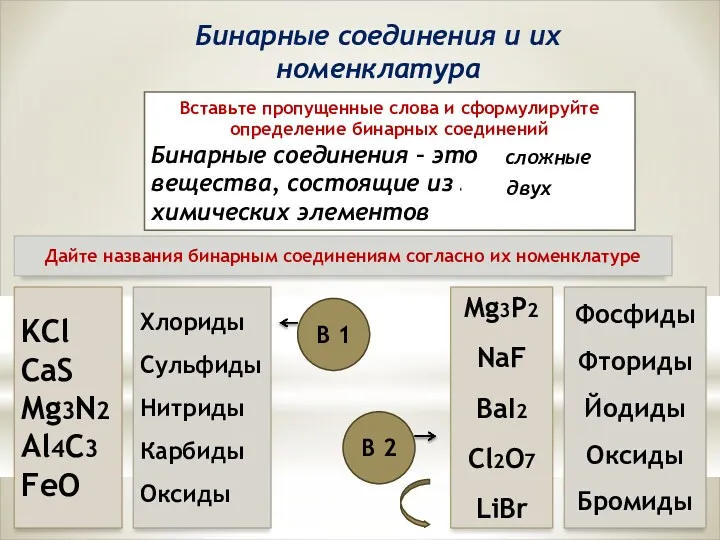 Бинарные соединения и их номенклатура
Бинарные соединения и их номенклатура