Содержание
- 2. МЕТАЛЛЫ l ll и lll А групп
- 3. МЕТАЛЛЫ l группы
- 6. МЕТАЛЛЫ ll группы
- 8. Химические свойства металлов второй группы Взаимодействие с неметаллами
- 9. Металлические свойства элементов главной подгруппы III группы выражены слабее, чем у элементов главных подгрупп I и
- 10. По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят
- 11. Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый
- 12. Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после
- 13. Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом
- 14. Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места
- 16. Скачать презентацию
 Серная кислота. 9 класс
Серная кислота. 9 класс Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь Химиялық элементтердің табиғи топтары
Химиялық элементтердің табиғи топтары Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Характеристика химического элемента Металла на основании его положения в периодической системе Д.И. Менделеева
Характеристика химического элемента Металла на основании его положения в периодической системе Д.И. Менделеева Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Определение разных форм угольной кислоты
Определение разных форм угольной кислоты Титриметрический анализ
Титриметрический анализ Теория сильных и слабых электролитов
Теория сильных и слабых электролитов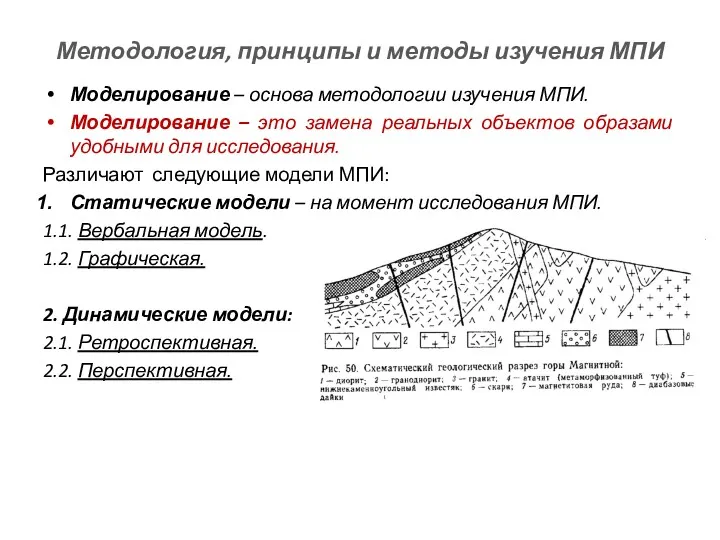 Методология, принципы и методы изучения МПИ
Методология, принципы и методы изучения МПИ Классификация минералов в соответствии с систематикой, утвержденной IMA
Классификация минералов в соответствии с систематикой, утвержденной IMA Бытовая химическая грамотность
Бытовая химическая грамотность Аналитическая химия. Физико-химические методы анализа
Аналитическая химия. Физико-химические методы анализа Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов Бейорганикалық химия туралы
Бейорганикалық химия туралы Эксплуатационные материалы
Эксплуатационные материалы Строение атома. Лекция №2
Строение атома. Лекция №2 Конструкционные функциональные волокнистые композиты. Углеродные волокна
Конструкционные функциональные волокнистые композиты. Углеродные волокна Основные понятия и законы химии
Основные понятия и законы химии Периодический закон Д.И. Менделеева (лекция 3)
Периодический закон Д.И. Менделеева (лекция 3) Соли (12 класс)
Соли (12 класс)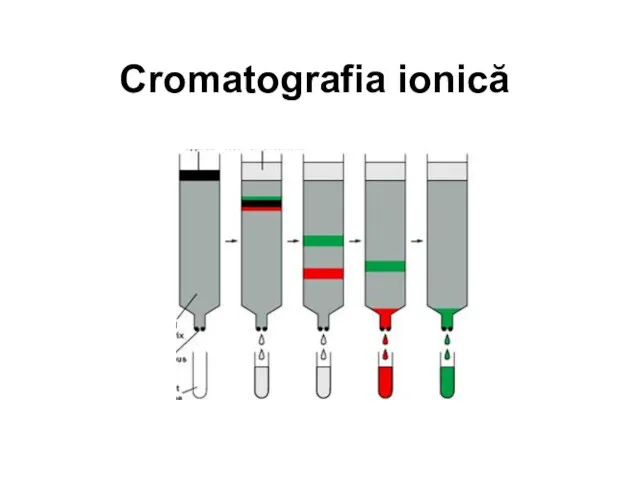 Cromatografia ionică
Cromatografia ionică Липиды 2. Тканевой обмен
Липиды 2. Тканевой обмен Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Кислоты. Индикаторы
Кислоты. Индикаторы Физико-химические и пожароопасные свойства углеводородов. (Тема 3.1)
Физико-химические и пожароопасные свойства углеводородов. (Тема 3.1) Предмет органической химии
Предмет органической химии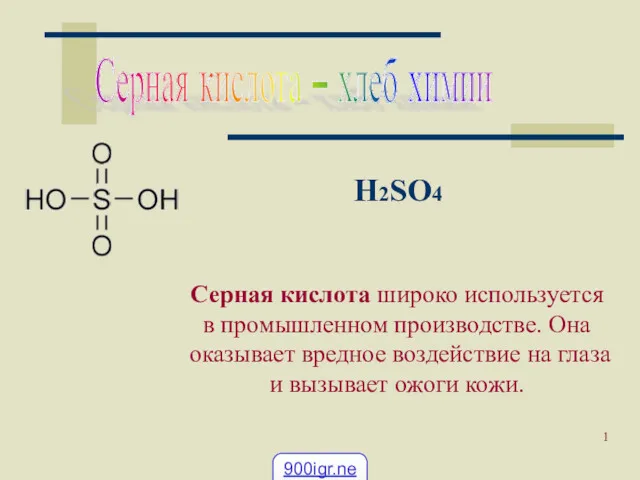 Применение серной кислоты
Применение серной кислоты