Слайд 2

Оглавление
Что такое раствор?
Что называют электролитической диссоциацией?
Основные положения теории электролитической диссоциации
(ТЭД)
Строение молекулы воды
Механизм электролитической диссоциации
Что такое электролит?
Какие количественные характеристики определяют силу электролита?
Слайд 3

Оглавление
Определения сильных и слабых электролитов
Что относится к сильным и слабым электролитам?
Сильные
электролиты, их диссоциация, теория Дебайя и Хюккеля, эффективная концентрация
Слабые электролиты, их диссоциация, связь константы диссоциации со степенью диссоциации
Выводы: какие факторы влияют на электролитическую диссоциацию? Условия необратимости химических реакций
Источники информации
Слайд 4

Что такое раствор?
Раствор – это гомогенная смесь двух или нескольких
веществ, способная непрерывно изменять свои свойства. Растворы бывают жидкие и твердые.
В растворах слабых электролитов степень диссоциации мала, число катионов и анионов в растворе вследствие неполной диссоциации тоже маленькое CD -> C(+) + D(-)
Число ионов в сильных электролитах больше, следовательно, чем больше концентрация, тем больше ионы электростатически взаимодействуют между собой, при взаимодействии образуются ионные пары C(+)……D(-)
Слайд 5

Слайд 6

Что называют электролитической диссоциацией?
Процесс распада вещества на ионы при растворении
в воде или расплавлении называют электролитической диссоциацией.
Электролитическая диссоциация состоит из двух одновременно протекающих обратных процессов: из диссоциации (распада молекул на ионы) и ассоциации (процесса образования молекул из ионов).
Отличие растворов электролитов от растворов неэлектролитов заключается в том, что при диссоциации происходит резкое увеличение числа частиц в растворе.
Слайд 7

Основные положения теории электролитической диссоциации (ТЭД)
Химические субстанции делятся на электролиты и неэлектролиты.
При растворении
в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
Под действием электрического тока движение ионов упорядочивается, и катионы движутся к отрицательному полюсу — катоду, анионы - к положительному аноду.
Электролитическая диссоциация - процесс обратимый (обратная реакция называется ассоциацией).
На степень электролитической диссоциации влияют различные факторы: природа растворенного вещества и его количество, свойства растворителя, температура раствора.
Слайд 8

Слайд 9

Что такое электролиты?
Проводники, прохождение через которые электрического тока вызывает перемещение вещества
в виде ионов (ионная проводимость) и химические превращения (электрохимические реакции), называются электролитами.
Сильные электролиты (неассоциированные) – электролиты, степень диссоциации которых в растворах равна 1, то есть диссоциируют полностью (сильные кислоты, щелочи, соли).
Слабые электролиты (ассоциированные) – степень диссоциации меньше единицы (то есть диссоциируют неполностью) и уменьшается с ростом концентрации.
Слайд 10

Механизм электролитической диссоциации
Слайд 11

Какие количественные характеристики определяют силу электролита?
Количественной характеристикой, определяющей силу электролита, является
СТЕПЕНЬ ДИССОЦИАЦИИ α=Cподв/C0
В расчетах степени диссоциации используют активную или аналитическую концентрацию.
Активная концентрация – это концентрация свободных частиц.
Аналитическая концентрация – это, например, молярная Cm, единица измерения моль/л (Cm=n/V)
Активная концентрация – та концентрация, которую мы учитываем в рассчетах a=Ci x f,
lg (f)= -1/2*Zi2*√I
Слайд 12

Что относится к электролитам?
Слайд 13

Слайд 14

Слайд 15















 Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Платина. Свойства
Платина. Свойства Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии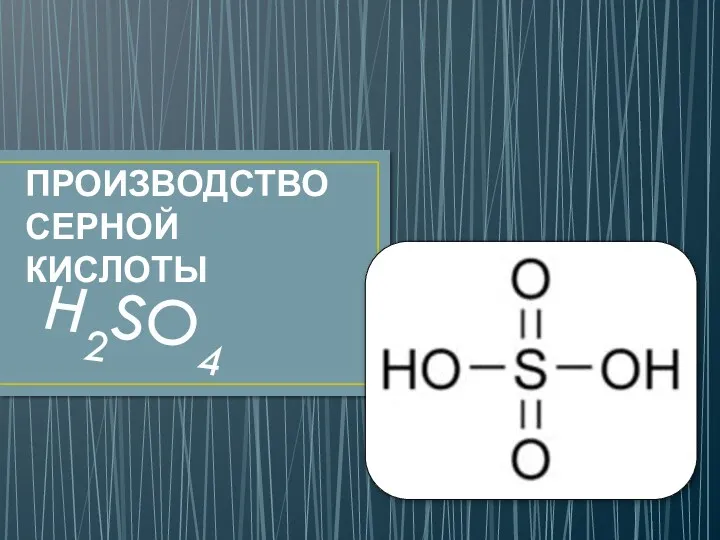 Производство серной кислоты
Производство серной кислоты Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Классификация строительных материалов. Коррозия бетона и железобетона
Классификация строительных материалов. Коррозия бетона и железобетона Органикалық қосылыстардың
Органикалық қосылыстардың Строение атома
Строение атома Ionic polymerization
Ionic polymerization Классификация автомобильных масел
Классификация автомобильных масел Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе
Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе Экспериментальные методы измерения изотерм адсорбции. Лекция 4
Экспериментальные методы измерения изотерм адсорбции. Лекция 4 Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій
Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій Производство серной кислоты
Производство серной кислоты Предмет химии. Вещества и их физические свойства
Предмет химии. Вещества и их физические свойства Отложения и коррозия
Отложения и коррозия Закон сохранения массы веществ. Урок вместе с умной колонкой
Закон сохранения массы веществ. Урок вместе с умной колонкой Металлы. Классификация металлов
Металлы. Классификация металлов Аминокислоты. Гетерофункциональные соединения, молекулы
Аминокислоты. Гетерофункциональные соединения, молекулы Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Происхождение химических элементов
Происхождение химических элементов Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Речовини. Молекули. Атоми
Речовини. Молекули. Атоми Химическая технология ситаллов и композитов
Химическая технология ситаллов и композитов