Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе презентация
Содержание
- 2. Простые и комплексные соединения HgI2 + 2KI = K2[HgI4] SO3(т) + K2O(т) = = K2SO4(т) HgI2(т)
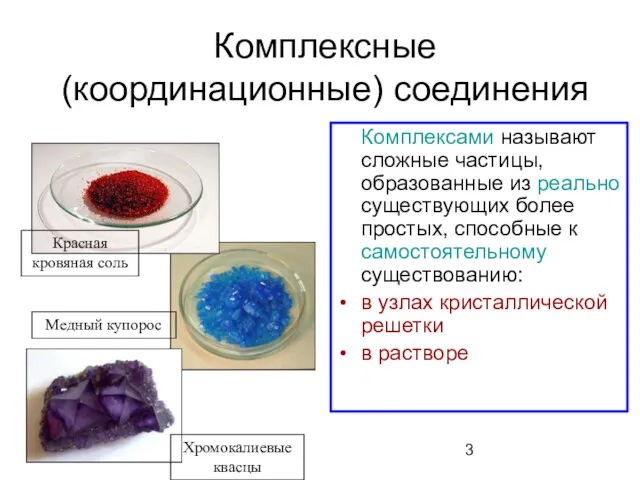
- 3. Комплексные (координационные) соединения Комплексами называют сложные частицы, образованные из реально существующих более простых, способные к самостоятельному
- 4. Координационная теория (1893 г. ) Внутренняя и внешняя сфера комплексного соединения [MLx]Yz Комплексообразователь M±ν Лиганды L±ν
- 5. Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] [Ni(NH3)6]2[Fe(CN)6] Примеры Внеш.сферы нет
- 6. Комплексообразователь, лиганды, КЧ и дентатность. Примеры [NH4]Cl – КЧ 4, дент.1 [Al(H2O)6]Cl3 – КЧ 6, дент.1
- 7. Полидентатные лиганды
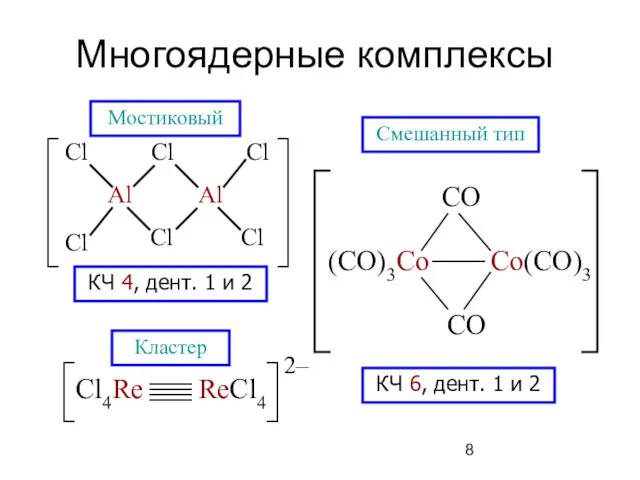
- 8. Многоядерные комплексы КЧ 4, дент. 1 и 2 Мостиковый Кластер Смешанный тип КЧ 6, дент. 1
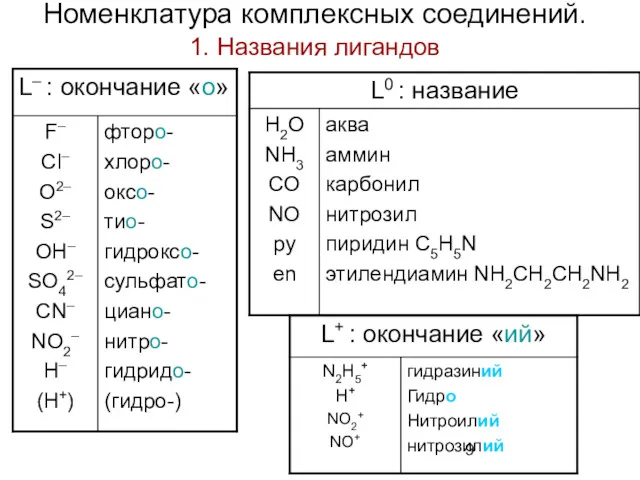
- 9. Номенклатура комплексных соединений. 1. Названия лигандов
- 10. 2. Формулы и названия комплексных соединений. [M(L+)(L0)(L–)]±,0 Число лигандов – греческое числительное 1 – (моно) 2
- 11. 3. Названия комплексных соединений А) Комплексы без внешней сферы [MLn]0 n (число лигандов) → L (название
- 12. Названия комплексных соединений Б) Комплексный катион [MLn]+X– Название аниона в именительном падеже + название комплексного катиона
- 13. Названия комплексных соединений В) Комплексный анион X+[MLn]– анион n → L → M(степень окисления)- «ат» Исключения:
- 14. Названия комплексных соединений Г) Многоядерные соединения [(H2O)4Al(OH)2Al(H2O)4](SO4)2 – сульфат ди(μ-гидроксо)-бис{тетраакваалюминия(III)} [(en)2Co(SO4)(NH2)Co(en)2]Br3 – бромид (μ-амидо)(μ-сульфато)-ди{бис(этилендиамин)кобальта(III)} [(NH3)5Cr(OH)Cr(NH3)4(OH)]Br4– бромид
- 15. Примеры: Na3[AgI(SO3S)2] – бис(тиосульфато)аргентат(I) натрия [PtII(py)4]2[FeII(CN)6] – гексацианоферрат(II) тетрапиридинплатины(II) [K(H2O)6][Al(H2O)6](SO4)2 – сульфат гексаакваалюминия-гексааквакалия [(CO)5Mn-Mn(CO)5] – бис(пентакарбонилмарганец)
- 16. Комплексные соединения в растворах Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2 ) Сильные электролиты [Pt(NH3)4]Cl2 =
- 17. [MLn] + H2O ⮀ [MLn-1(H2O)] + L0 (n = КЧ) [H2O] = Const, р-р разбавленный Ступенчатая
- 18. Чем больше значение Ki(обр), тем сильнее смещено равновесие в сторону образования данного комплекса. … Ступенчатая константа
- 19. Полные (суммарные) константы образования Характеристика устойчивости комплексного соединения: чем больше значение βn(обр), тем более устойчив комплекс
- 20. Связь между полной и ступенчатой константами образования βn(обр) = K1(обр)·K2(обр)·K3(обр)·… ·Kn(обр)
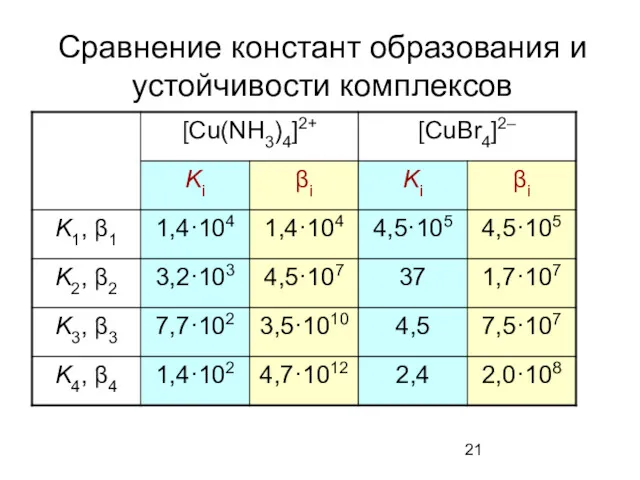
- 21. Сравнение констант образования и устойчивости комплексов
- 23. Скачать презентацию
![Простые и комплексные соединения HgI2 + 2KI = K2[HgI4] SO3(т)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-1.jpg)

![Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] [Ni(NH3)6]2[Fe(CN)6] Примеры Внеш.сферы нет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-4.jpg)
![Комплексообразователь, лиганды, КЧ и дентатность. Примеры [NH4]Cl – КЧ 4,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-5.jpg)

![2. Формулы и названия комплексных соединений. [M(L+)(L0)(L–)]±,0 Число лигандов –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-9.jpg)
![3. Названия комплексных соединений А) Комплексы без внешней сферы [MLn]0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-10.jpg)
![Названия комплексных соединений Б) Комплексный катион [MLn]+X– Название аниона в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-11.jpg)
![Названия комплексных соединений В) Комплексный анион X+[MLn]– анион n →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-12.jpg)
2 – сульфат ди(μ-гидроксо)-бис{тетраакваалюминия(III)}](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-13.jpg)
![Примеры: Na3[AgI(SO3S)2] – бис(тиосульфато)аргентат(I) натрия [PtII(py)4]2[FeII(CN)6] – гексацианоферрат(II) тетрапиридинплатины(II) [K(H2O)6][Al(H2O)6](SO4)2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-14.jpg)
![Комплексные соединения в растворах Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-15.jpg)
![[MLn] + H2O ⮀ [MLn-1(H2O)] + L0 (n = КЧ)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/127458/slide-16.jpg)



 Строение электронных оболочек атомов
Строение электронных оболочек атомов Растворы ВМС
Растворы ВМС Промышленные типы месторождений железа
Промышленные типы месторождений железа Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Химия нефти и газа
Химия нефти и газа Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів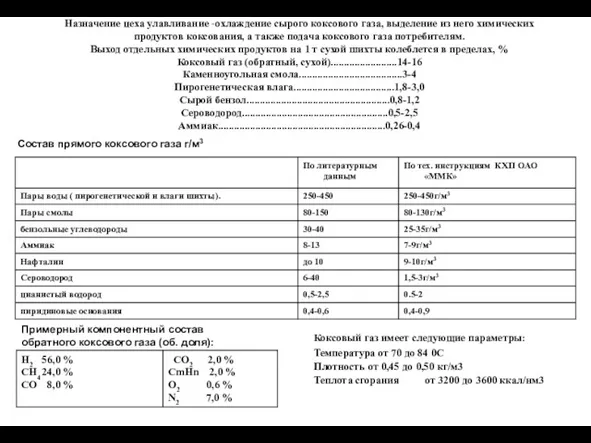 Охлаждение сырого коксового газа, выделение из него химических продуктов коксования
Охлаждение сырого коксового газа, выделение из него химических продуктов коксования Переходные элементы
Переходные элементы Низкомолекулярные компоненты сыворотки крови
Низкомолекулярные компоненты сыворотки крови Гидролиз неорганических веществ - солей. (11 класс)
Гидролиз неорганических веществ - солей. (11 класс) Крекинг нефти
Крекинг нефти Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Аминокислоты. Номенклатура
Аминокислоты. Номенклатура Детонаційна стійкість бензину
Детонаційна стійкість бензину Алкадиены
Алкадиены Класифікація неорганічних сполук, їхній склад і номенклатура
Класифікація неорганічних сполук, їхній склад і номенклатура Азот
Азот Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Техника безопасности на уроках химии. Решение экспериментальных задач по теме Неметаллы. Практическая работа №2
Техника безопасности на уроках химии. Решение экспериментальных задач по теме Неметаллы. Практическая работа №2 Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Количество вещества. Молярная масса и молярный объем
Количество вещества. Молярная масса и молярный объем Урок + презентация Азот. 9 класс.
Урок + презентация Азот. 9 класс. Цепные химические реакции
Цепные химические реакции Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз
Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз Йод в нашей жизни
Йод в нашей жизни Степень окисления. Подготовка к контрольной работе
Степень окисления. Подготовка к контрольной работе Основные электрохимические процессы
Основные электрохимические процессы