Техника безопасности на уроках химии. Решение экспериментальных задач по теме Неметаллы. Практическая работа №2 презентация
Содержание
- 2. - Закрепление знаний о качественных реакциях на анионы и катион аммония; - Совершенствование умения писать реакции
- 3. Техника безопасности на уроках химии
- 4. Прежде чем приступить к выполнению эксперимента, внимательно изучи инструкцию
- 5. Эксперименты нужно выполнять в строгом соответствии с инструкциями, используя точно указанные количества веществ Следует помнить, что
- 6. Помните, что любое вещество может быть опасным, если обращаться с ним неправильно Без указания преподавателя не
- 7. Пользоваться реактивами можно только из тех склянок, на которых есть надписи
- 8. Используйте только чистую лабораторную посуду и тщательно промывайте ее после выполнения эксперимента
- 9. Жидкость из сосуда берите пипеткой
- 10. После эксперимента не выливайте в раковину остатки реактивов – они должны быть нейтрализованы и разбавлены Остатки
- 11. Вещества не должны храниться вместе с пищевыми продуктами
- 12. Не принимайте пищу во время химических экспериментов, а после их завершения тщательно мойте руки Никогда не
- 13. Правила нагревания Держите пробирку выходом от себя, а также в сторону, противоположную от любого человека, находящегося
- 14. Помните, что нюхать любое вещество нужно очень осторожно. Не склоняйтесь над сосудом с кипящей жидкостью! Определять
- 15. Никогда не добавляйте воду в кислоту
- 16. Юные химики, помните: кислоту добавляют в воду, а не наоборот
- 17. Правила выживания в химической лаборатории Если в руках у вас жидкое - не разлейте, порошкообразное -
- 18. Мини-тест
- 19. 1. Один из признаков реакций ионного обмена, дошедших до конца а) выделение энергии; б) выпадение осадка;
- 20. 2.Качественный ион на сульфат –анион а) катион серебра; б) катион водорода; в) катион бария; г) гидроксид-ион
- 21. 3. Пищевая сода – это а) хлорид натрия; б) карбонат натрия; в) гидрокарбонат натрия; г) карбонат
- 22. 4. Желтый осадок при добавлении нитрата серебра выпадает при действии на а) фосфаты; б) хлориды; в)
- 23. 5. Все эти соли хорошо растворимы в воде и являются азотными удобрениями, известны под названием а)
- 24. 6. Как используют пищевую соду в хлебопекарном производстве? а) растворяется в воде; б) перемешивают с поваренной
- 25. 7. Какой ион можно обнаружить по посинению влажной лакмусовой бумажки? а) хлорид-анион, б) сульфид анион; в)
- 26. 8. Качественная реакция на хлорид-анион а) выпадение белого осадка при добавлении нитрата серебра; б) выпадение желтого
- 27. 9. Качественная реакция на катион аммония а) выпадение белого осадка при добавлении нитрата серебра; б) выделение
- 28. 10. Как распознать соли угольной кислоты? а) вспенивание или шипение при действии кислот б) выпадение желтого
- 29. Правильные ответы: 1.б 2.в 3.ж 4.а 5.б 6.в 7.г 8.а 9.г 10.а
- 30. Критерии оценки 1ошибка – «5» 2-3 ошибки – «4» 4-5 ошибок – «3» Более 5 ошибок
- 32. Скачать презентацию





























 Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Легированные стали
Легированные стали Фенолы
Фенолы Теплота сгорания топлива
Теплота сгорания топлива Физико-химические свойства сырья, продукции, реагентов и материалов (часть 2)
Физико-химические свойства сырья, продукции, реагентов и материалов (часть 2) Химическая связь
Химическая связь Генетическая связь между классами неорганических веществ. Химический тренажёр
Генетическая связь между классами неорганических веществ. Химический тренажёр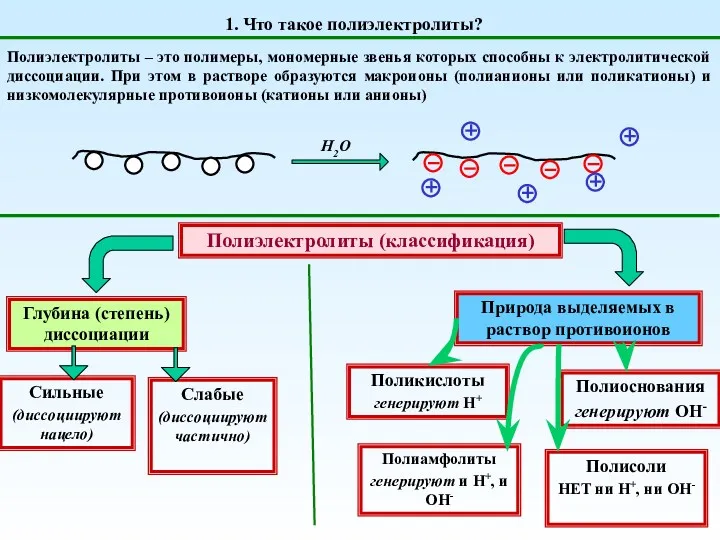 Полиэлектролиты. (Тема 3)
Полиэлектролиты. (Тема 3) Источники углеводородов
Источники углеводородов Химия 20 века
Химия 20 века Амины. Анилин
Амины. Анилин Аквамарин
Аквамарин Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Нуклеиновые кислоты. Нуклеотиды
Нуклеиновые кислоты. Нуклеотиды Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Сложные эфиры
Сложные эфиры Металлы в нашей жизни
Металлы в нашей жизни Химические реакции. Условия необходимые для протекания химических реакций?
Химические реакции. Условия необходимые для протекания химических реакций? Коррозия металлов. Способы защиты металлов от коррозии
Коррозия металлов. Способы защиты металлов от коррозии Штучні і синтетичні волокна
Штучні і синтетичні волокна Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Теоретические основы органической химии
Теоретические основы органической химии Что такое химия. Техника безопасности. Интересные факты (урок 1)
Что такое химия. Техника безопасности. Интересные факты (урок 1)