Содержание
- 2. Обратимые и необратимые реакции. Обратимые химические реакции – это реакции, одновременно протекающие в прямом и обратном
- 3. Признаки необратимости. CuCl2 + 2KOH=Cu(OH)2↓ +2KOH – выпал осадок Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
- 4. Химическое равновесие. H2 + I2 ↔ 2HI Вернемся к обратимой реакции водорода с парами йода. В
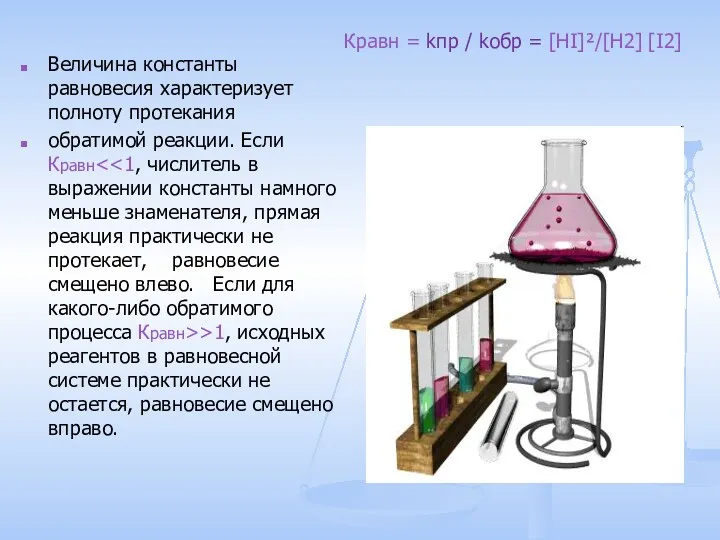
- 5. Константа химического равновесия. H2 + I2 ↔ 2HI Состояние химического равновесия характеризуется особой величиной – константой
- 6. Величина константы равновесия характеризует полноту протекания обратимой реакции. Если Кравн >1, исходных реагентов в равновесной системе
- 7. Факторы, вызывающие смещение химического равновесия. Состояние химического равновесия может сохраняться долго при неизменных внешних условиях: температуры,
- 8. Историческая справка. Французский ученый- химик, занимался исследованиями процессов протекания химических реакций. Принцип смещения равновесий- самое известное,
- 9. Принцип Ле Шателье. Известен всюду на Земле Анри Луи Де Шателье. Он не был королем и
- 10. Изменение концентрации: 3H2 + N2 ↔ 2NH3 А) если увеличиваем концентрацию конечных продуктов, рав- новесие смещается
- 11. Изменение давления А) при увеличения давления равновесие смещается в сторону той реакции, при которой объем образовавшихся
- 12. Изменение температуры А) при повышении температуры химическое равновесие смещается в сторону эндотермической реакции. Б) при понижении
- 13. Значение принципа Ле Шателье.
- 14. ВОПРОС 1. При повышении температуры равновесие системы смещается 2SO3 2SO2 + O2 - Q Если увеличить
- 15. (в сторону обр-ния исх. в-тв)
- 16. ВОПРОС 2. Каким образом можно сместить равновесие реакции в сторону исходных веществ (все в-ва – газы):
- 17. (повысить температуру, понизить давление).
- 18. ВОПРОС 3. При повышении давления равновесие реакции смещается 2SO3 2SO2 + O2 - Q
- 19. (в сторону обр-ния исх. в-тв)
- 20. ВОПРОС 4. Каким образом можно сместить равновесие в сторону продуктов реакции SO2 + 2H2S 3S +
- 21. (повысить давление, понизить температуру)
- 22. ВОПРОС 5. При уменьшении концентрации SO2 равновесие реакции смещается H2SO3 SO2 + H2O -Q
- 23. (в сторону прод. р-ции)
- 24. ВОПРОС 6. При повышении температуры равновесие реакции сместится Q-2ZnS + O2 2ZnO + H2O + Q
- 25. (в сторону исх. в-тв)
- 26. Задача . Как надо изменить концентрации веществ, давление и температуру гомогенной системы PCl5 ↔ PCl3 +
- 27. ВОПРОС A21. В какой системе увеличение давления приведет к смещению химического равновесия в сторону прямой реакции?
- 28. Задача 4. Как сместиться химическое равновесие реакции 2СО + О2 ↔ 2СО2 + Q при а)
- 29. ВОПРОС A21. В какой системе увеличение давления приведет к смещению химического равновесия в сторону прямой реакции?
- 30. ВОПРОС A21. В какой системе увеличение давления приведет к смещению химического равновесия в сторону прямой реакции?
- 31. Задания ЕГЭ . 1. Условие необратимости химического превращения. а) образование слабого электролита б) поглощение большого количества
- 32. 4. Верны ли следующие суждения о смещении химического равновесия в системе 2CO(г) + O2(г) ↔ 2CO2(г)
- 34. Скачать презентацию






























 Лантаноиды. Лантан
Лантаноиды. Лантан Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Натуральный и синтетический каучуки. Резина
Натуральный и синтетический каучуки. Резина Свинец и цинк в природе
Свинец и цинк в природе Карбонильные соединения. Альдегиды и кетоны
Карбонильные соединения. Альдегиды и кетоны Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Алкины. Гомологический ряд алкинов
Алкины. Гомологический ряд алкинов Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2 Химический анализ почв. Понятия и показатели
Химический анализ почв. Понятия и показатели Технические средства наноэлектроники. Эпитаксиальные методы получения наноструктур
Технические средства наноэлектроники. Эпитаксиальные методы получения наноструктур Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10
Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10 Химия в повседневной жизни
Химия в повседневной жизни Химия. D-элементтер
Химия. D-элементтер Основные классы неорганических соединений
Основные классы неорганических соединений Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Оксиды азота
Оксиды азота Металлы. Общая характеристика
Металлы. Общая характеристика Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Наноалмазы детонационного синтеза
Наноалмазы детонационного синтеза Реакции ионного обмена
Реакции ионного обмена Lesson 2 and 3. The chemistry of life
Lesson 2 and 3. The chemistry of life Применение родия (Rh)
Применение родия (Rh) Виды химической связи
Виды химической связи СОЕДИНЕНИЯ ХРОМА
СОЕДИНЕНИЯ ХРОМА Приготовление растворов солей с определенной массовой долей растворенного вещества
Приготовление растворов солей с определенной массовой долей растворенного вещества Золото
Золото