Содержание
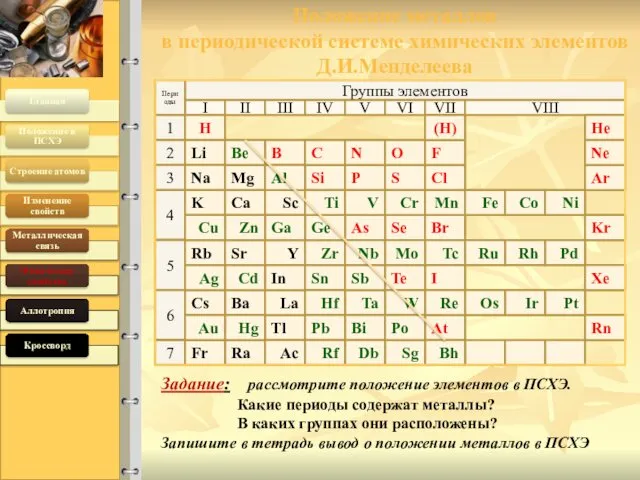
- 2. Положение металлов в периодической системе химических элементов Д.И.Менделеева 19.04.2016 Соколова О.Е. Группы элементов VII VIII Периоды
- 3. Особенности строения атомов металлов 11 Na 20 Са 26 Fe 19.04.2016 2е 8е 1е 2е 8е
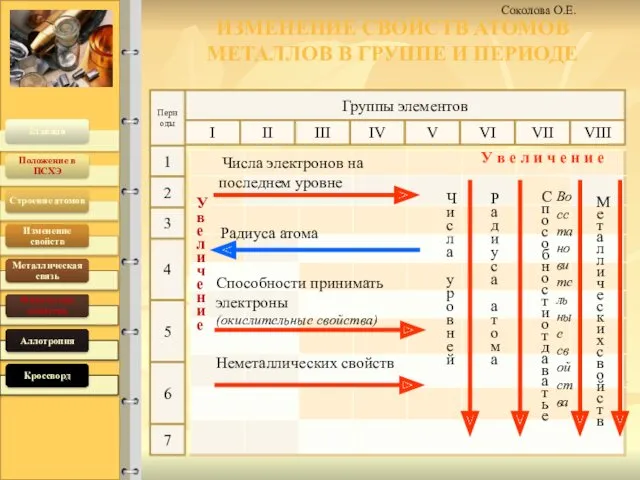
- 4. 19.04.2016 Соколова О.Е. ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ МЕТАЛЛОВ В ГРУППЕ И ПЕРИОДЕ Группы элементов Увеличение У в
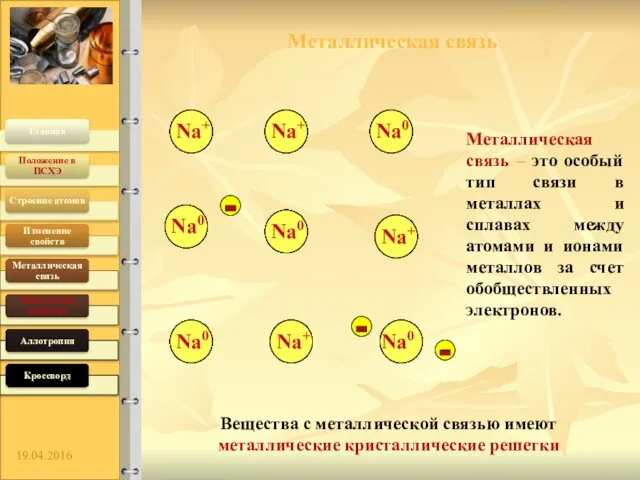
- 5. Металлическая связь – это особый тип связи в металлах и сплавах между атомами и ионами металлов
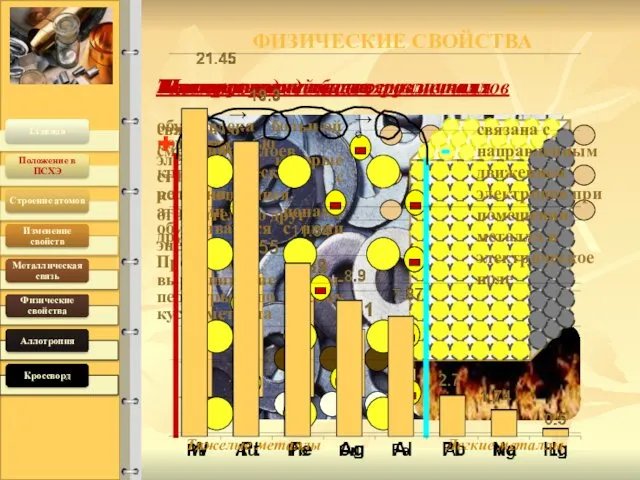
- 6. Металлический блеск 19.04.2016 Температура плавления различная Плотность металлов различная связана со смещением слоев кристаллической решетки относительно
- 7. Физические свойства
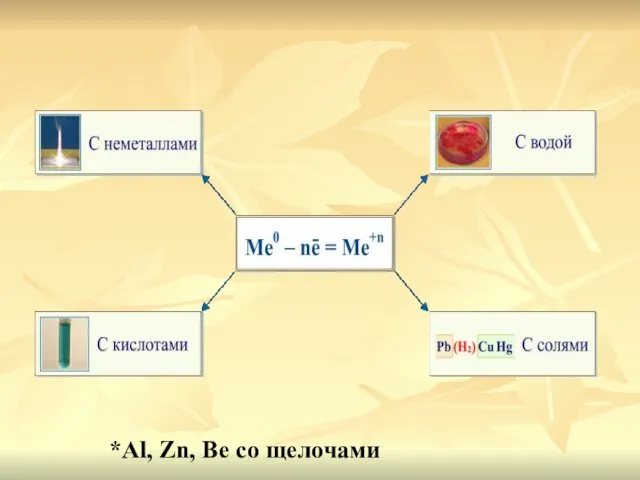
- 8. *Al, Zn, Be cо щелочами
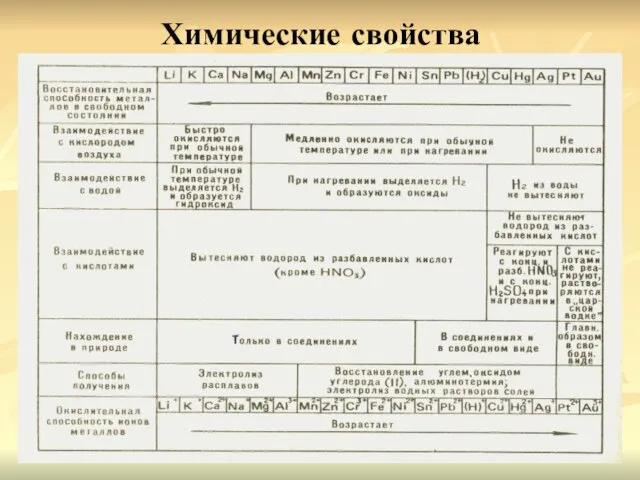
- 9. Химические свойства
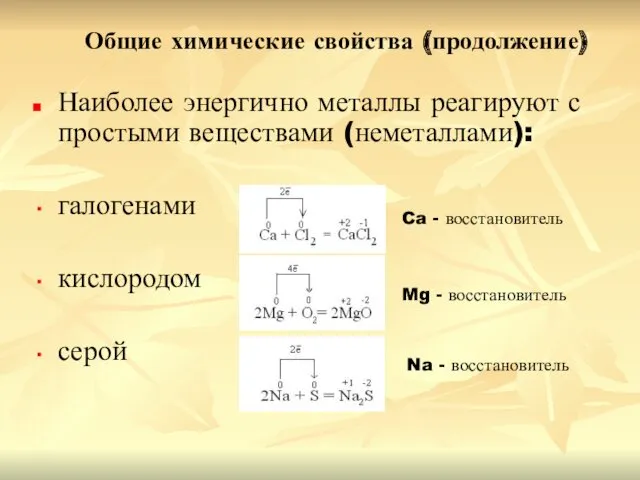
- 10. Общие химические свойства (продолжение) Наиболее энергично металлы реагируют с простыми веществами (неметаллами): галогенами кислородом серой Ca
- 11. Химические свойства металлов Взаимодействие с неметаллами: с кислородом с серой с галогенами
- 12. Общие химические свойства (продолжение) Металлы могут окисляться также ионами водорода и ионами других металлов. Металлы реагируют
- 13. Взаимодействие со сложными веществами: с водой
- 14. Взаимодействие c растворами кислот
- 15. Взаимодействие с растворами солей Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в
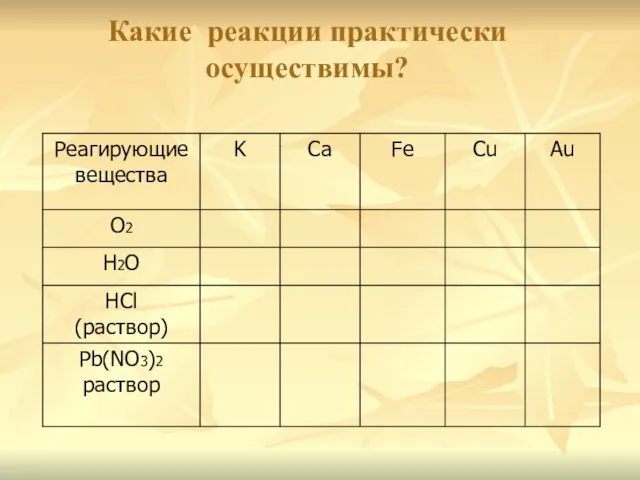
- 16. Какие реакции практически осуществимы?
- 18. Скачать презентацию







 Ионная химическая связь
Ионная химическая связь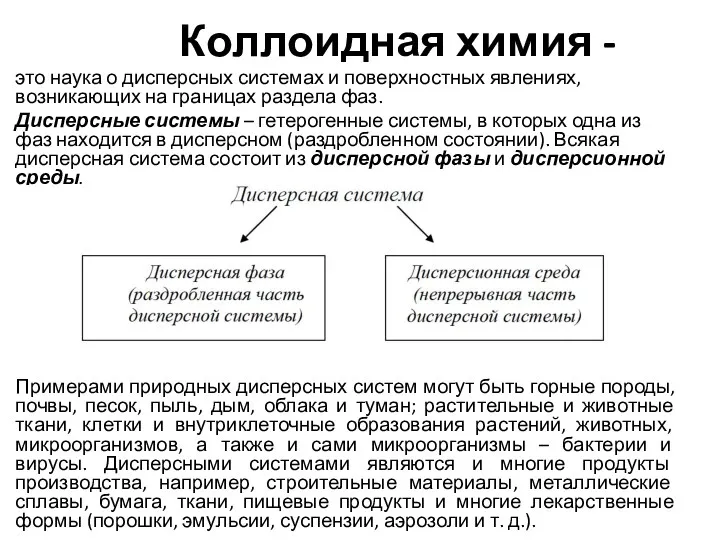 Коллоидная химия
Коллоидная химия бензол часть 10к
бензол часть 10к Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Физические методы стабилизации масел
Физические методы стабилизации масел Крохмаль. Структурна формула крохмалю
Крохмаль. Структурна формула крохмалю Көміртек
Көміртек Металдардың химиялық белсенділігі
Металдардың химиялық белсенділігі Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №13
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №13 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Вода. Химические свойства воды. Состав, нахождение в природе
Вода. Химические свойства воды. Состав, нахождение в природе Cleaners for
Cleaners for Мектепте химия пәнінен олипиядалық есептерді шешуде иондар қасиеттерінің маңызы
Мектепте химия пәнінен олипиядалық есептерді шешуде иондар қасиеттерінің маңызы Химическая связь и ее типы. Кристаллические решетки
Химическая связь и ее типы. Кристаллические решетки Химические свойства воды (домашнее задание)
Химические свойства воды (домашнее задание) Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Алкени і алкіни
Алкени і алкіни Проект Получение пресной и чистой воды
Проект Получение пресной и чистой воды Нефелометрический анализ
Нефелометрический анализ Аминокислоты
Аминокислоты Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Откуда берутся кристаллы
Откуда берутся кристаллы Степень окисления
Степень окисления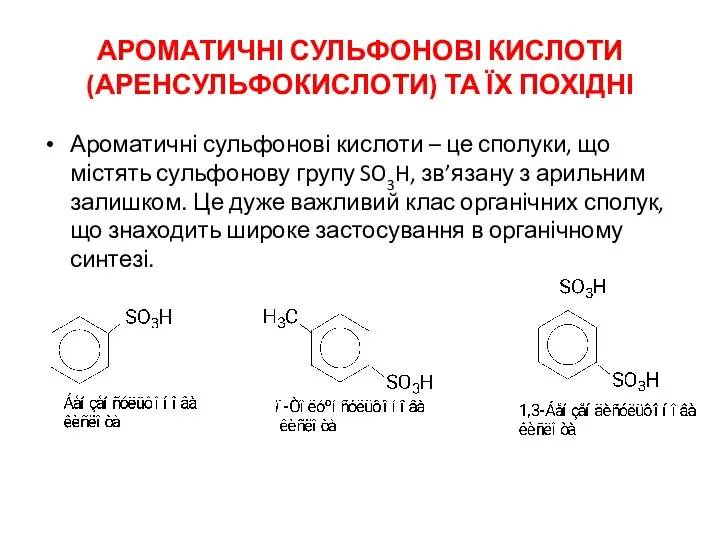 Ароматичні сульфонові кислоти (аренсульфокислоти) та їх похідні
Ароматичні сульфонові кислоти (аренсульфокислоти) та їх похідні Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Цинк и его соединения
Цинк и его соединения Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Preparation for COP
Preparation for COP