Элементы IV группы, главной подгруппы
Sn
+50
2
8
18
4
32
Si
+18
2
8
4
У атома кремния 4 внешних электрона находятся
на небольшом расстоянии от ядра, сила притяжения этих электронов к ядру велика, поэтому атом кремния – неметалл (принимает электроны)
У атома олова 4 внешних электрона находятся на большом расстоянии от ядра, сила притяжения этих электронов к ядру невелика, поэтому атом кремния –металл (отдает электроны)
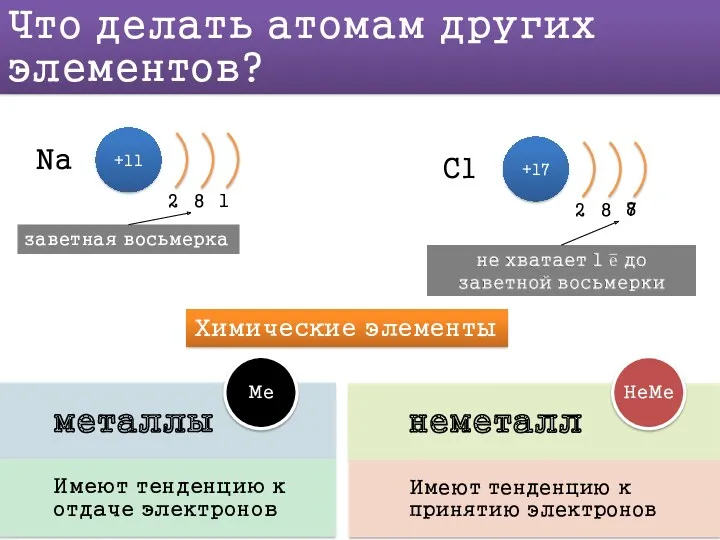
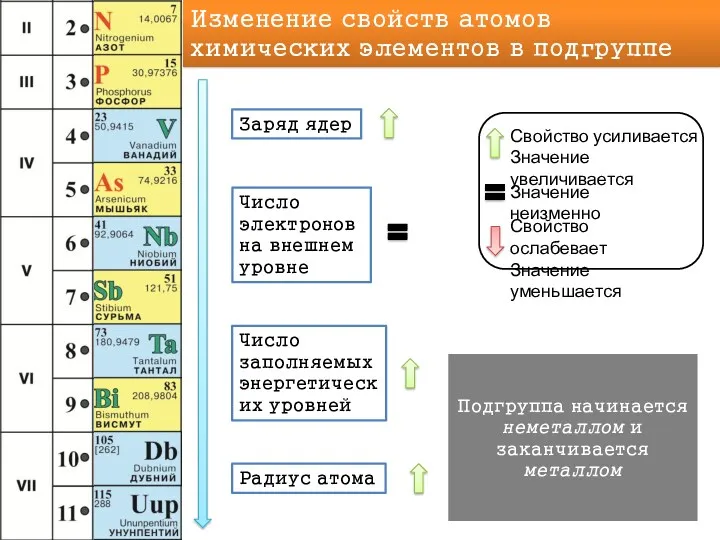
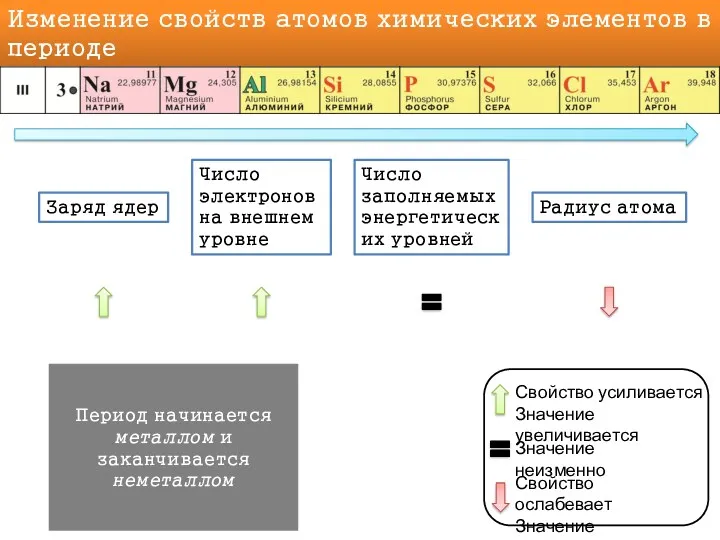
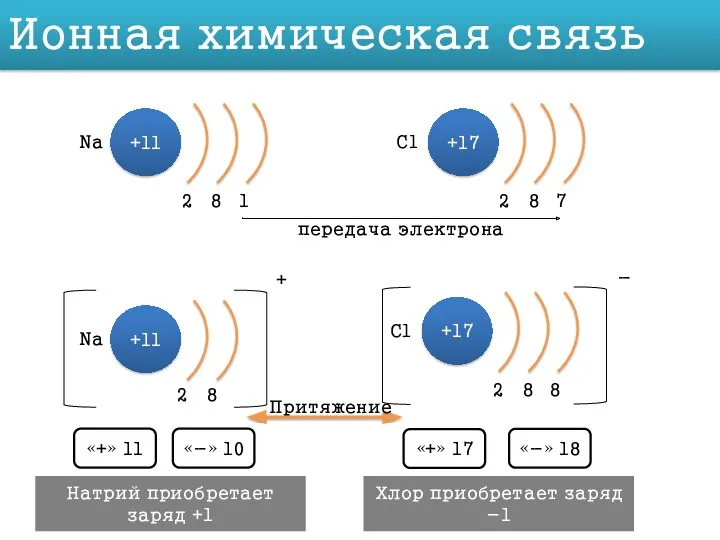
Вывод: способность принимать или отдавать электроны зависит не только от того, сколько электронов на внешнем уровне, но и от того, как далеко эти электроны находятся от ядра




 Цветные металлы и сплавы
Цветные металлы и сплавы Массовая доля вещества в растворе
Массовая доля вещества в растворе Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)
Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2) Анилин. Строение. Физические и химические свойства
Анилин. Строение. Физические и химические свойства Технология промышленных газов
Технология промышленных газов Химия вокруг нас
Химия вокруг нас Непредельные, ненасыщенные, ацетиленовые алкины
Непредельные, ненасыщенные, ацетиленовые алкины Перегонка с водяным паром
Перегонка с водяным паром Липиды. Классификация липидов
Липиды. Классификация липидов Основания. Номенклатура оснований
Основания. Номенклатура оснований Химические свойства металлов
Химические свойства металлов Процесс в химическом реакторе
Процесс в химическом реакторе Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева
Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Спирты
Спирты Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Тяжелые металлы
Тяжелые металлы Горение жидкостей
Горение жидкостей Определение фосфатов, железа, хлоридов
Определение фосфатов, железа, хлоридов Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Металлическая связь
Металлическая связь Химический состав воздуха
Химический состав воздуха Сладкая жизнь. Проектно-исследовательская работа
Сладкая жизнь. Проектно-исследовательская работа Хімічні явища в побуті
Хімічні явища в побуті Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)