Содержание
- 2. Основания – сложные вещества, в состав которых входят атомы металлов, соединенные с одной или нескольким группами
- 3. Номенклатура оснований Название основания = «Гидрооксид» + название Me + валентность (в скобках) NaOH, Ca(OH)2, Fe(OH)2
- 4. Классификация оснований
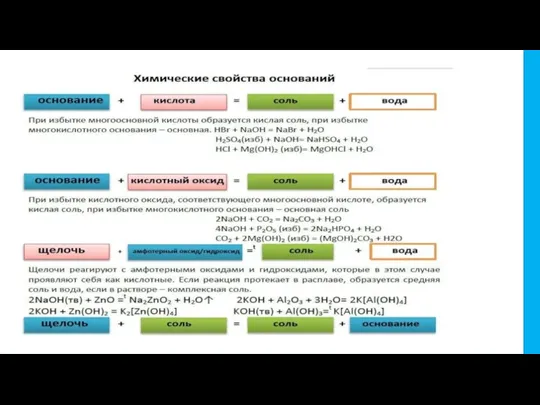
- 5. Химические свойства щелочей (Щ) 1.Водные растворы Щ изменяют окраску индикаторов, тем самым можно определить реакцию среды.
- 6. 2.Реакция нейтрализации NaOH + HCl → NaCl + H2O реакция характерна и для щелочей, и для
- 7. 4. Могут вступать в реакции с кислотными оксидами, при этом образуется нерастворимая соль и вода. Ca(OH)2
- 8. Химические свойства нерастворимых оснований 1.Так же как и щелочи, могут изменять окраску индикаторов. 2.Характерна реакция нейтрализации.
- 9. Химические свойства амфотерных гидроксидов ZnO — Zn(OH)2 ↔ H2ZnO2 Al2O3 — Al(OH)2 ↔ H3AlO3 GeO2 —
- 10. 2.При взаимодействии с кислотами образуется соль и вода. Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Zn(OH)2
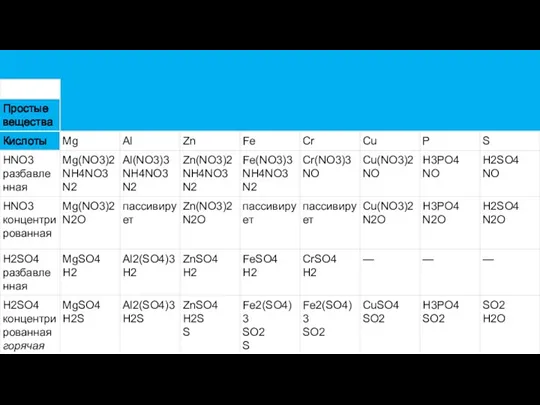
- 14. Химические свойства меди Медь (Cu) — элемент побочной подгруппы первой группы. Электронная формула: (...3d104s1). Десятый d-электрон
- 15. Химические свойства цинка При нагревании 1.Zn+Cl2→ZnCl2 2. 2Zn+O2→2ZnO 3. Zn+S→ZnS 4. Zn+2Н+=Zn2+ +H2↑ 5. ZnSO4+2NaOH=Zn(OH)2↓+Na2SO4 6.
- 16. Химические свойства хрома 1.Cr+2H+=Cr2+ +H2↑ 2. 4Cr(OH)2+O2+2H2O=4Cr(OH)3 3. Ему соответствует амфотерный оксид Cr2O3. Оксид и гидроксид
- 17. Химические свойства железа
- 18. Кислоты
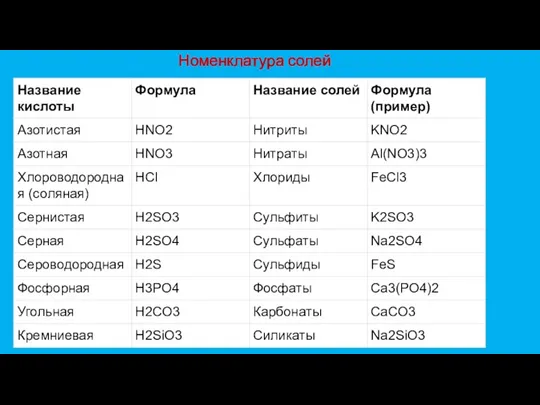
- 21. Номенклатура солей
- 25. Задание 7.1 В одну из пробирок с осадком гидроксида алюминия добавили сильную кислоту X, а в
- 26. Задание 7.2 В пробирку с раствором вещества X добавили несколько капель бесцветного раствора вещества Y. В
- 27. Задание 7.3 В пробирку с раствором соли X добавили по каплям раствор вещества Y. При этом
- 28. Задание 7.4 В пробирку с раствором соли X добавили несколько капель раствора вещества Y. В результате
- 29. Задание 7.5 В одну пробирку с раствором сульфата меди (II) добавили вещество X и в результате
- 30. Задание 7.6 В пробирку с раствором соли X добавили несколько капель раствора вещества Y. В результате
- 31. Задание 7.7 Даны две пробирки с соляной кислотой. В первую пробирку добавили нерастворимое в воде вещество
- 32. Задание 7.8 Даны две пробирки с раствором бромида железа (III). В первую пробирку добавили раствор сильного
- 33. Задание 7.9 Даны две пробирки с раствором гидрокарбоната натрия. В первую пробирку добавили раствор вещества X,
- 34. Задание 7.10 Даны две пробирки с раствором сульфата алюминия. В первую пробирку добавили раствор вещества X,
- 35. Задание 7.11 Даны две пробирки с раствором хлорида магния. В одну из них добавили раствор слабого
- 37. Скачать презентацию





























 Композиционные материалы для изоляции электрических машин
Композиционные материалы для изоляции электрических машин Milk Composition. Proteins - Молоко
Milk Composition. Proteins - Молоко 20231028_kislorod
20231028_kislorod Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Строение и свойства материалов
Строение и свойства материалов Соединения углерода
Соединения углерода Получение водорода. Проверка Н2 на чистоту. Практическая работа
Получение водорода. Проверка Н2 на чистоту. Практическая работа Азот в нашей жизни
Азот в нашей жизни Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Основные классы неорганических соединений
Основные классы неорганических соединений Химическая кинетика
Химическая кинетика Минералы и их свойства
Минералы и их свойства Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки
Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки Радиогеохимия экзогенных процессов
Радиогеохимия экзогенных процессов Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів
Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау Алкены (олефины). Лекция 3
Алкены (олефины). Лекция 3 Кислоты в свете ТЭД
Кислоты в свете ТЭД Химикаты для сельского хозяйства
Химикаты для сельского хозяйства Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан
Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Реакции деструкции макромолекул
Реакции деструкции макромолекул Степень окисления. Составление химических формул бинарных соединений
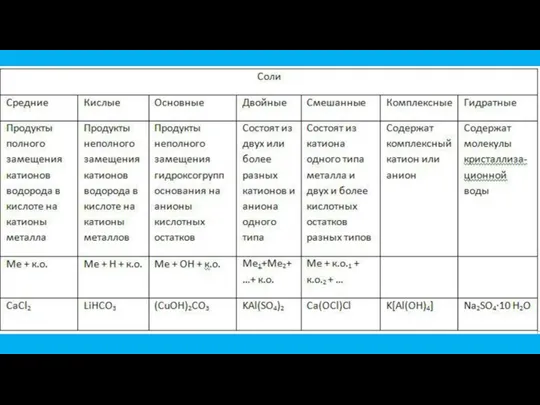
Степень окисления. Составление химических формул бинарных соединений Соли, их классификация и свойства
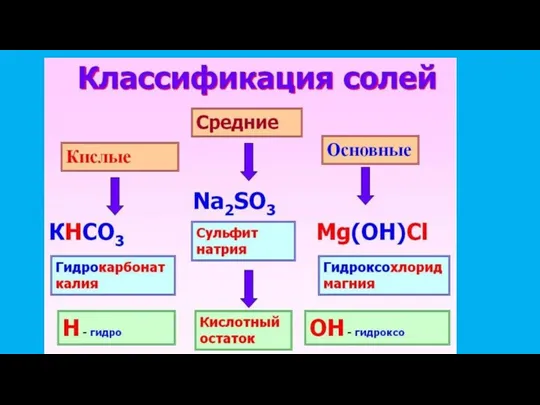
Соли, их классификация и свойства