Содержание
- 2. Азотсодержащие гетероциклические соединения - органические соединения, содержащие в своих молекулах циклы, в образовании которых принимают участие
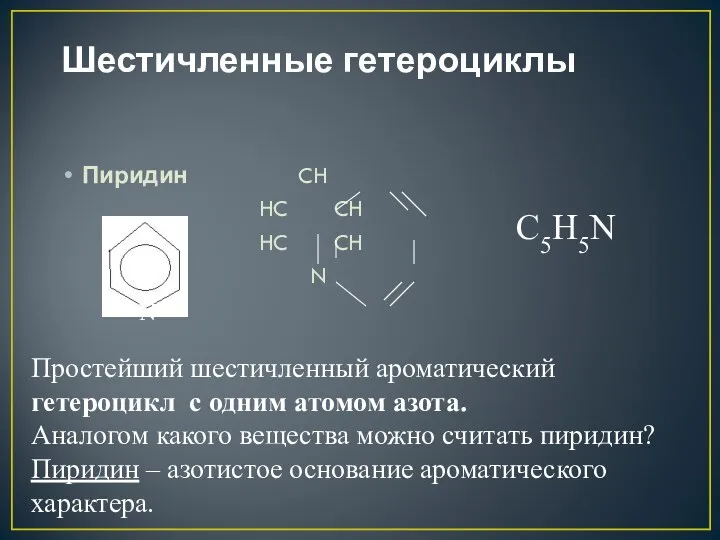
- 3. Шестичленные гетероциклы Пиридин CH HC CH HC CH N N Простейший шестичленный ароматический гетероцикл с одним
- 4. Строение пиридина По электронному строению напоминает бензол. Все атомы в sp2-гибридизации. Шесть негибридных электронов (по одному
- 5. Физические свойства и получение пиридина бесцветная жидкость, немного легче воды, с резким неприятным запахом, с водой
- 6. Химические свойства пиридина Чем определяются химические свойства пиридина? Наличием ароматической системы – реакции электрофильного замещения и
- 7. Химические свойства пиридина
- 8. Основные свойства пиридина Более слабое основание, чем алифатические амины. Водный раствор окрашивает лакмус в синий цвет.
- 9. Ароматические свойства пиридина Активность в реакциях электрофильного замещения ниже, чем бензола из-за большой электроотрицательности атома азота.
- 10. Ароматические свойства пиридина При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является
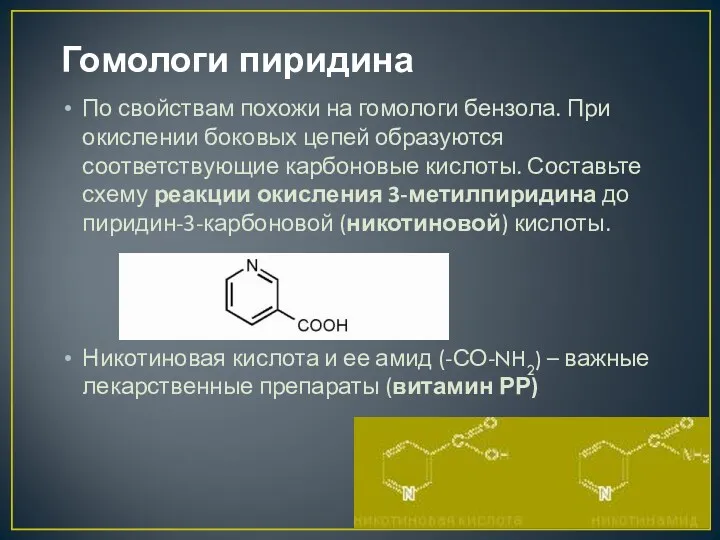
- 11. Гомологи пиридина По свойствам похожи на гомологи бензола. При окислении боковых цепей образуются соответствующие карбоновые кислоты.
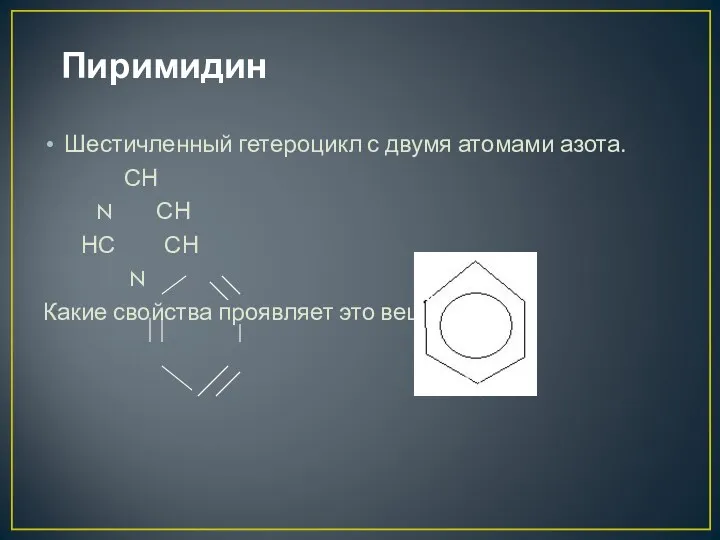
- 12. Пиримидин Шестичленный гетероцикл с двумя атомами азота. СН N СН НС СН N Какие свойства проявляет
- 13. Свойства пиримидина Благодаря наличию в кольце двух электроотрицательных атомов азота, пиридин менее активен в реакциях электрофильного
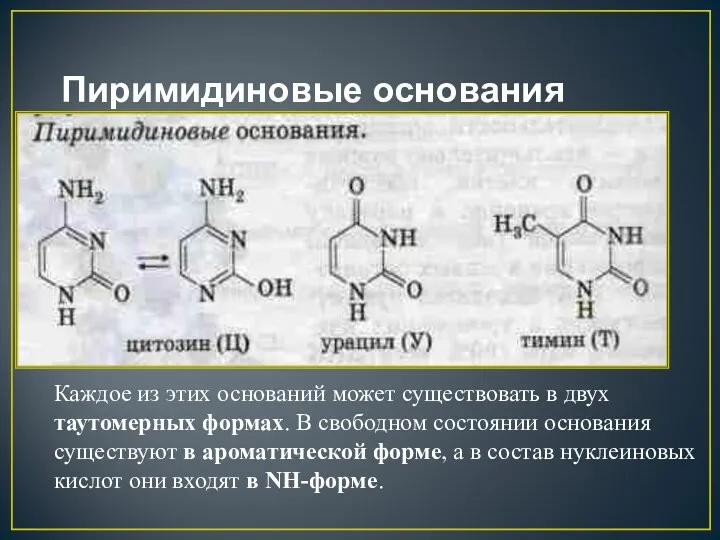
- 14. Пиримидиновые основания - производные пиримидина, остатки которых входят в состав нуклеиновых кислот: урацил тимин цитозин
- 15. Пиримидиновые основания Каждое из этих оснований может существовать в двух таутомерных формах. В свободном состоянии основания
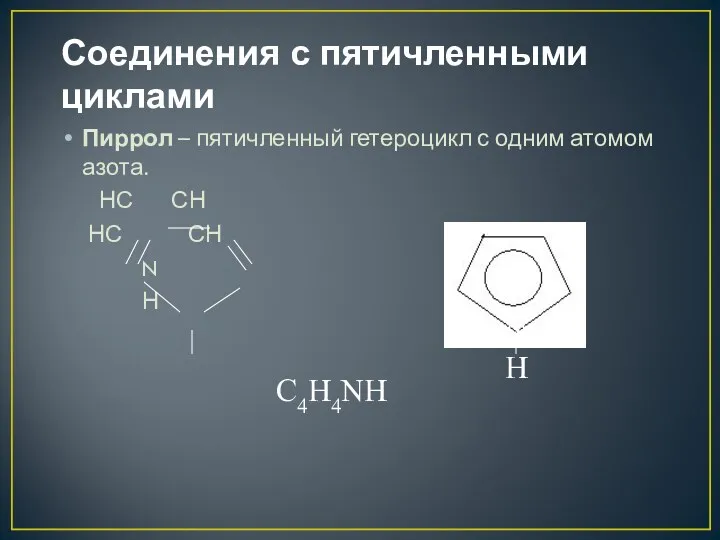
- 16. Соединения с пятичленными циклами Пиррол – пятичленный гетероцикл с одним атомом азота. НС СН НС СН
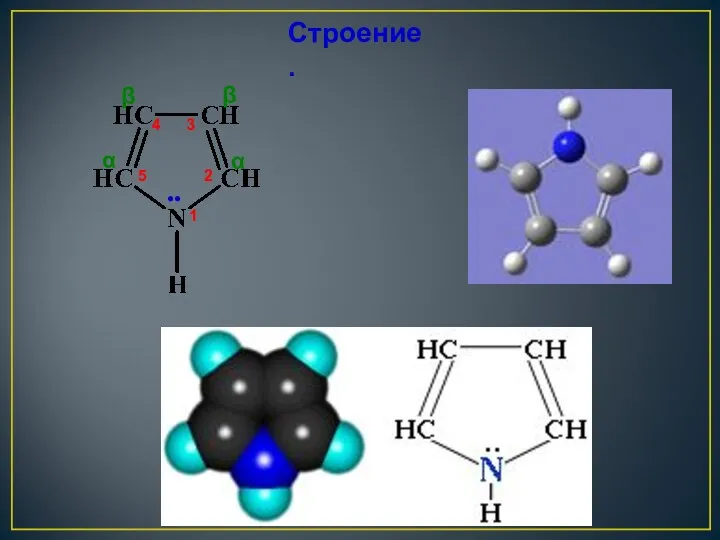
- 17. Строение молекулы пиррола Атомы углерода и атом азота находятся в состоянии в sp2-гибридизации. Четыре негибридизованных электрона
- 18. 4 5 1 2 3 ●● α α β β Строение.
- 19. Физические свойства пиррола Бесцветная жидкость Запах напоминает запах хлороформа Слабо растворим в воде ( Растворим в
- 20. Получение пиррола Конденсацией ацетилена с аммиаком 2НС СН + NH3 C4H4NH + H2 Перегонка амида янтарной
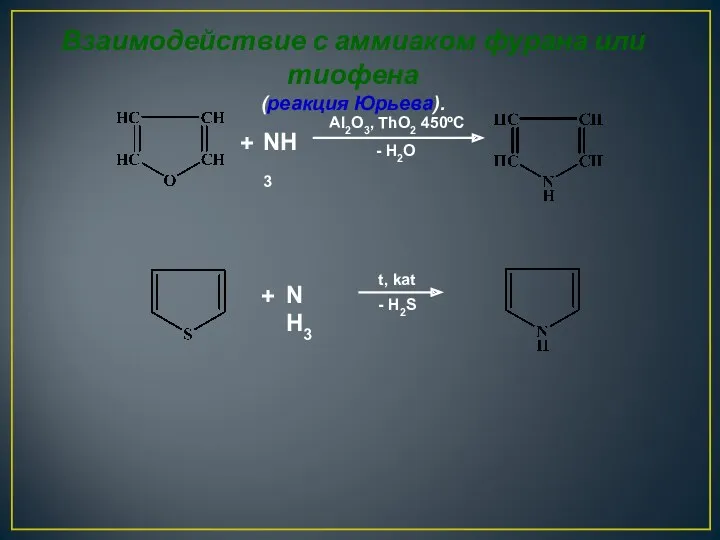
- 21. + NH3 - H2O Al2O3, ThO2 450ºC + NH3 - H2S t, kat Взаимодействие с аммиаком
- 22. Химические свойства пиррола В кислой среде неустойчив: сильные минеральные кислоты могут вытягивать электронную пару атома азота
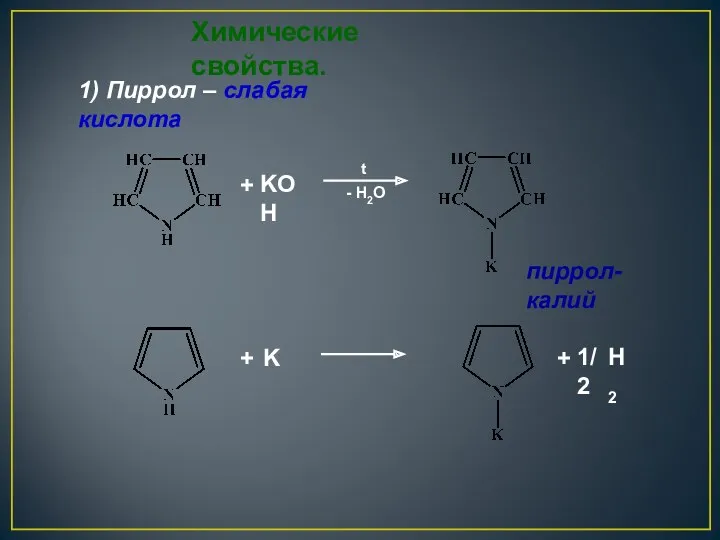
- 23. + + K KOH - H2O t + Химические свойства. 1) Пиррол – слабая кислота пиррол-калий
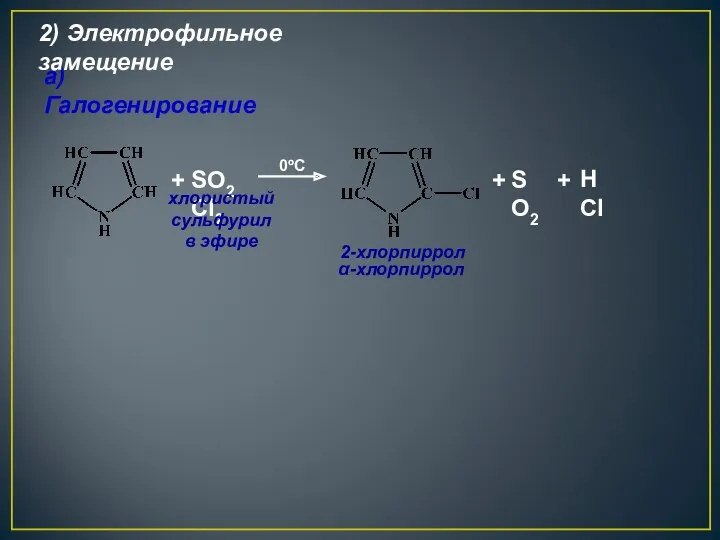
- 24. + SO2Cl2 0ºС а) Галогенирование 2-хлорпиррол α-хлорпиррол хлористый сульфурил в эфире 2) Электрофильное замещение
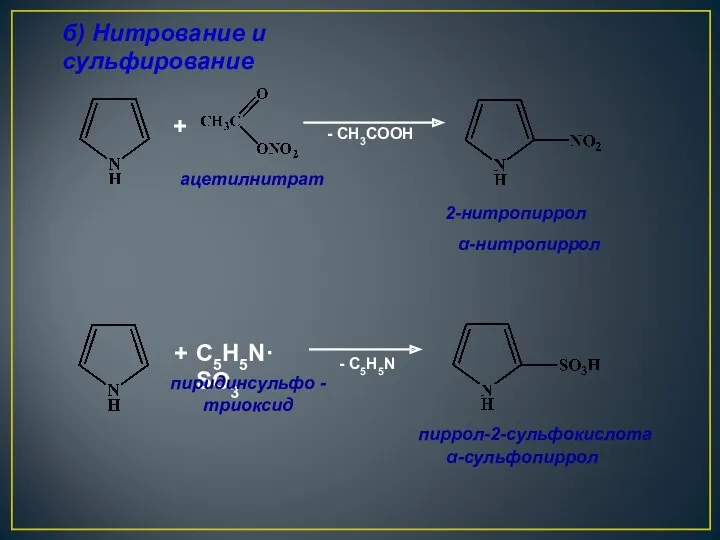
- 25. + - CH3COOH + C5H5N·SO3 - C5H5N б) Нитрование и сульфирование ацетилнитрат 2-нитропиррол пиридинсульфо - триоксид
- 26. Химические свойства пиррола При гидрировании пиррола образуется пирролидин – циклический вторичный амин, проявляющий основные свойства. Составьте
- 27. H2O H2O H2S NH3 H2S NH3 Взаимопревращения гетероциклических соединений Реакции Юрьева Al2O3, ThO2 450-500°С
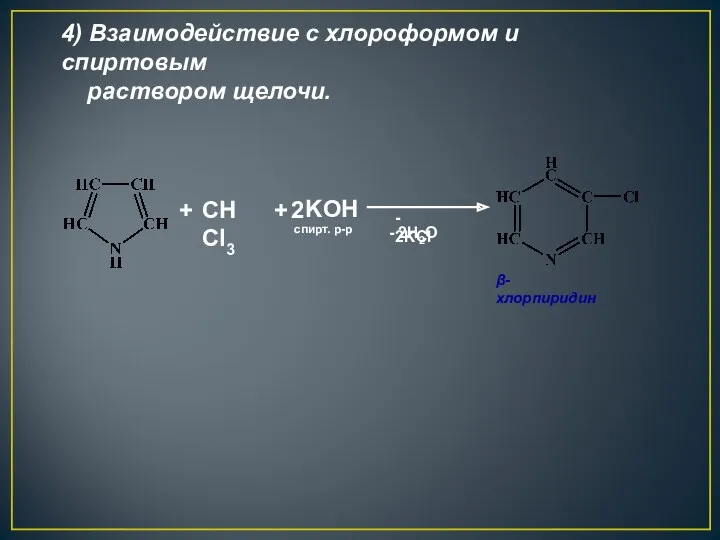
- 28. + CHCl3 + 2 KOH - 2H2O - 2KCl спирт. р-р β-хлорпиридин 4) Взаимодействие с хлороформом
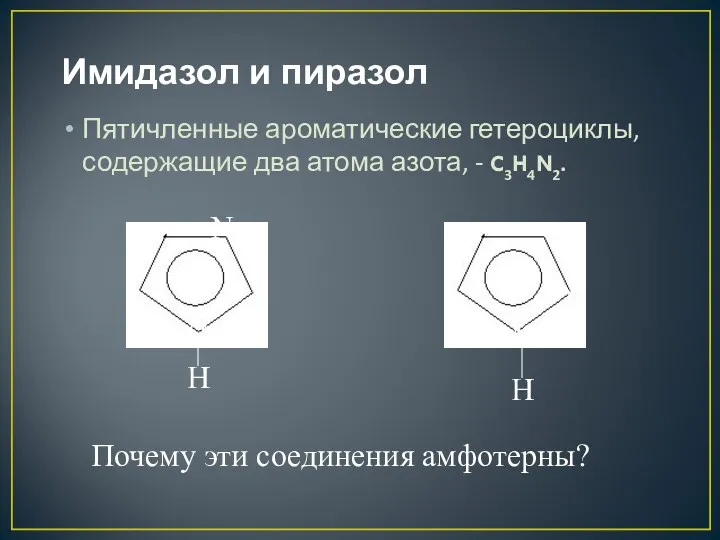
- 29. Имидазол и пиразол Пятичленные ароматические гетероциклы, содержащие два атома азота, - C3H4N2. N H N H
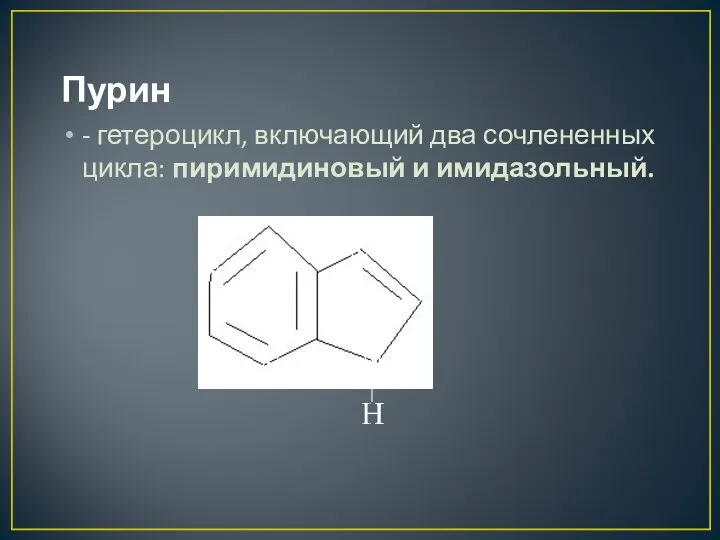
- 30. Пурин - гетероцикл, включающий два сочлененных цикла: пиримидиновый и имидазольный. N H N N N
- 31. Строение и свойства пурина Ароматическая система пурина включает в себя 10 пи-электронов (8 электронов двойных связей
- 32. Пуриновые основания производные пурина, остатки которых входят в состав нуклеиновых кислот: аденин, гуанин. Могут ли пуриновые
- 34. Скачать презентацию


















 Органическая химия в ряду других наук
Органическая химия в ряду других наук Типы химических реакций
Типы химических реакций Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Чистые вещества и смеси
Чистые вещества и смеси Металлы – простые вещества
Металлы – простые вещества Цинк и его соединения
Цинк и его соединения Особенности химического состава клетки
Особенности химического состава клетки Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Пищевые добавки
Пищевые добавки Растворы. Приготовление растворов
Растворы. Приготовление растворов Группа редкоземельных элементов
Группа редкоземельных элементов Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс
Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс Самородные элементы
Самородные элементы Магия кристаллов
Магия кристаллов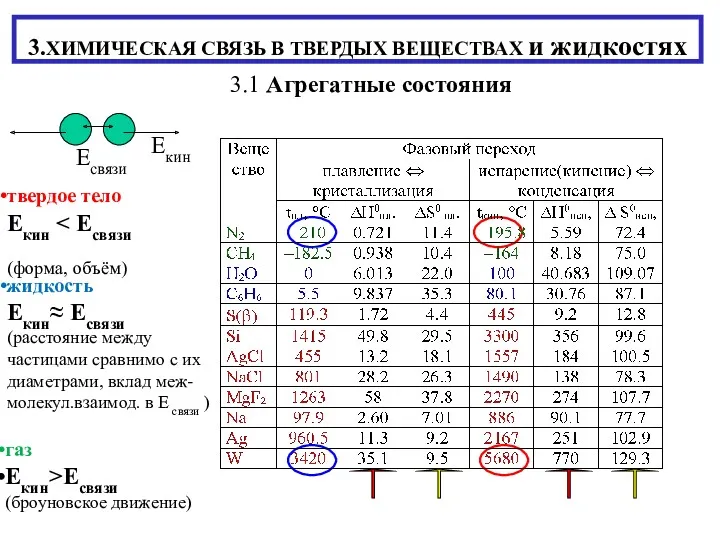 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Электролитическая диссоциация
Электролитическая диссоциация Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Алюминий и его соединения
Алюминий и его соединения Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Общая теория протолитических равновесий и процессов. Буферные системы
Общая теория протолитических равновесий и процессов. Буферные системы Равновесие в реакциях гидролиза. Лекция 6
Равновесие в реакциях гидролиза. Лекция 6