Содержание
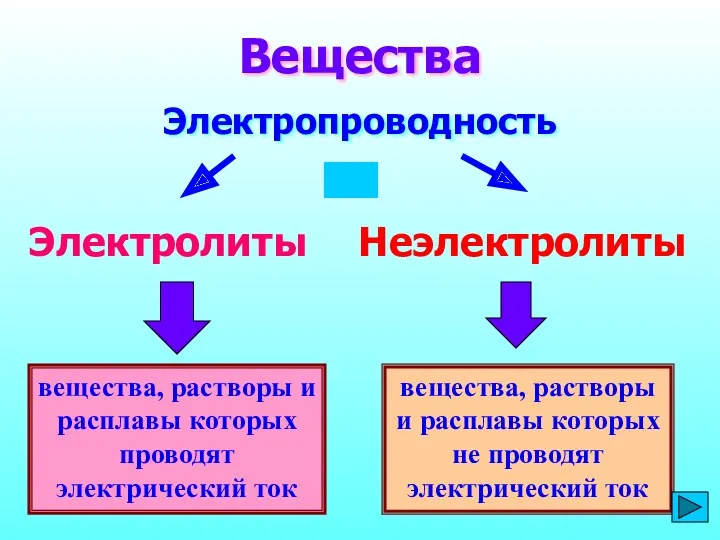
- 3. вещества, растворы и расплавы которых проводят электрический ток Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы
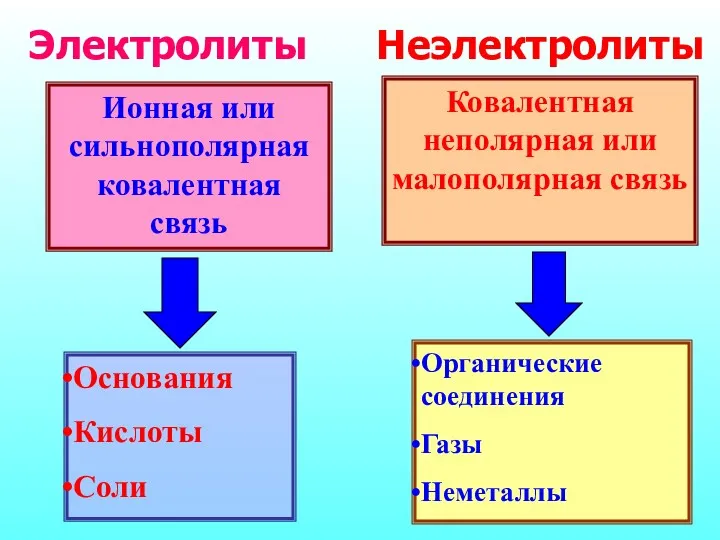
- 4. Ионная или сильнополярная ковалентная связь Основания Кислоты Соли Ковалентная неполярная или малополярная связь Органические соединения Газы
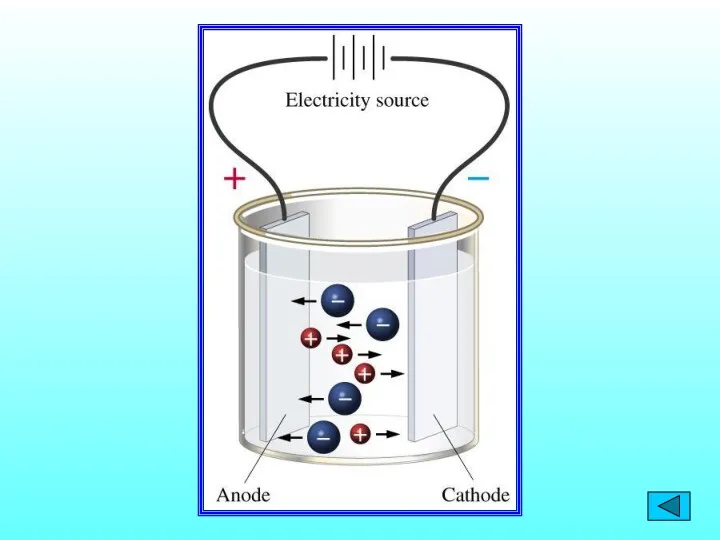
- 5. Теория электролитической диссоциации С. А. Аррениус (1859-1927) процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить
- 6. 1. Электролиты при растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация.
- 9. Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая
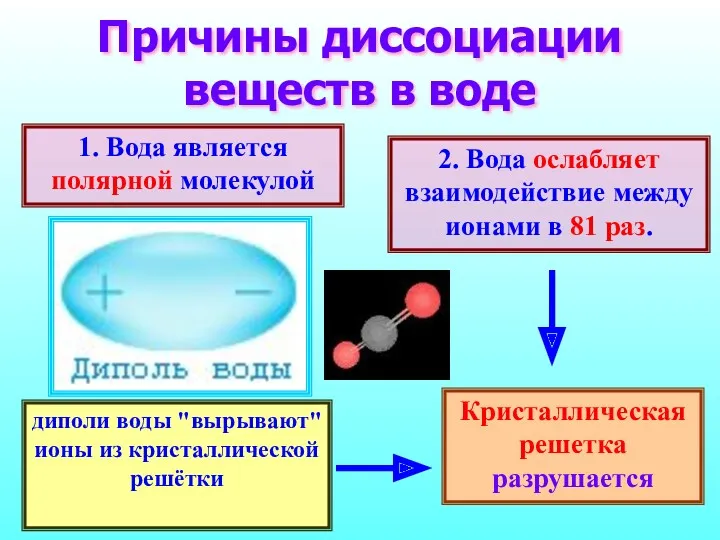
- 10. Причины диссоциации веществ в воде 1. Вода является полярной молекулой 2. Вода ослабляет взаимодействие между ионами
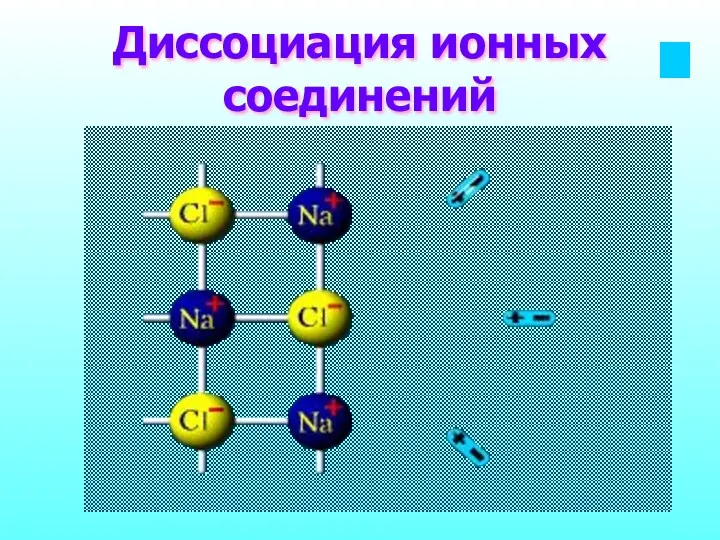
- 11. Диссоциация ионных соединений
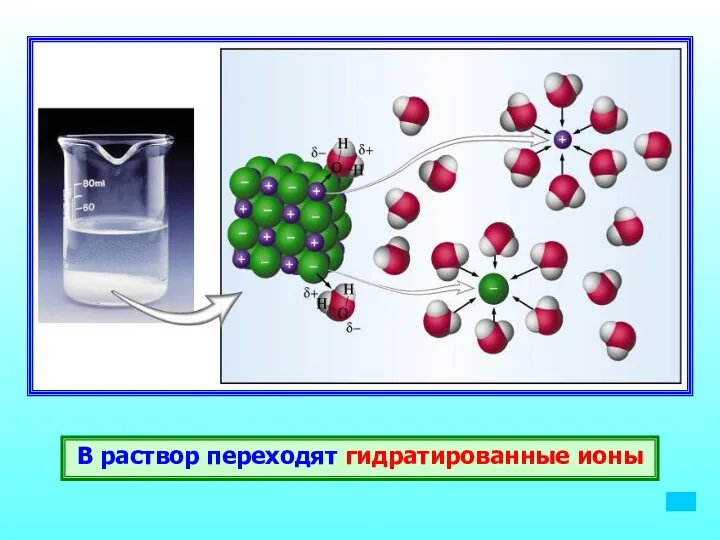
- 12. В раствор переходят гидратированные ионы
- 13. Диссоциация соединений с КП связью
- 14. Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения
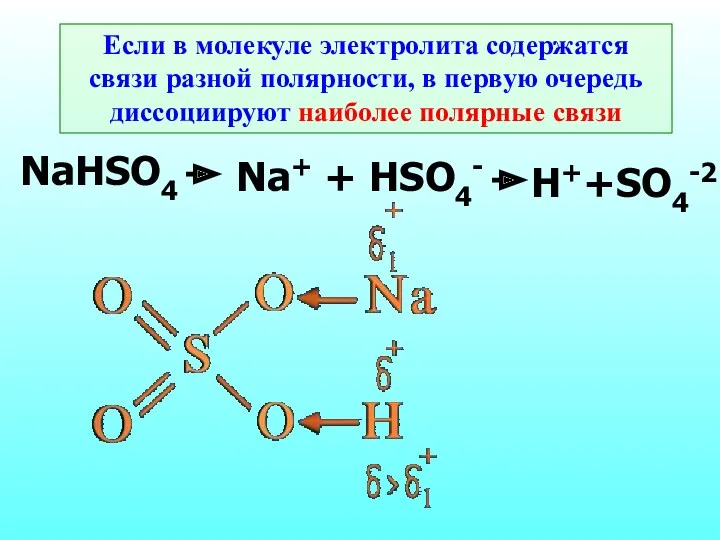
- 15. Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи NaHSO4
- 16. Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
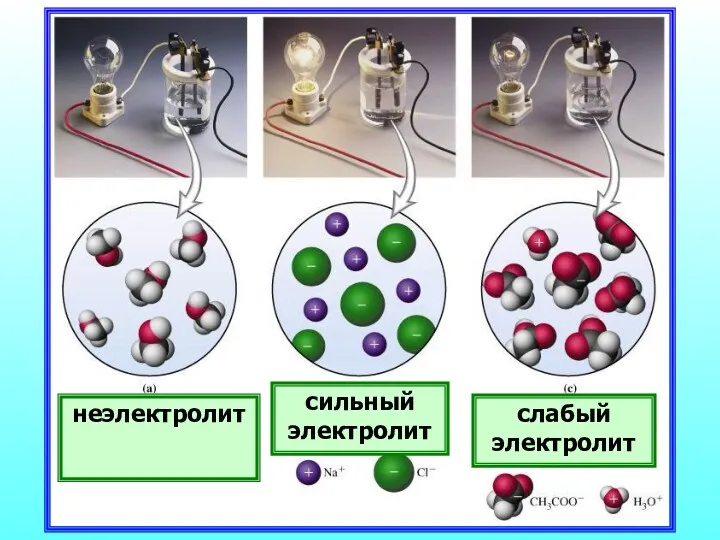
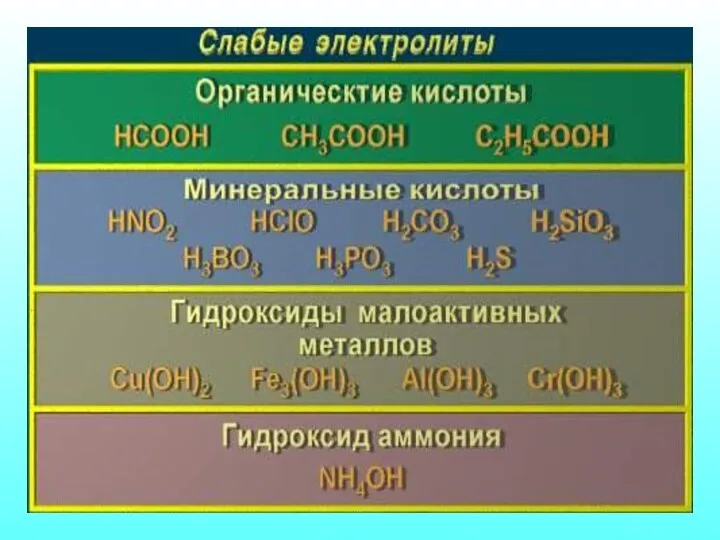
- 18. неэлектролит сильный электролит слабый электролит
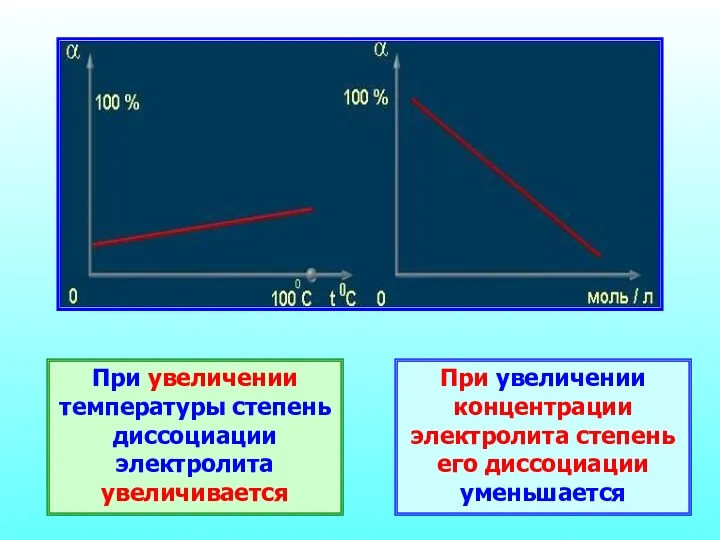
- 22. При увеличении температуры степень диссоциации электролита увеличивается При увеличении концентрации электролита степень его диссоциации уменьшается
- 24. Скачать презентацию











 Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM)
Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM) Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Розв’язування задач на приготування розчинів із кристалогідратів
Розв’язування задач на приготування розчинів із кристалогідратів Предмет и задачи физической химии
Предмет и задачи физической химии Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення
Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення Коррозия металлов. Способы защиты металлов от коррозии
Коррозия металлов. Способы защиты металлов от коррозии Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування
Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування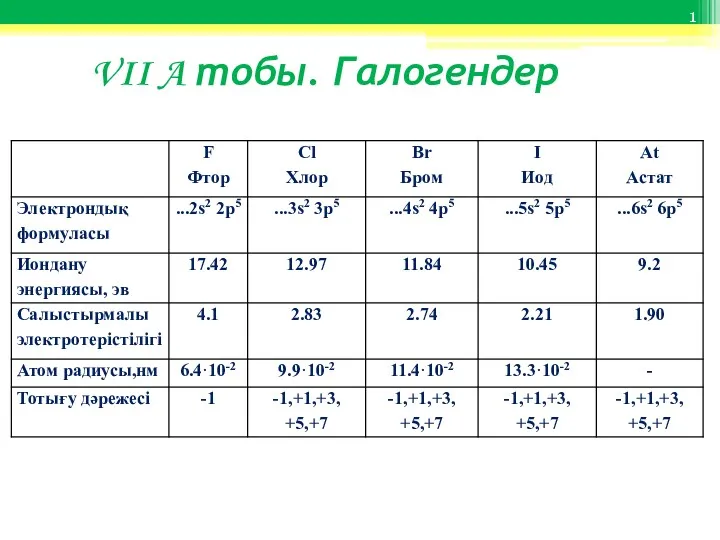 VII A тобы. Галогендер
VII A тобы. Галогендер Скорость химических реакций
Скорость химических реакций Аллотропные модификации алмаза
Аллотропные модификации алмаза Способы выражения концентрации растворов
Способы выражения концентрации растворов Спирты (алканолы)
Спирты (алканолы) Строение атома. 10 ен
Строение атома. 10 ен Строение и функции биополимеров
Строение и функции биополимеров Соли аммония
Соли аммония Обмен липидов. Классификация липидов
Обмен липидов. Классификация липидов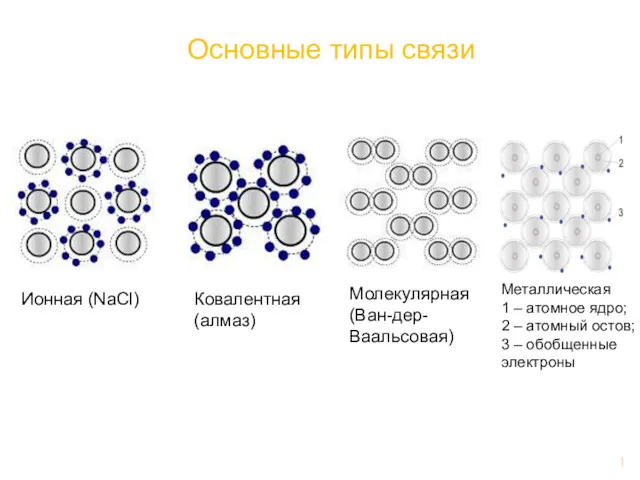 Основные типы связи
Основные типы связи Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Шкала не Мооса
Шкала не Мооса Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості
Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Взрывчатые вещества, их история и применение
Взрывчатые вещества, их история и применение Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1 Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Щёлочноземельные металлы
Щёлочноземельные металлы