Содержание
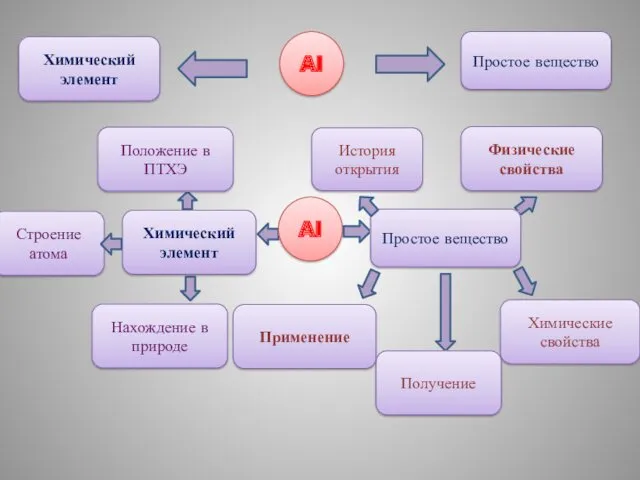
- 2. Химический элемент Al Простое вещество Al Химический элемент Положение в ПТХЭ Строение атома Нахождение в природе
- 3. Алюминий - химический элемент положение в периодической системе и строение атома 1. Химический знак (металл или
- 4. Al (металл) Ar= 27 13 III Нечётный III А (главная) Алюминий - химический элемент положение в
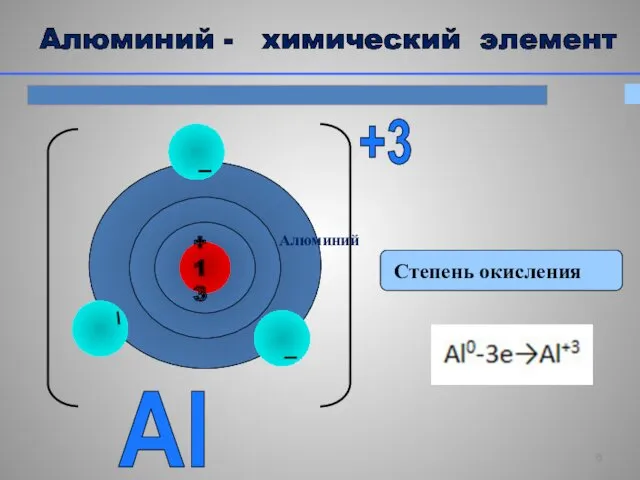
- 5. Алюминий - строение атома Al 27 +13 0 2 8 3 P = 13 e =
- 6. Степень окисления Al +3 Алюминий
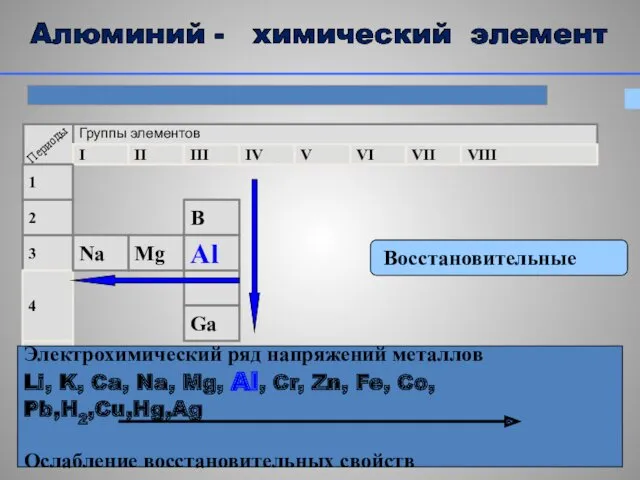
- 7. Восстановительные Электрохимический ряд напряжений металлов Li, K, Ca, Na, Mg, Al, Cr, Zn, Fe, Co, Pb,H2,Cu,Hg,Ag
- 8. Металлические Mg>Al 3 13 ē нет 3 +13
- 9. Алюминий – самый распространенный в природе элемент, по содержанию в земной коре (8%) находится на третьем
- 10. Бокситы – Al2O3 • H2O Нефелины – KNa3[AlSiO4]4 Глиноземы - Al2O3 Be3Al2Si6O18 Берилл Гранат Ca3Al2(SiO4)3
- 11. физические свойства Возьмите алюминиевую проволоку, рассмотрите ее, попробуйте изменить ее форму. На основании наблюдения и вашего
- 12. Алюминий как простое вещество химические свойства Если поверхность алюминия потереть солью ртути, то происходит реакция: 2Al
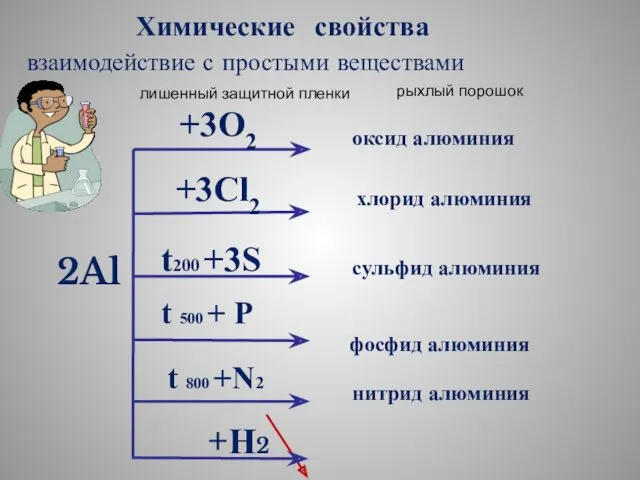
- 13. 2Al +3O2 оксид алюминия +3Cl2 хлорид алюминия t200 +3S сульфид алюминия фосфид алюминия +Н2 нитрид алюминия
- 14. взаимодействие с водой Если в отсутствии воздуха удалить с поверхности алюминия оксидную пленку, то он активно
- 15. Химические свойства взаимодействие со сложными веществами 2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O 2.
- 16. взаимодействие со щелочами 2Al + 2NaOH + 6H2O=2Na[Al(OH)4] + 3H2 1. 2NaOH + Al2O3 + 3H2O=2Na[Al(OH)4]
- 17. 8Al + 3Fe3O4 = 9Fe + 4Al2O3 8 Al0 - 3ē → Al+3 – окисление, восстановитель
- 18. Получение алюминия в промышленности Алюминий получают электрохимическим методом из бокситов. 2Al2O3 ток> 4Al + 3O2
- 19. Алюминий
- 20. Авиастроение Применение Al и его сплавов во всех видах транспорта, а в особенности воздушного привело к
- 21. Кораблестроение Al и его сплавы применяют при отделке и изготовлении корпусов и дымовых труб судов, спасательных
- 22. Пищевая промышленность Алюминиевая фольга – упаковочный материал для пищевых продуктов. Алюминиевая тара используется для консервирования и
- 23. Машиностроение Моторы, блоки, головки цилиндров, картеры, коробки передач, насосы и многие другие детали также изготавливают из
- 24. Электротехника Алюминий и его сплавы используют в электротехнической промышленности для изготовления кабелей, шинопроводов, конденсаторов, выпрямителей переменного
- 25. Соединения алюминия. Оксид Очень твердый порошок белого цвета. Образуется: а) при окислении или горении алюминия: 4Al
- 26. Химические свойства оксида алюминия Взаимодействует: а) с кислотами: Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O Al2O3
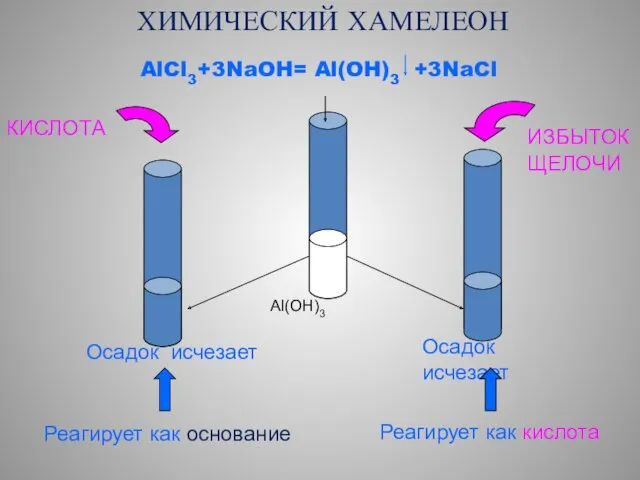
- 27. ХИМИЧЕСКИЙ ХАМЕЛЕОН AlCl3+3NaOH= Al(OH)3 +3NaCl Al(OH)3 КИСЛОТА ИЗБЫТОК ЩЕЛОЧИ Осадок исчезает Реагирует как основание Осадок исчезает
- 28. Амфотерный гидроксид Как основание: Al(OH)3 + 3HCl → AlCl3 + 3H2O Как кислота Al(OH)3 + NaOH
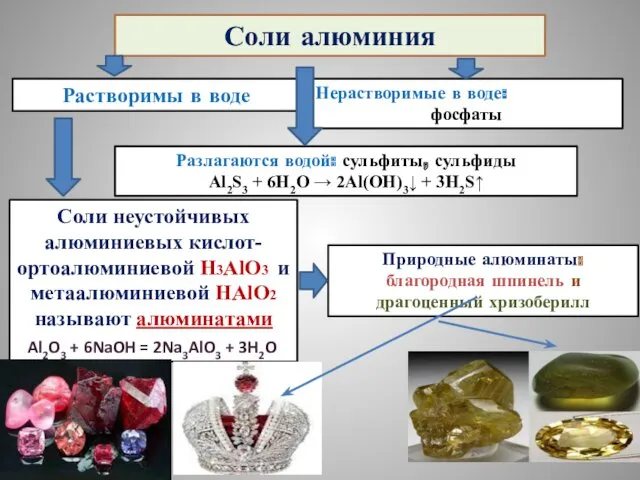
- 29. Соли алюминия Растворимы в воде Нерастворимые в воде: фосфаты Разлагаются водой: сульфиты, сульфиды Al2S3 + 6H2O
- 31. Скачать презентацию





![Бокситы – Al2O3 • H2O Нефелины – KNa3[AlSiO4]4 Глиноземы - Al2O3 Be3Al2Si6O18 Берилл Гранат Ca3Al2(SiO4)3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/110801/slide-9.jpg)




![взаимодействие со щелочами 2Al + 2NaOH + 6H2O=2Na[Al(OH)4] + 3H2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/110801/slide-15.jpg)











 Липиды
Липиды Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Глицерин. Свойства и применение
Глицерин. Свойства и применение Крекинг нефти
Крекинг нефти Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи
Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи Химическая связь
Химическая связь Приготовление растворов солей с определенной массовой долей растворенного вещества
Приготовление растворов солей с определенной массовой долей растворенного вещества Вода – это жизнь!
Вода – это жизнь! The production of stable isotopes
The production of stable isotopes Молибден. Нахождение в природе
Молибден. Нахождение в природе Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Аммиак
Аммиак Что нас объединяет?
Что нас объединяет? Таблицы. Определение характера оксидов
Таблицы. Определение характера оксидов Основи
Основи Методы оценки плотности и вязкости нефтей и нефтепродуктов
Методы оценки плотности и вязкости нефтей и нефтепродуктов Ионное произведение воды. Водородный показатель
Ионное произведение воды. Водородный показатель Ионы и ионная химическая связь
Ионы и ионная химическая связь Металлы главных подгрупп
Металлы главных подгрупп Производство извести
Производство извести Металлы. Свойства металлов
Металлы. Свойства металлов Химия. D-элементтер
Химия. D-элементтер Методы определения вязкости жидкости
Методы определения вязкости жидкости Химический состав клетки
Химический состав клетки Основні класи неорганічних сполук
Основні класи неорганічних сполук Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины