Содержание
- 2. УМК «ХИМИЯ» Тема лекции: Химическая связь Лектор – Иванов М.Г. Разработчик – Данилова Д.А.
- 3. Цель лекции: изложение проблемы химической связи и строения молекул в рамках современной химической теории Компетенции, формируемые
- 4. СОДЕРЖАНИЕ Виды химической связи Ковалентная связь квантово-механическое описание строения молекул метод валентных схем механизмы образования ковалентной
- 5. Химическая связь Химическая связь – это различные виды взаимодействия, обуславливающие устойчивое существование многоатомных соединений (молекул, ионов,
- 6. Ковалентная связь Квантово-механическое описание строения молекул В основе лежит решение волнового уравнения Шредингера для соответствующей системы.
- 7. Ковалентная связь Квантово-механическое описание строения молекул Образование химической связи между атомами в молекуле Н2 обусловлено тем,
- 8. Ковалентная связь Метод валентных связей (ВС) В основе метода ВС лежат следующие допущения Ковалентная химическая связь
- 9. Ковалентная связь Механизмы образования ковалентной связи 1. Обменный механизм Атомы предоставляют на образование химической связи одноэлектронные
- 10. Ковалентная связь Свойства связи Энергия связи Длина связи Направленность химической связи Кратность связи Насыщаемость связи Полярность
- 11. Ковалентная связь 1. Энергия связи Энергия связи – энергия, которая выделяется при образовании химической связи из
- 12. Ковалентная связь 3. Направленность химической связи Поскольку электронные орбитали направлены в про-странстве определенным образом, то и
- 13. Ковалентная связь Геометрия простейших молекул SF2 S ... 3s2 3p4 F ... 2s2 2p5 F ...
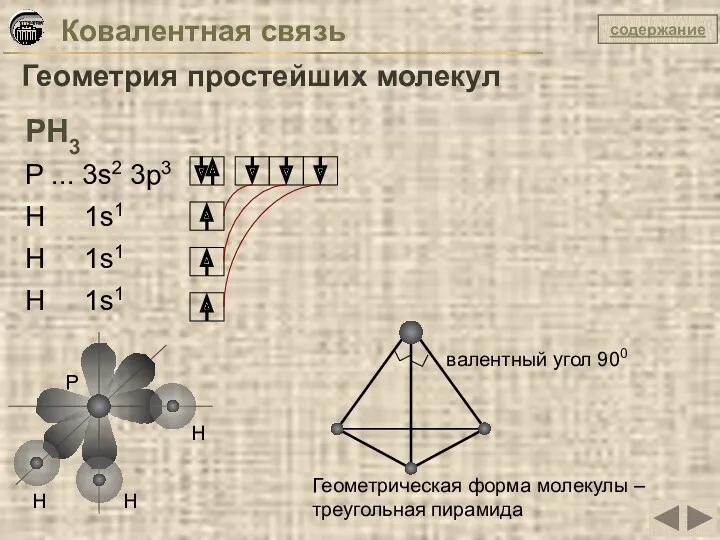
- 14. Ковалентная связь Геометрия простейших молекул РН3 Р ... 3s2 3p3 Н 1s1 Н 1s1 Н 1s1
- 15. Гибридизация – это представление о выравнивании валентных атомных орбиталей по форме и по энергии Ковалентная связь
- 16. Ковалентная связь Гибридизация BeCl2 Be ...2s2 Be* ...2s1 2p1 Be* - может образовать две связи по
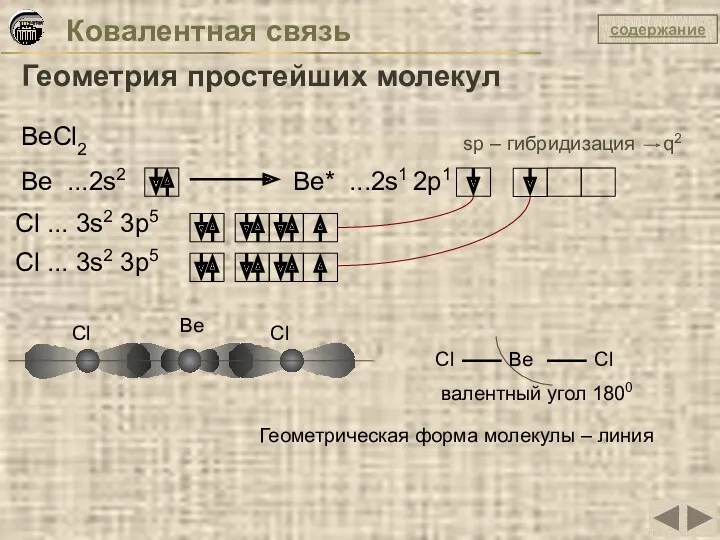
- 17. Ковалентная связь Геометрия простейших молекул BeCl2 Be ...2s2 Be* ...2s1 2p1 Сl ... 3s2 3p5 Cl
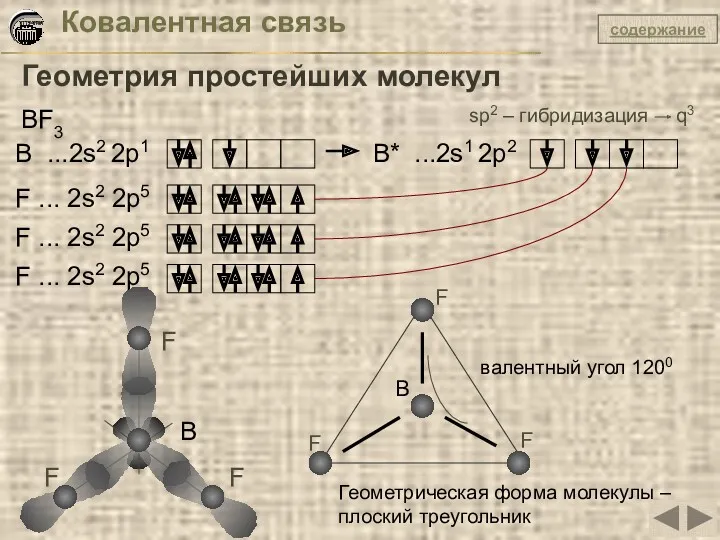
- 18. Ковалентная связь Геометрия простейших молекул BF3 B ...2s2 2p1 B* ...2s1 2p2 F ... 2s2 2p5
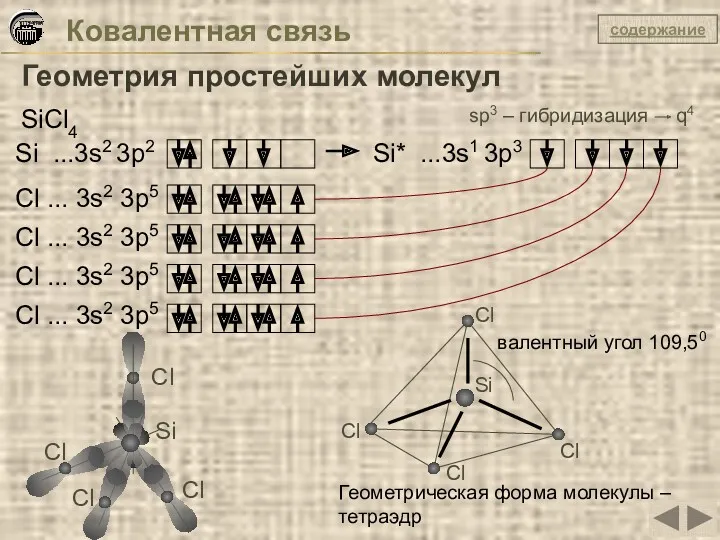
- 19. Ковалентная связь Геометрия простейших молекул SiCl4 Si ...3s2 3p2 Si* ...3s1 3p3 Cl ... 3s2 3p5
- 20. Ковалентная связь Геометрия простейших молекул содержание
- 21. Ковалентная связь 4. Кратность связи В зависимости от способа перекрывания электронных облаков различают σ-, π-, δ-связи
- 22. Ковалентная связь π – связь р - р d - р d - d Условное обозначение
- 23. Ковалентная связь π – связь N2 N ...2s2 2p3 N ...2s2 2p3 N N π σ
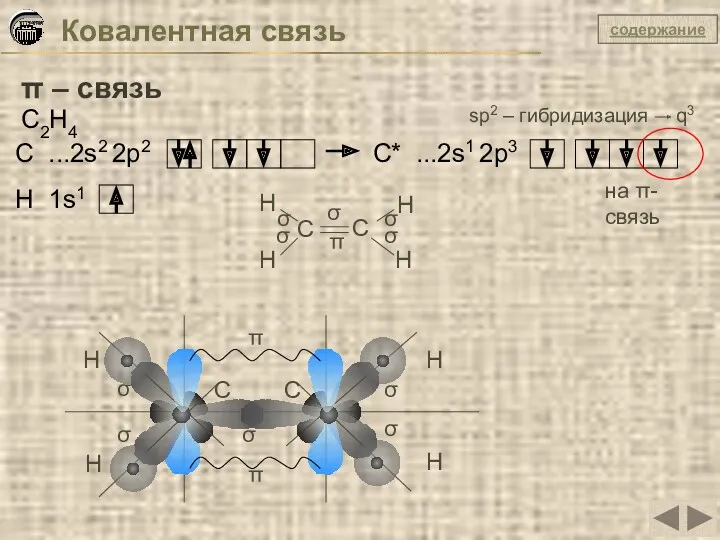
- 24. Ковалентная связь π – связь C2H4 C ...2s2 2p2 C* ...2s1 2p3 sp2 – гибридизация q3
- 25. Ковалентная связь 5. Насыщаемость связи. Валентность. Насыщаемость – способность атома взаимодействовать только с определенным числом атомов
- 26. Ковалентная связь Валентные возможности элементов I период H 1s1 1 ковалентная связь обменный механизм В =
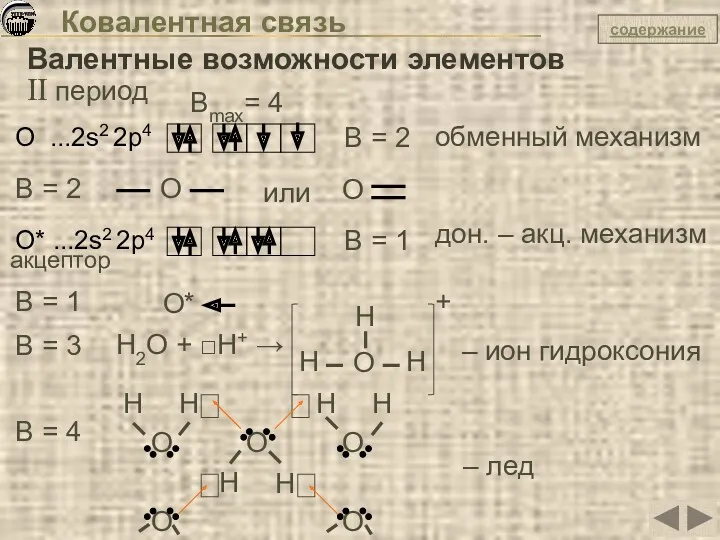
- 27. Ковалентная связь Валентные возможности элементов II период Be ...2s2 Be* ...2s1 2p1 2 ковалентные связи по
- 28. Ковалентная связь Валентные возможности элементов II период C ...2s2 2p2 C* ...2s1 2p3 Вmax=4 C C
- 29. Ковалентная связь Валентные возможности элементов II период О ...2s2 2p4 B = 2 обменный механизм Вmax=
- 30. Ковалентная связь Валентные возможности элементов III период s p d – 9 валентных орбиталей Практически В
- 31. Ковалентная связь Валентные возможности элементов Координационное число – число атомов соседей данного элемента max к.ч. =
- 32. Ковалентная связь Правила составления валентных схем Оценить валентные возможности всех атомов в данном соединении в невозбужденном
- 33. Ковалентная связь Правила составления валентных схем 4. В молекулах кислот водород всегда присоединяется к кислотообразующему элементу
- 34. Ковалентная связь Правила составления валентных схем Cl2O7 Cl ... 3s2 3p5 О ...2s2 2p4 О* ...2s2
- 35. Ковалентная связь 6. Полярность связи. Полярность молекул. Степень окисления элементов. Неполярная ковалентная связь – связь, образованная
- 36. Ковалентная связь Полярность молекул. Если молекула обладает собственным постоянным дипольным моментом, то такая молекула полярна. Для
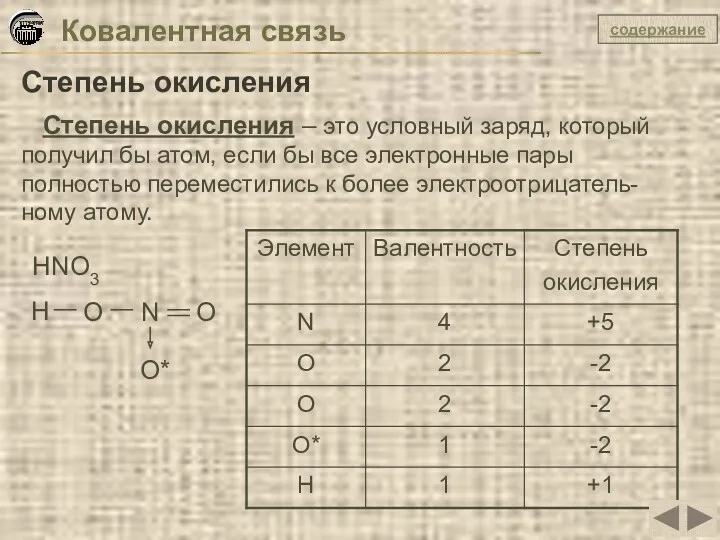
- 37. Ковалентная связь Степень окисления Степень окисления – это условный заряд, который получил бы атом, если бы
- 38. Ионная связь Осуществляется путем электростатического взаимо-действия между ионами. Ионная связь предельный случай ковалентной полярной связи, когда
- 39. Металлическая связь Связь между положительно заряженными остовами атомов осуществляется коллек-тивом валентных электронов, относи-тельно свободно перемещающихся по
- 40. Водородная связь Связь через атом водорода сильно электроотрицатель-ных атомов, имеющих очень малые радиусы (F, O, N).
- 41. Силы межмолекулярного взаимодействия Природа этих сил определяется электростатическим взаимодействием диполей 1. Ориентационное взаимодействие взаимодействие между полярными
- 42. Учение о химической связи – основополагающая проблема современной химии. Знание о природе взаимодействия атомов в веществе,
- 43. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н. Л. Глинка ; под ред. А.
- 45. Скачать презентацию


































 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов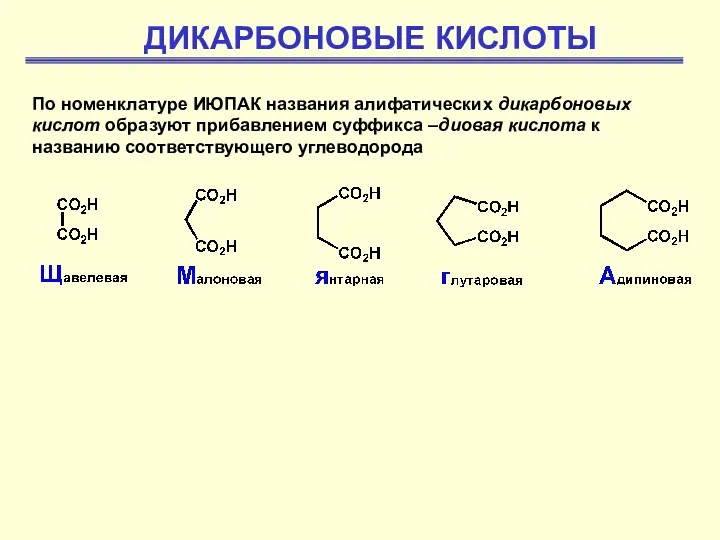 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка