Содержание
- 2. План лекции Классификация кислот и оснований. Понятие о протолитических реакциях. Буферные системы и механизм их действия.
- 3. Теории кислот и оснований
- 4. Теория электролитической диссоциации Аррениуса - Оствальда Кислоты - это вещества, образующие в водном растворе гидратированные катионы
- 5. Теория электролитической диссоциации Аррениуса - Оствальда Основания - вещества, диссоциирующие в водном растворе с образованием катионов
- 6. Протонная (протолитическая) теория Брёнстеда – Лоури (Лаури) (1923) Йоханнес-Николаус Брёнстед 1879 - 1947 - датский физикохимик.
- 7. Кислота – молекула или ион способные отдавать катион водорода (протон - H+). Кислота - донор протонов.
- 8. Основание – молекула или ион, способный присоединять катион водорода. Основание – акцептор протонов. Основание, присоединяя протон,
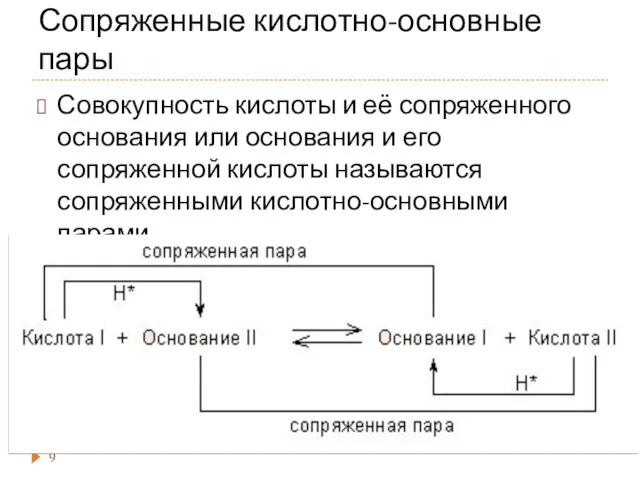
- 9. Сопряженные кислотно-основные пары Совокупность кислоты и её сопряженного основания или основания и его сопряженной кислоты называются
- 10. Амфолиты Амфолиты – молекулы или ионы, способные как отдавать, так и присоединять протон, а следовательно, вступать
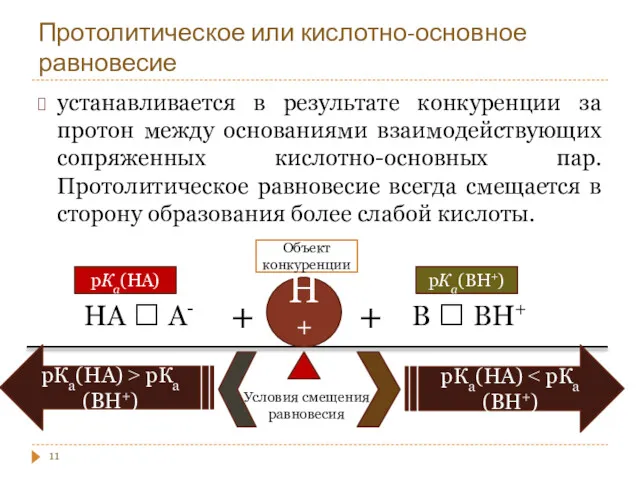
- 11. Протолитическое или кислотно-основное равновесие устанавливается в результате конкуренции за протон между основаниями взаимодействующих сопряженных кислотно-основных пар.
- 12. Константа кислотности и её показатель (рКа) Ка = [Н+]∙[А-]/[НА] ⇒ рКа = -lgКа Слабая кислота тем
- 13. Сила кислоты определяется её способностью отдавать протон, т.е. сильная кислота – активный донор протонов. Сила основания
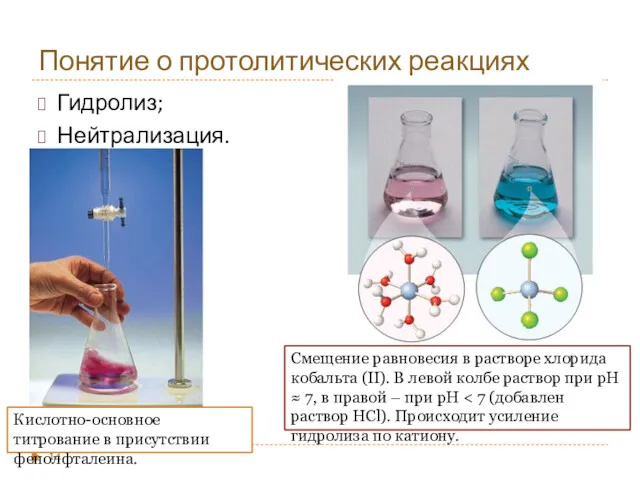
- 14. Понятие о протолитических реакциях Гидролиз; Нейтрализация. Кислотно-основное титрование в присутствии фенолфталеина. Смещение равновесия в растворе хлорида
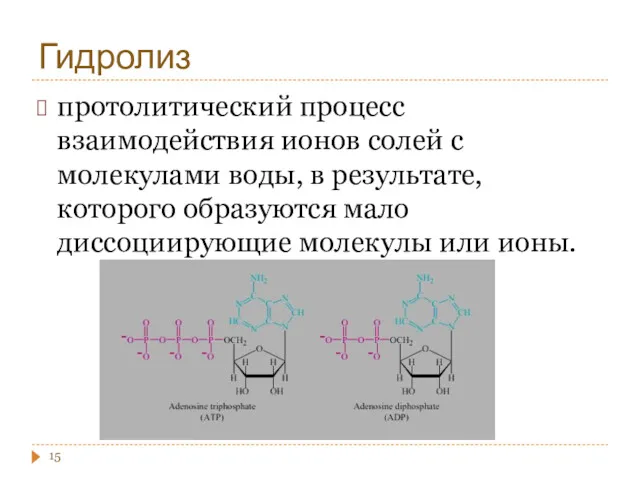
- 15. Гидролиз протолитический процесс взаимодействия ионов солей с молекулами воды, в результате, которого образуются мало диссоциирующие молекулы
- 16. Апротонная или электронная теория Льюиса (1923) Гилберт Ньютон Льюис (1875-1946), выдающийся американский физикохимик.
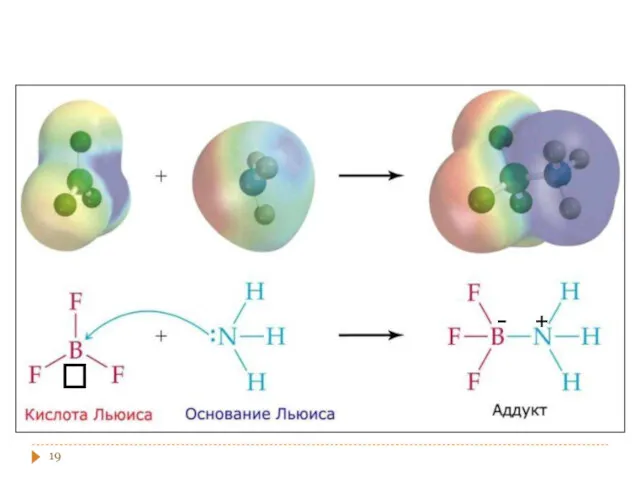
- 17. Кислота вещество, принимающее электронные пары – т.е. акцептор электронных пар (Н+, AlCl3, BF3, SiF4, катионы металлов
- 18. Основание вещество, поставляющее электроны для образования химической связи – т.е. донор электронов (Н2О, NH3, Cl-).
- 19. - +
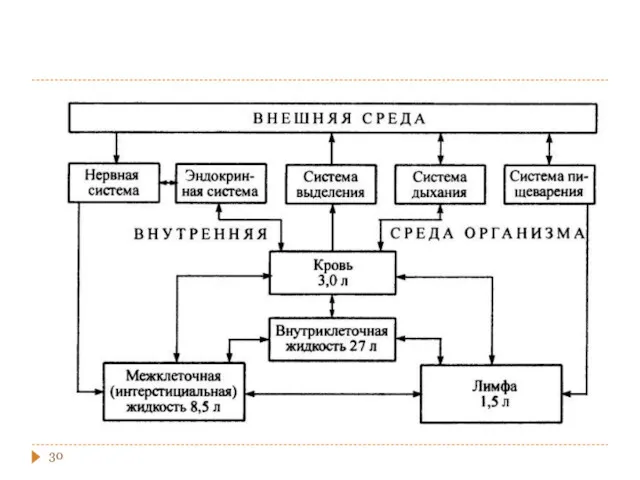
- 20. Буферный раствор это раствор, содержащий протолитическую равновесную систему, способную поддерживать практически постоянное значение рН при разбавлении
- 21. Типы буферных систем Кислотные - содержат слабую кислоту – донор Н+ и соль этой кислоты –
- 22. Механизм действия буферных систем кислотного типа Ацетатная буферная система CH3COO- / СН3СООН Акцептор Н+ / Донор
- 23. Ацетатная буферная система Обратимый процесс – частичная диссоциация слабой кислоты: СН3СООН ⮀ Н+ + СН3СОО-; рКа
- 24. Уравнение Гендерсона - Хассельбаха для расчета рН буферной системы кислотного типа рКа – табличная величина (см.
- 25. Механизм действия буферных систем основного типа Аммиачная буферная система NH3∙H2O / NH4+ Акцептор Н+ / Донор
- 26. Уравнение Гендерсона - Хассельбаха для расчета рН буферной системы основного типа
- 27. Буферное действие
- 28. Буферная ёмкость
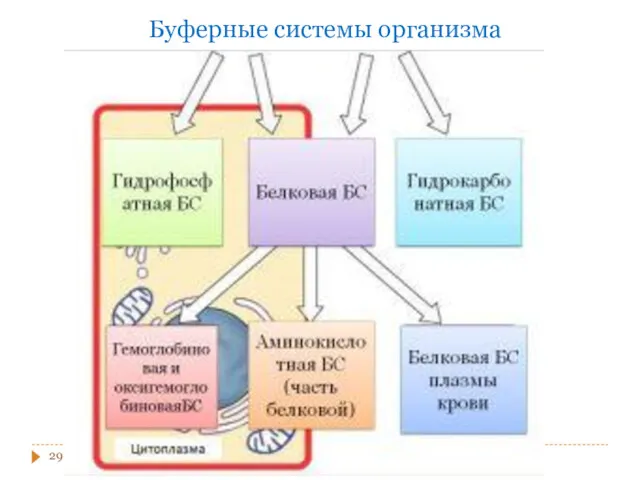
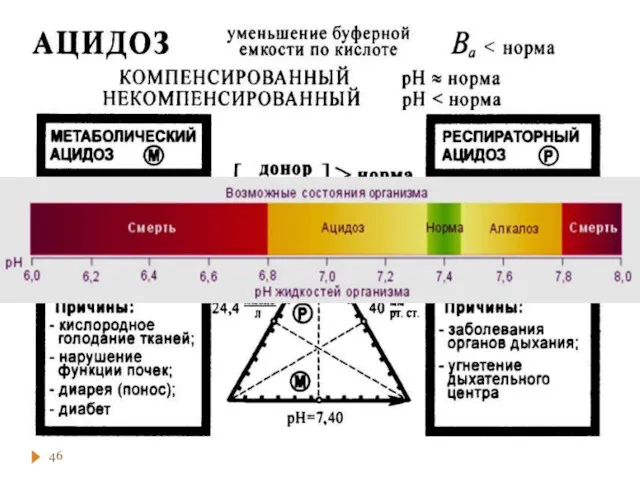
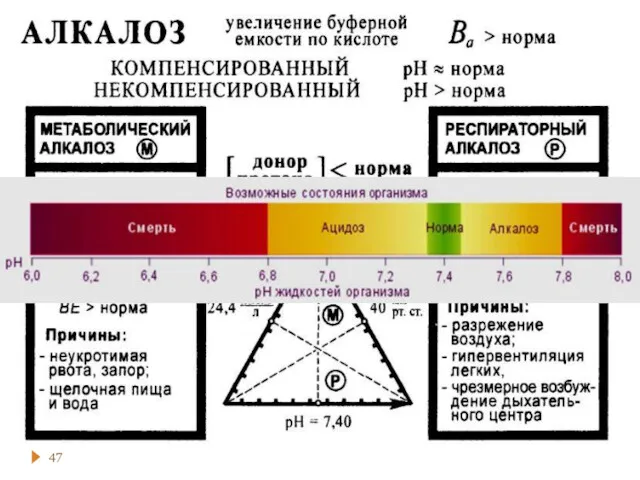
- 29. Буферные системы организма
- 31. Значения рН важнейших биологических жидкостей
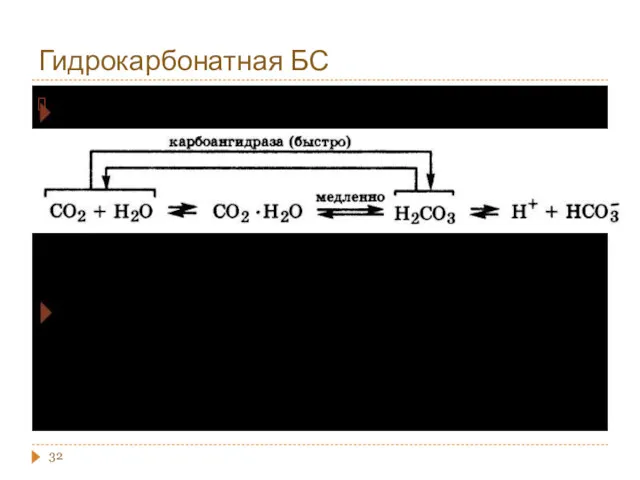
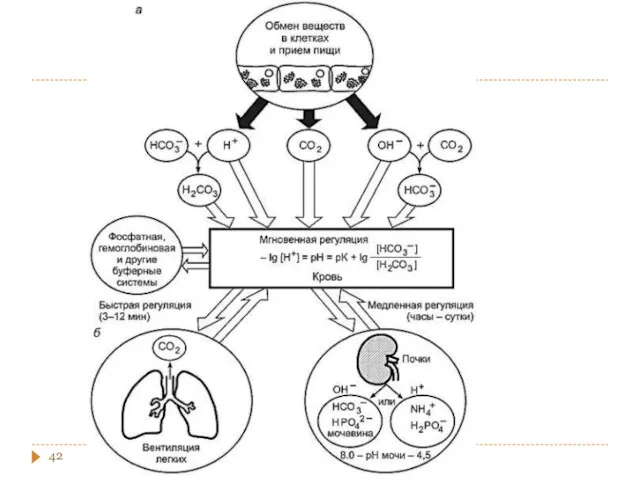
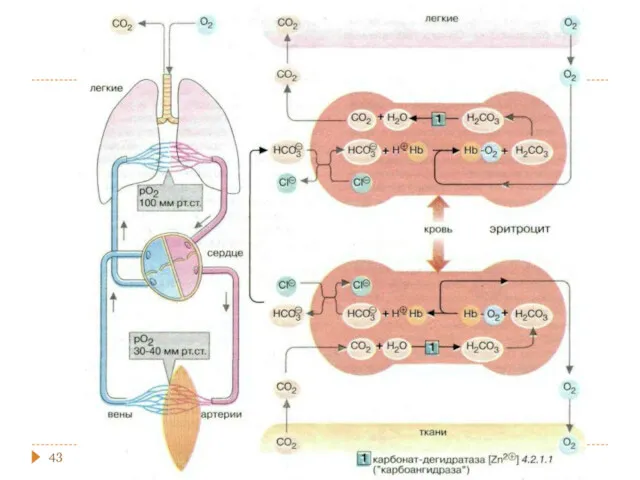
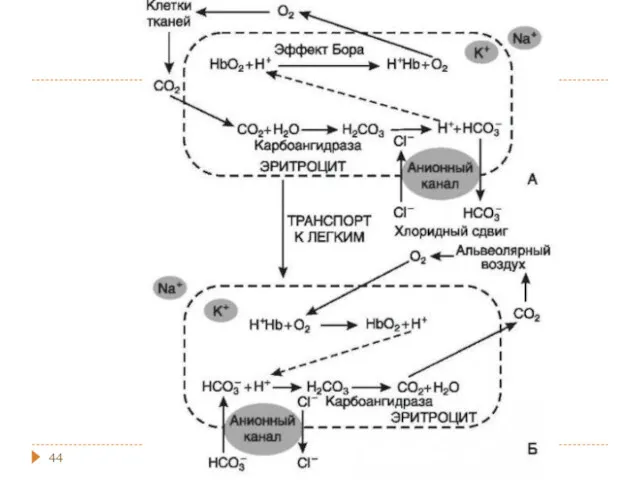
- 32. Гидрокарбонатная БС
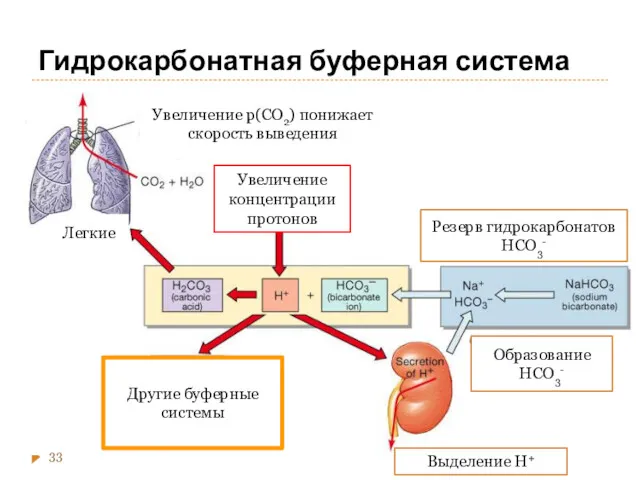
- 33. Гидрокарбонатная буферная система Легкие Увеличение p(СО2) понижает скорость выведения Увеличение концентрации протонов Образование НСО3- Резерв гидрокарбонатов
- 34. Гидрофосфатная буферная система
- 35. Гемоглобиновая и оксигемоглобиновая БС Гемоглобиновая БС: Hb- / HHb Оксигемоглобиновая БС: HbО2- / HHbО2
- 36. Механизм действия гемоглобиновой БС Н+ + Hb- ↔ HHb ОН- + HHb ↔ Hb- + Н2О
- 37. Белковые (протеиновые) БС Бывают анионного и катионного типа, в зависимости от изоэлектрической точки входящих в систему
- 38. Катионный белковый буфер работает при рН +H3N-Prot-COOН ↔ H+ + +H3N-Prot-COO- кратко: (H2Prot)+ ↔ H+ +
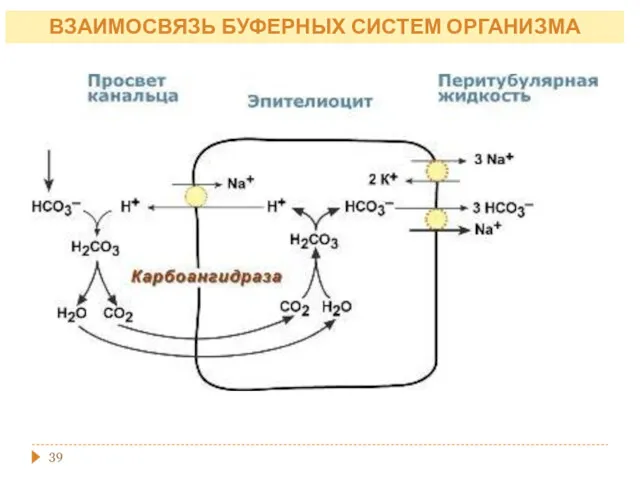
- 39. ВЗАИМОСВЯЗЬ БУФЕРНЫХ СИСТЕМ ОРГАНИЗМА
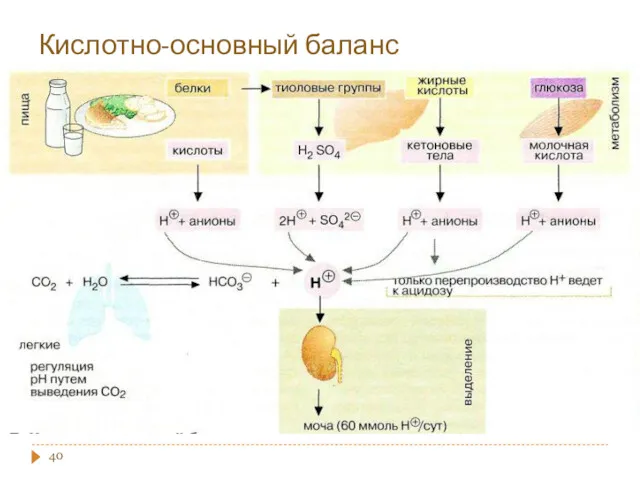
- 40. Кислотно-основный баланс
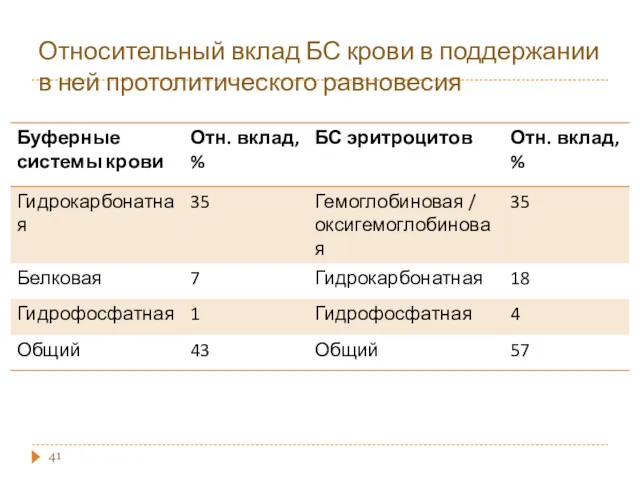
- 41. Относительный вклад БС крови в поддержании в ней протолитического равновесия
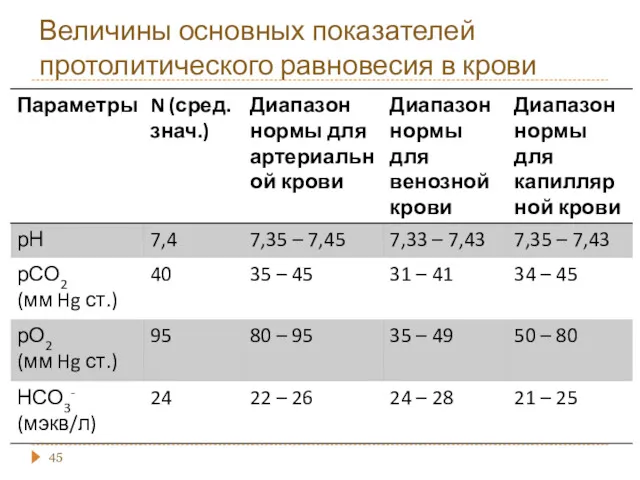
- 45. Величины основных показателей протолитического равновесия в крови
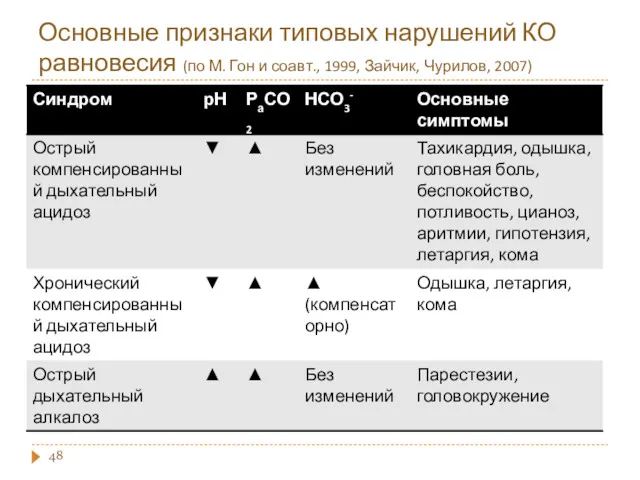
- 48. Основные признаки типовых нарушений КО равновесия (по М. Гон и соавт., 1999, Зайчик, Чурилов, 2007)
- 50. Скачать презентацию








![Константа кислотности и её показатель (рКа) Ка = [Н+]∙[А-]/[НА] ⇒](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/136363/slide-11.jpg)



















 Теоретические основы органической химии
Теоретические основы органической химии Кислоты и их свойства
Кислоты и их свойства Воздух и его свойства
Воздух и его свойства Виды изомерии в органической химии
Виды изомерии в органической химии Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Химическая промышленность
Химическая промышленность Свойства растворов электролитов
Свойства растворов электролитов Роль химии в современной цивилизации
Роль химии в современной цивилизации Электрохимические процессы
Электрохимические процессы Обмен липидов
Обмен липидов Химические свойства воды
Химические свойства воды Экстрагирование в химической промышленности
Экстрагирование в химической промышленности Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Жескость воды
Жескость воды ОВР в органической химии
ОВР в органической химии Чисті речовини і суміші
Чисті речовини і суміші Каталитический риформинг
Каталитический риформинг Кислород как элемент
Кислород как элемент Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов Бордың адам ағзасына әсері
Бордың адам ағзасына әсері Алюминий и его сплавы
Алюминий и его сплавы Кремний и его соединения
Кремний и его соединения Виды химической связи
Виды химической связи Положение металлов в периодической системе химических элементов. Особенности строения их атомов
Положение металлов в периодической системе химических элементов. Особенности строения их атомов Изотопы химических элементов
Изотопы химических элементов Электронные конфигурации атомов
Электронные конфигурации атомов Решение заданий ЕГЭ на составление окислительно-восстановительных реакций
Решение заданий ЕГЭ на составление окислительно-восстановительных реакций