Слайд 2

1.
какой класс веществ представлен в следующих названиях:
хлорид натрия, сульфат
бария, карбонат кальция, фосфат кальция?
1. оксиды
2. кислоты
3. соли
4. основания
Слайд 3

2. поваренная соль – это
1. хлорид кальция
2. хлорид натрия
3. хлорид
алюминия
3. гидроксид натрия
3. взаимодействие кислоты и основания относится к типу реакции:
1. соединения
2. разложения
3. нейтрализации
4. замещения
Слайд 4

4. общий признак кислот:
1. наличие гидроксогруппы
2.наличие ионов водорода
3. наличие ионов металла
4.
наличие кислорода
5.верное сопоставление:
1. HCl - хлорид натрия
2. NaCl - хлорид натрия
3. CaO - оксид
4. NaOH - оксид натрия
Слайд 5

6.верное сопоставление:
1 NaCl - оксид натрия
2 HCl - оксид водорода
3
CaO - оксид кальция
4 MgO - оксид калия
7. не вписывается в логику представленного ряда веществ -
CaO - NaCl - MgO - NaF - CuO - KOH
1 2 3 4 5 6
1) 1
2) 2
3) 3
4) 4
5) 5
6) 6
Слайд 6

8. чем можно нейтрализовать едкое кали - КОН
1 - NaCl
2 -
NaOH
3 - HCl
4 - HOH
9. чем можно нейтрализовать серную кислоту?
1 - HCl
2 - HOH
3 - KOH
4 - NaCl
5 – KCl
Слайд 7

10. каким индикатором легче выявить наличие щелочи?
1 - лакмусом
2 - фенолфталеином
3
- метилоранжем
4 - йодом
11. не относится к индикаторам
1 - метиловый оранжевый
2 - лакмус
3 - фенолфталеин
4 – йод
Слайд 8

12.карбонат кальция – это
1. оксид
2. кислота
3. соль
4. основание
13.негашеная известь – это
1.оксид
2.
основание
3. кислота
4. соль
Слайд 9

14. гашеная известь – это
1. оксид
2. основание
3. кислота
4. соль
15. углекислый газ
– это
1. оксид
2. основание
3. кислота
4. соль
Слайд 10

16. двухосновной кислотой является
1. серная
2. соляная
3. фосфорная
4. азотная
17. к кислотам не
относится
1. уксус
2. сода
3. лимонный сок
4. вытяжка из щавеля
Слайд 11

18. степень окисления кислотного остатка зависит от
1. числа атомов водорода в
молекуле кислоты
2. степени окисления металла, с которым соединяется
3. числа атомов кислорода в молекуле кислоты
4. характера свойств
Слайд 12

20. Обозначения :
O – основание ┬ - оксид
∆ -
кислота □ – соль
Составьте графический рисунок согласно следующей последовательности формул веществ:
Fe(OH) 2 Na2O KOH MgO NaCl Fe2O3 CaSO3 CuO H2S K2O H2SO3
O ┬ O ┬ □ ┬ □ ┬ ∆ ┬ ∆











 Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Основания. Классификация оснований
Основания. Классификация оснований Карбонові кислоти
Карбонові кислоти Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты
Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты Породообразующие минералы
Породообразующие минералы Классификация химических реакций
Классификация химических реакций Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Природні гази
Природні гази Произведение растворимости. Строение комплексных соединений
Произведение растворимости. Строение комплексных соединений Пространственное строение молекул органических соединений
Пространственное строение молекул органических соединений Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Фосфор и его соединения
Фосфор и его соединения Зелёная химия
Зелёная химия Алкены. Этилен
Алкены. Этилен Переработка угля
Переработка угля Возобновляемое сырье органической химии
Возобновляемое сырье органической химии Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Штучні і синтетичні волокна
Штучні і синтетичні волокна Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Обобщение по типам химических реакций
Обобщение по типам химических реакций Щелочные металлы
Щелочные металлы Сульфиды. Занятие 7
Сульфиды. Занятие 7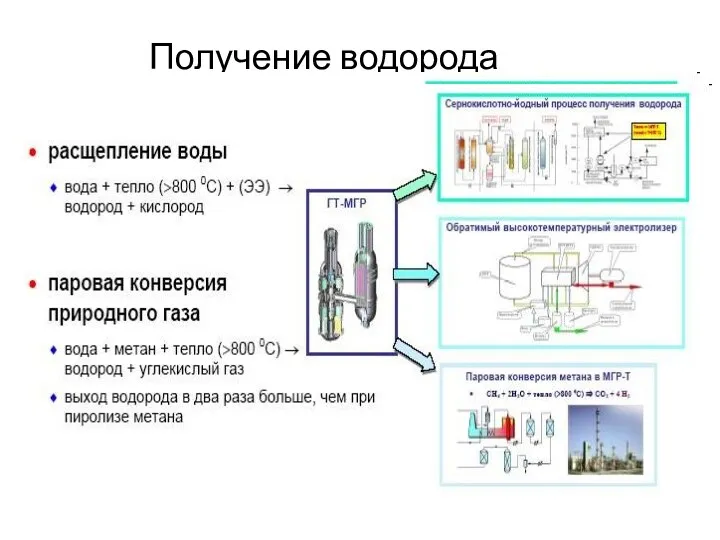 Получение водорода
Получение водорода Сырьевая база промышленной органической химии. Области применения органических веществ. (Лекция 1)
Сырьевая база промышленной органической химии. Области применения органических веществ. (Лекция 1) Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Лекция 6. Алициклические углеводороды (циклоалканы, нафтены)
Лекция 6. Алициклические углеводороды (циклоалканы, нафтены) Производство низших олефинов
Производство низших олефинов Виды топлива
Виды топлива