Содержание
- 2. Цели и задачи урока Образовательная: обобщить и систематизировать знания обучающихся о классификации химических реакций отработать навыки
- 3. Типы химических реакций По числу вступивших в реакцию веществ По тепловому эффекту По обратимости По изменению
- 4. 1. По числу вступивших в реакцию веществ и образовавшихся
- 5. 2. По тепловому эффекту Экзотермические - идут с выделением теплоты S + O2 = SO2 +
- 6. 3. По обратимости Необратимые - Идут только в одном направлении Условия: образование осадка или слабого электролита
- 7. Правило Бертолле В растворах электролитов реакции идут до конца в случае, если в результате образуется осадок,
- 8. Образование осадка: 2NaCl + Ba(OH)2 = 2NaOH +BaCl2 ↓ Ba2++ 2Cl- = BaCl2 ↓ образование газа:
- 9. 4.По изменению степени окисления Идут без изменения степени окисления элементов CaCO3 = CaO + CO2 Окислительно
- 10. По агрегатному состоянию веществ Гомогенные - между веществами нет поверхности раздела фаз H2 + Cl2 =
- 11. По механизму (не нужно это писать) Ионные NaOH + HCl = NaCl + H2O Na+ +
- 12. Проверь себя Определите тип химических реакций по всем пройденным классификациям, кроме механизма. Mn(OH)2? MnO + H2O
- 13. Напишите уравнения реакций между следующими парами веществ (все вещества назвать): HCI и Mg(OH)2 Zn и H2SO4
- 14. Вывод Поставленные цели урока достигнуты
- 16. Скачать презентацию
 Синтетические моющие средства
Синтетические моющие средства Соединения кремния
Соединения кремния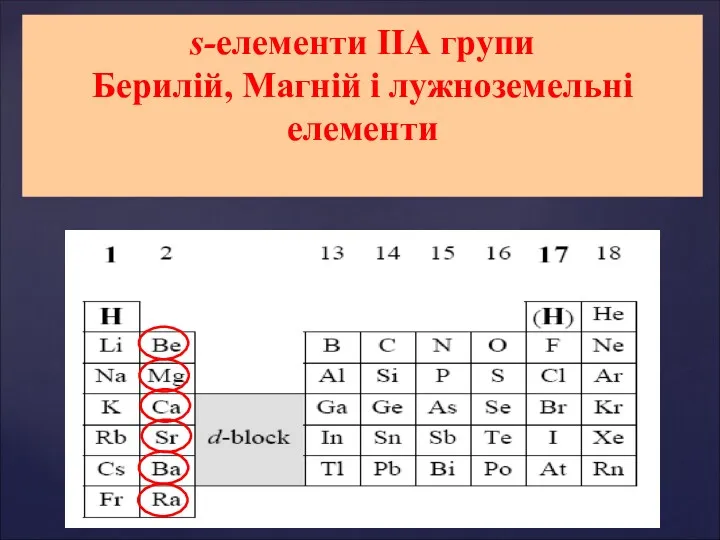 s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи
s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы
Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы Органическая химия. Этапы развития органической химии
Органическая химия. Этапы развития органической химии Полисахариды. Крахмал
Полисахариды. Крахмал Неделя химии в МБОУ Андреевская ООШ
Неделя химии в МБОУ Андреевская ООШ Массовая доля растворенного вещества в растворе
Массовая доля растворенного вещества в растворе Разделение углеводородных газов
Разделение углеводородных газов Полимерные материалы
Полимерные материалы Белоктар. Биохимиясы
Белоктар. Биохимиясы Алканы
Алканы Свойства простых веществ, кислот и солей в свете OBP. 8 класс
Свойства простых веществ, кислот и солей в свете OBP. 8 класс Хром. Свойства
Хром. Свойства Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Расчеты, связанные с понятием доля
Расчеты, связанные с понятием доля Хозяйственные товары из пластических масс
Хозяйственные товары из пластических масс Итоговая контрольная работа по химии
Итоговая контрольная работа по химии Количественный анализ. Титриметрический анализ
Количественный анализ. Титриметрический анализ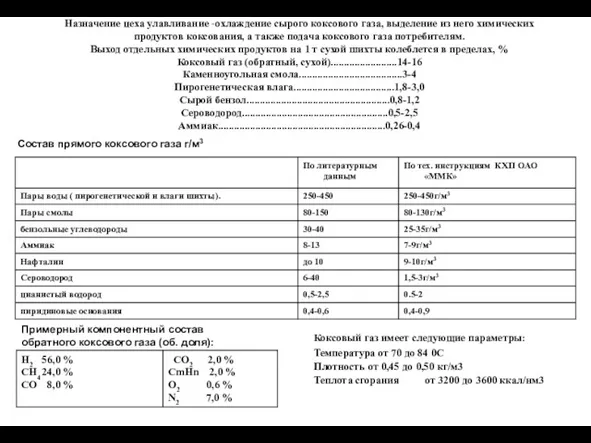 Охлаждение сырого коксового газа, выделение из него химических продуктов коксования
Охлаждение сырого коксового газа, выделение из него химических продуктов коксования Альдегіди і кетони аліфатичного ряду. Альдегіди і кетони ароматичного ряду
Альдегіди і кетони аліфатичного ряду. Альдегіди і кетони ароматичного ряду 20231110_zakon_avogadro
20231110_zakon_avogadro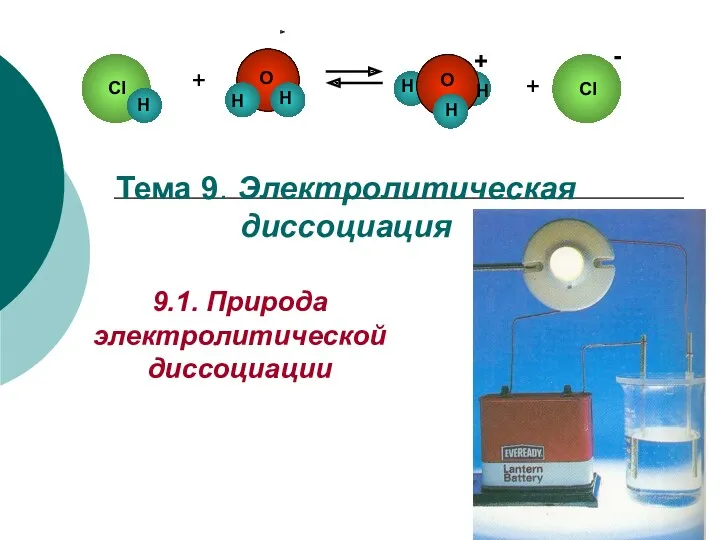 Электролитическая диссоциация
Электролитическая диссоциация Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)
Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)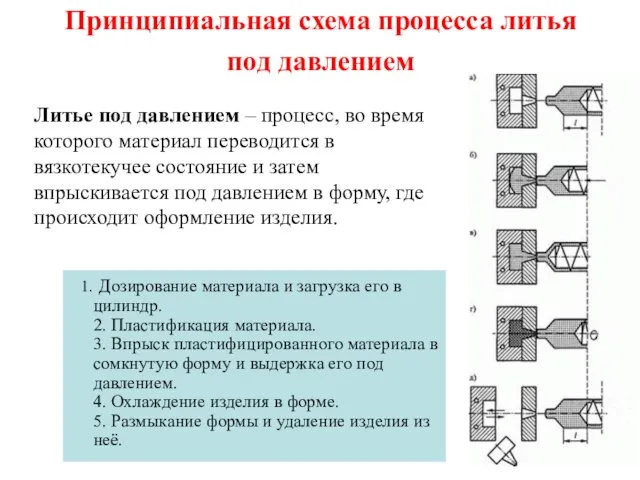 Принципиальная схема процесса литья под давлением
Принципиальная схема процесса литья под давлением Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Оксиды (1 этап изучения). 8 класс
Оксиды (1 этап изучения). 8 класс