Содержание
- 2. Металлы Нахождение в природе Внешний вид и условия хранения Получение металлов Химические свойства металлов Соединения металлов
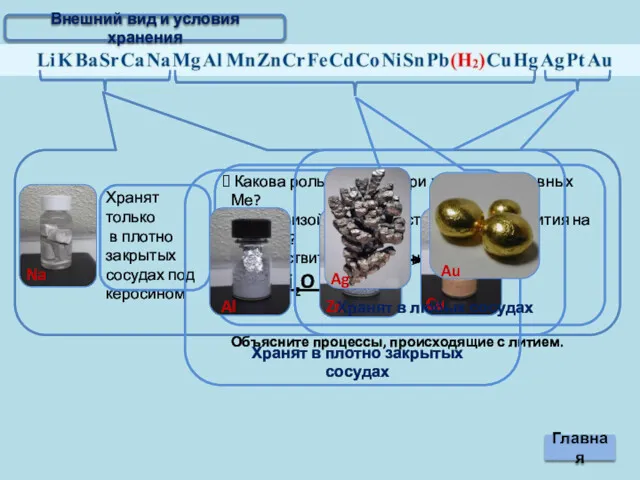
- 3. Внешний вид и условия хранения
- 4. Внешний вид и условия хранения Главная
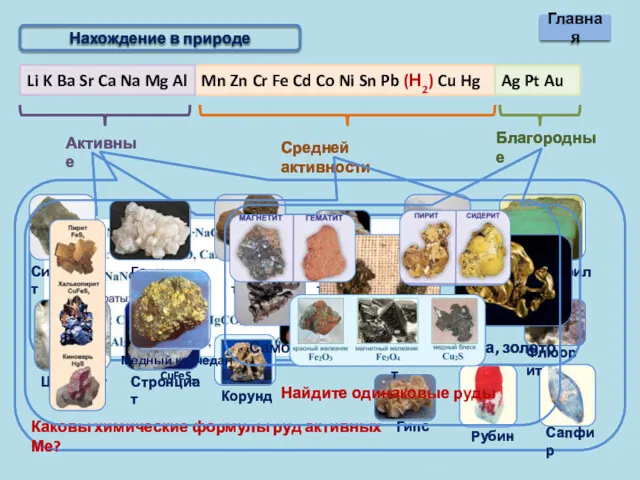
- 5. Mn Zn Cr Fe Cd Co Ni Sn Pb (Н2) Cu Hg Li K Ba Sr
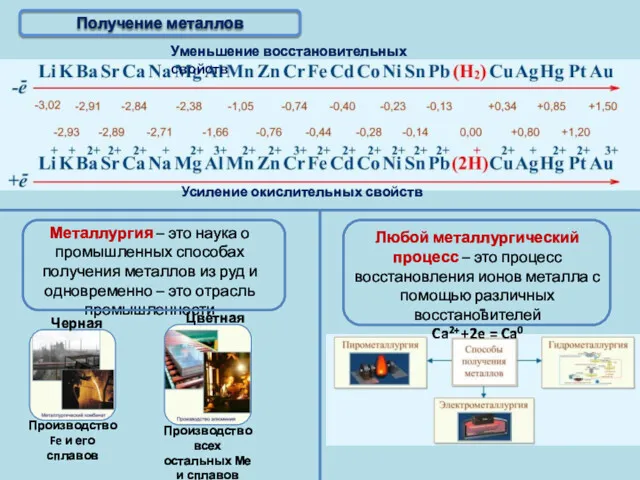
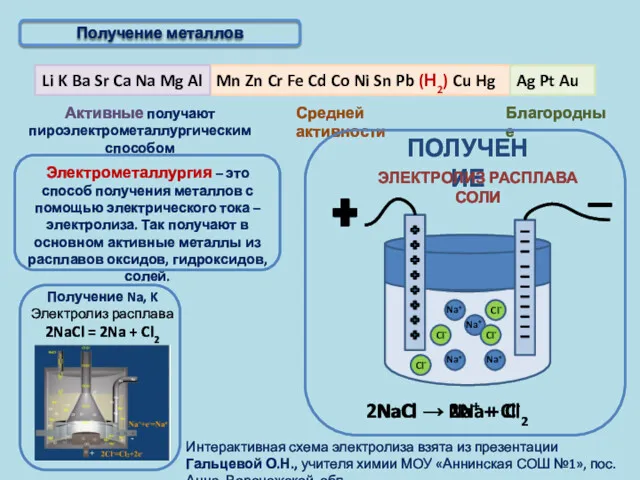
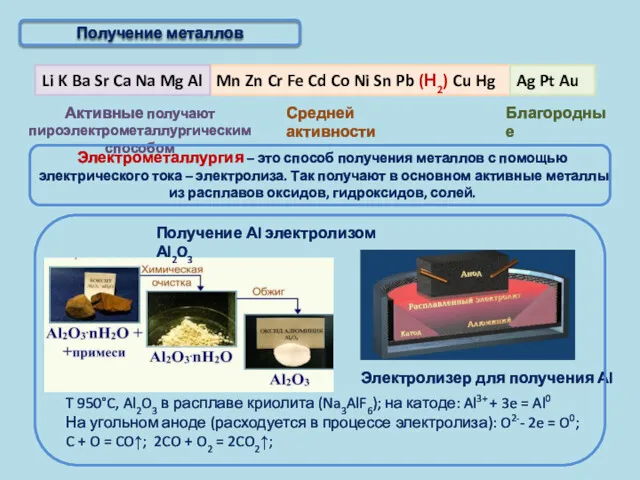
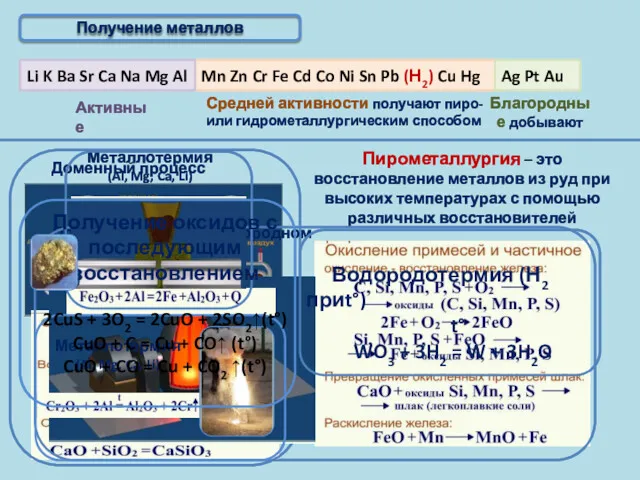
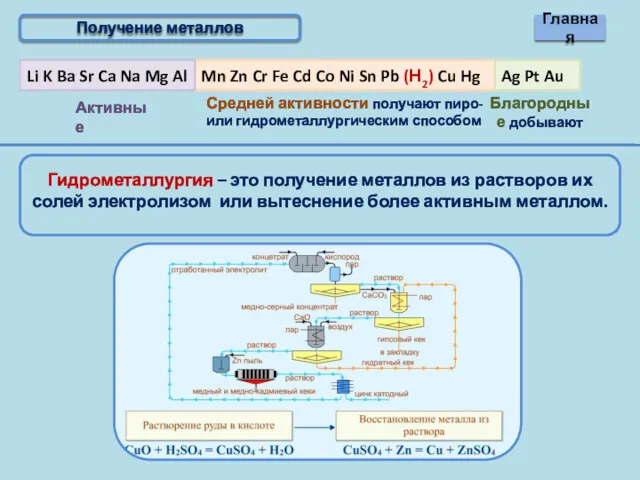
- 6. Получение металлов
- 7. Активные получают пироэлектрометаллургическим способом Благородные Получение металлов Электрометаллургия – это способ получения металлов с помощью электрического
- 8. Активные получают пироэлектрометаллургическим способом Благородные Получение металлов T 950°C, Al2O3 в расплаве криолита (Na3AlF6); на катоде:
- 9. Получение металлов Пирометаллургия – это восстановление металлов из руд при высоких температурах с помощью различных восстановителей
- 10. Получение металлов Главная
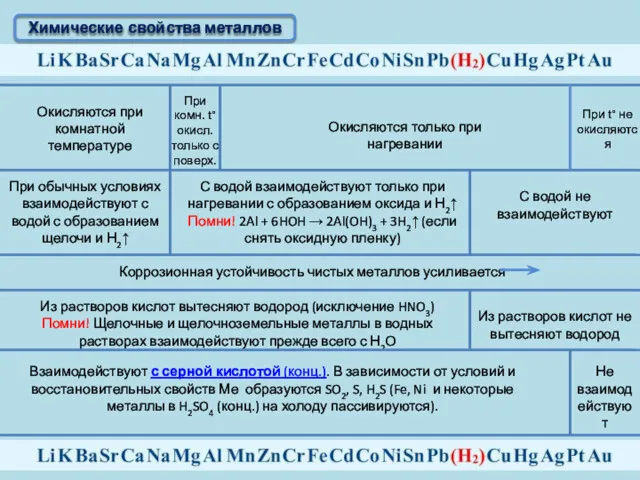
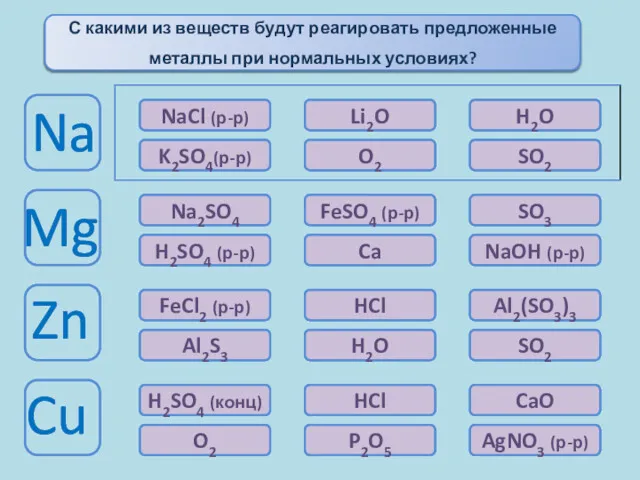
- 11. Химические свойства металлов Окисляются при комнатной температуре При комн. t°окисл. только с поверх. Окисляются только при
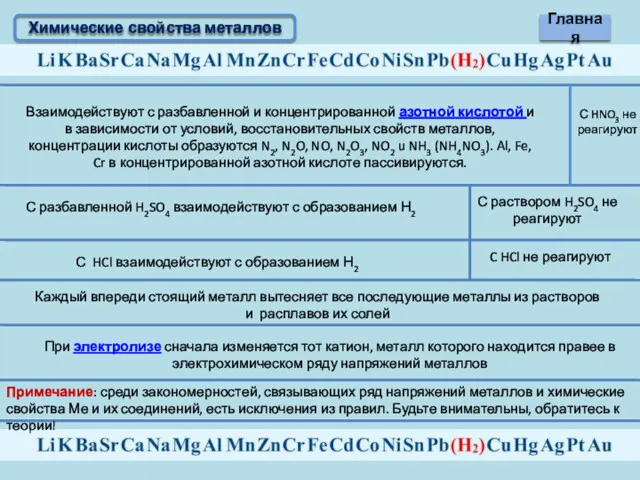
- 12. Химические свойства металлов Взаимодействуют с разбавленной и концентрированной азотной кислотой и в зависимости от условий, восстановительных
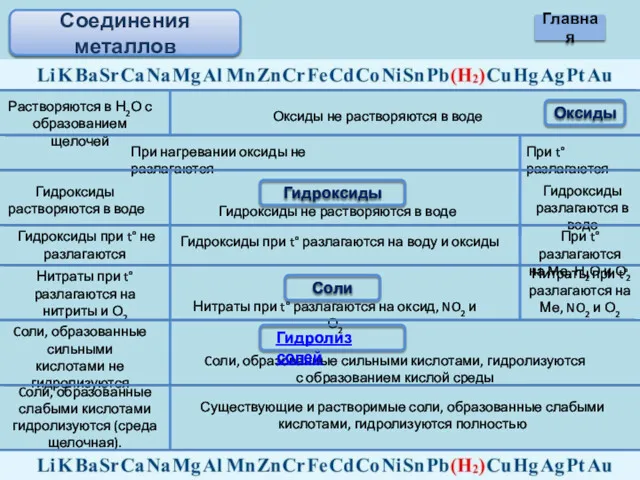
- 13. Соединения металлов Оксиды Растворяются в Н2О с образованием щелочей Оксиды не растворяются в воде При нагревании
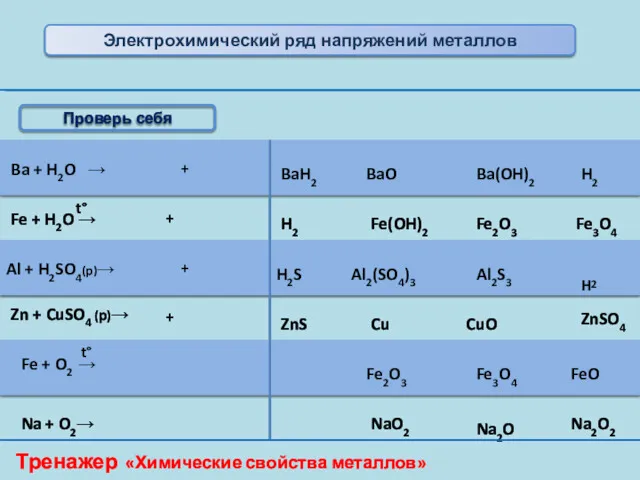
- 14. Ba + H2O → BaH2 BaO Ba(OH)2 H2 Fe + H2O → H2 Fe(OH)2 Fe2O3 Fe3O4
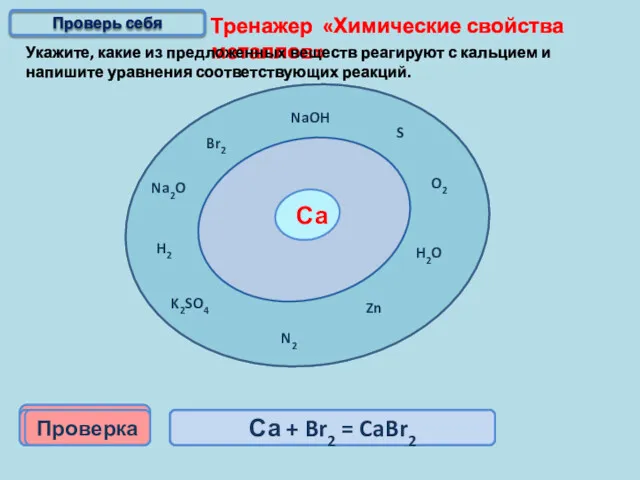
- 15. Тренажер «Химические свойства металлов» Укажите, какие из предложенных веществ реагируют с кальцием и напишите уравнения соответствующих
- 16. Коэффициент перед формулой восстановителя в реакции, схема которой Ca + HNO3 (конц.) → Ca(NO3)2 + N2↑+
- 17. ошибка ошибка ошибка молодец молодец ошибка ошибка молодец молодец ошибка ошибка ошибка молодец ошибка молодец ошибка
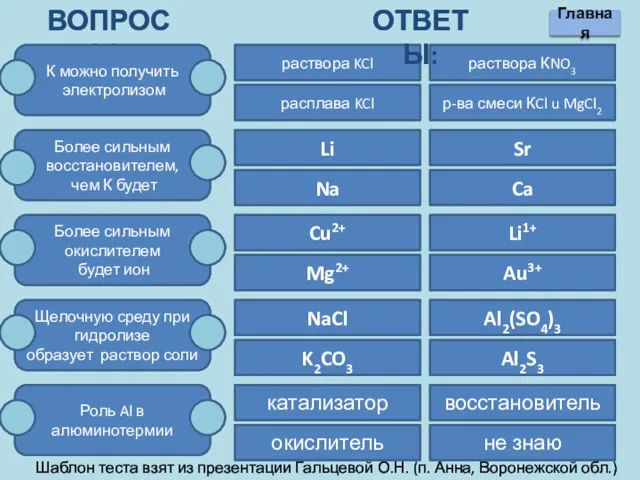
- 18. ВОПРОСЫ: К можно получить электролизом Более сильным восстановителем, чем К будет Более сильным окислителем будет ион
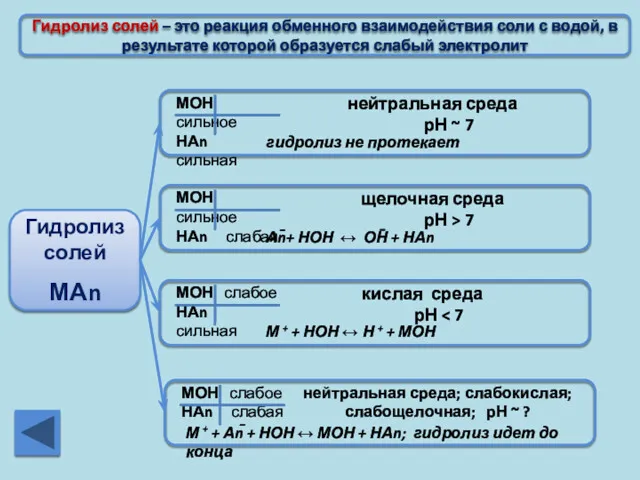
- 19. Гидролиз солей – это реакция обменного взаимодействия соли с водой, в результате которой образуется слабый электролит
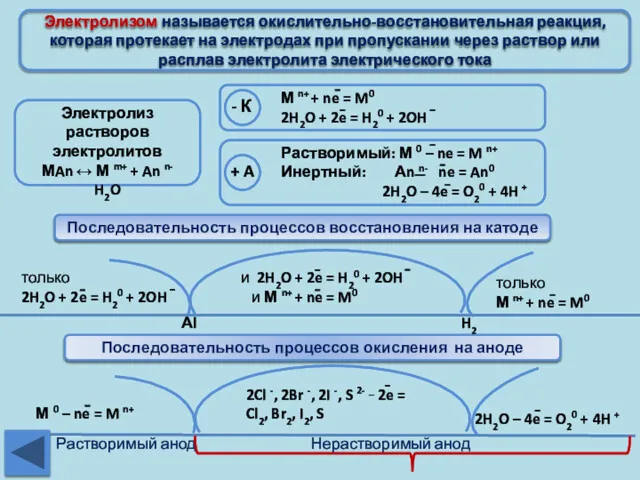
- 20. Электролизом называется окислительно-восстановительная реакция, которая протекает на электродах при пропускании через раствор или расплав электролита электрического
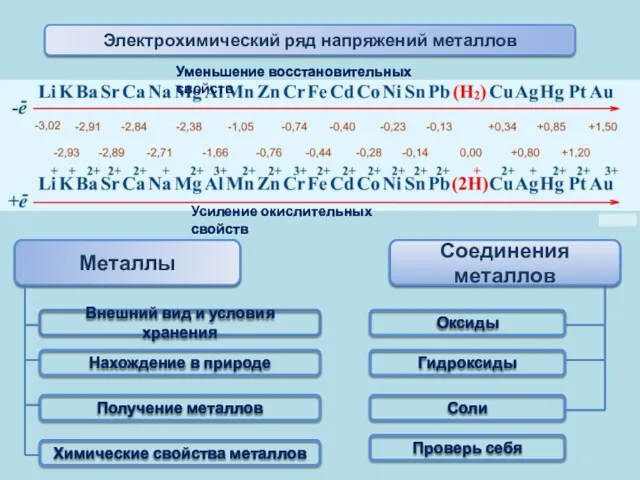
- 21. Электрохимический ряд напряжений металлов Уменьшение восстановительных свойств Усиление окислительных свойств Факторы, определяющие положение металла в электрохимическом
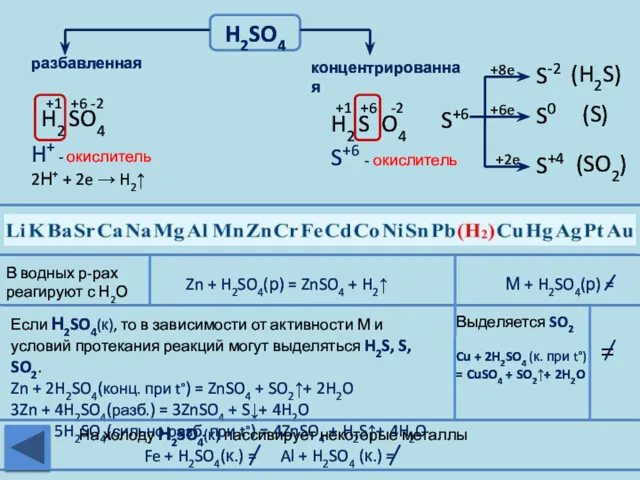
- 22. H2SO4 разбавленная концентрированная Zn + H2SO4(р) = ZnSO4 + H2↑ М + H2SO4(р) = В водных
- 24. Скачать презентацию



 Качественные реакции на органические вещества
Качественные реакции на органические вещества Озон
Озон Қарапайым кристалдық құрылымдар
Қарапайым кристалдық құрылымдар Лантаноидтар. Лантаноидтардың қасиеттері
Лантаноидтар. Лантаноидтардың қасиеттері Электрохимические методы анализа
Электрохимические методы анализа Материальный баланс химического реактора. Лекция № 3
Материальный баланс химического реактора. Лекция № 3 Биомакромолекулы. Нуклеиновые кислоты
Биомакромолекулы. Нуклеиновые кислоты Глоссарий
Глоссарий Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Метаболизм нуклеотидов
Метаболизм нуклеотидов Уравнения химических реакций
Уравнения химических реакций Тұнбалар мен қайнатпаларды алу принциптері
Тұнбалар мен қайнатпаларды алу принциптері Vitaminele
Vitaminele Алотропні модифікації фосфору
Алотропні модифікації фосфору Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть
Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть Век пластмасс
Век пластмасс Техника безопасности на уроках химии
Техника безопасности на уроках химии Химия. 6я группа элементов. 9 класс
Химия. 6я группа элементов. 9 класс Нефтепродукты. Продукты переработки нефти
Нефтепродукты. Продукты переработки нефти Генетичні зв’язки між неорганічними речовинами. Практична робота 2
Генетичні зв’язки між неорганічними речовинами. Практична робота 2 Алкены. Химия
Алкены. Химия Относительная молекулярная масса
Относительная молекулярная масса Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2)
Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Азотистая кислота
Азотистая кислота Простые и сложные вещества. Химический элемент
Простые и сложные вещества. Химический элемент