Содержание
- 2. Тема: Валентность. Определение валентности по формулам.
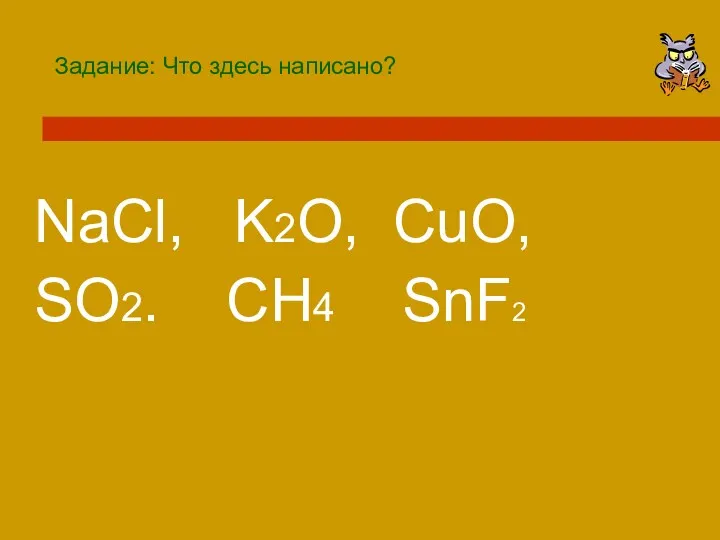
- 3. Задание: Что здесь написано? NaCl, K2O, CuO, SO2. CH4 SnF2
- 4. . Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2. Справочные данные: Аr (Cu) = 64 Аr
- 5. Что общего в составе молекул? Чем они отличаются друг от друга? Задание: сравните качественный и количественный
- 6. Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это называется валентностью. Слово
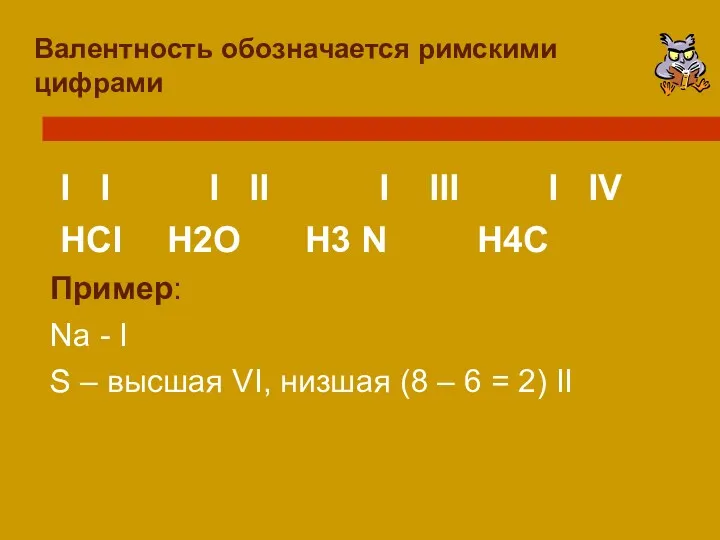
- 8. Валентность обозначается римскими цифрами I I I II I III I IV HCl H2O H3 N
- 9. Составление химических формул по валентности 1. Запиши рядом знаки химических элементов, которые входят в состав вещества.
- 10. III B O II Н.О.К. (наименьшее общее кратное) – это число, которое делится на исходные числа
- 11. Раздели Н.О.К. на валентность каждого элемента. Запиши полученный индекс. Пример: Составить химическую формулу оксида бора. B
- 12. Типы химических реакций.
- 13. Классификация реакций по числу и составу исходных веществ и продуктов реакции реакция соединения реакция разложения реакция
- 14. По числу и составу исходных веществ и продуктов реакции Реакция соединения – реакция, в ходе, которой
- 15. Реакция разложения Реакция разложения – реакция, в которой из одного исходного вещества образуется несколько новых веществ.
- 16. Реакция замещения Реакция замещения – реакция между простым и сложным веществами, в результате которой атомы простого
- 17. Реакция обмена Реакция обмена – реакция, в результате которой два вещества обмениваются своими составными частями, образуя
- 18. По тепловому эффекту химической реакции Экзотермические реакции – реакции, протекающие с выделением энергии (тепла). Горение фосфора
- 19. Эндотермическая реакция Эндотермические реакции – реакции, протекающие с поглощением энергии (тепла). Горение азота в атмосфере кислорода
- 20. Проверьте свои знания Определите тип химической реакции. Распределите предложенные вам уравнения, расставьте коэффициенты в уравнениях реакций.
- 22. Скачать презентацию

















 Азот
Азот Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Лекарства дома
Лекарства дома Теория резонанса в неорганической химии
Теория резонанса в неорганической химии Простые вещества (урок для 8 класса)
Простые вещества (урок для 8 класса) Химическая кинетика. Закон действующих масс для скорости реакции
Химическая кинетика. Закон действующих масс для скорости реакции Фенолы
Фенолы Минералы
Минералы Понятия и законы химии
Понятия и законы химии История микроскопа
История микроскопа Химическая термодинамика
Химическая термодинамика Переработка нефти. (10 класс)
Переработка нефти. (10 класс) Аминокислоты. Производные карбоновых кислот,
Аминокислоты. Производные карбоновых кислот, Минералогия литофильных редких элементов. Бериллий
Минералогия литофильных редких элементов. Бериллий Водородная связь
Водородная связь Химические реакции
Химические реакции Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Декоративная косметика. Исходное сырье. Лекция 7. Индустрия красоты
Декоративная косметика. Исходное сырье. Лекция 7. Индустрия красоты Физическая химия. Химическая термодинамика
Физическая химия. Химическая термодинамика Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Хімія та їжа
Хімія та їжа Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо
Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо Донорно-акцепторний механізм утворення ковалентного зв’язку
Донорно-акцепторний механізм утворення ковалентного зв’язку Азот. Физические и химические свойства азота
Азот. Физические и химические свойства азота Непредельные углеводороды. Этиленовые углеводороды (алкены)
Непредельные углеводороды. Этиленовые углеводороды (алкены) НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика