Содержание
- 2. План лекции. 1. Основные термодинамические характеристики: внутренняя энергия(U) , энтальпия(H), энтропия(S), энергия Гиббса(G). 2.Первый закон термодинамики.
- 3. Термодинамика- наука о превращениях одних видов энергии и работы в другие. Химическая термодинамика – рассматривает превращение
- 4. Основные термодинамические характеристики . 1. Внутренняя энергия (ΔU), кДж ΔU = Q-A 2. Энтальпия (ΔH), кДж
- 5. 1.Внутренняя энергия. Внутренняя энергия (U)- это общий запас энергии системы, слагающийся из энергии движения составляющих ее
- 6. 2.Первый закон термодинамики. Энтальпия. Энтальпия (ΔH)– теплосодержание системы. 1-ый закон термодинамики (закон сохранения энергии): теплота ,
- 7. 3. Второй закон термодинамики. Энтропия. Энтропия (ΔS) – это степень беспорядка термодинамической системы. Например, СаСО3(кр) =
- 8. Третий закон термодинамики: Энтропия идеального кристалла при абсолютном нуле равна нулю. (М. Планк,1911 г.) Макс Планк
- 9. Энергия Гиббса (ΔG) Энергия Гиббса (ΔG )– это энергия, которую система может затратить на совершение максимальной
- 10. Джозайя Уиллард Гиббс Американский физик, физикохимик, математик и механик, один из создателей векторного анализа, статистической физики,
- 11. Тепловой эффект реакции. Закон Гесса. Тепловой эффект реакции- это количество теплоты, которое выделяется или поглощается в
- 12. Термохимический закон Гесса (1841г) : Тепловой эффект химической реакции не зависит от пути её протекания, а
- 13. Герман Иванович Гесс Русский химик, академик Петербургской Академии наук (1834).
- 15. Скачать презентацию












 Растворы. Термодинамическая теория растворов
Растворы. Термодинамическая теория растворов Классификация химических реакций
Классификация химических реакций Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Основные классы неорганических соединений
Основные классы неорганических соединений Ионные кристаллы
Ионные кристаллы Типы химических реакций
Типы химических реакций Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Гигиена питания школьников
Гигиена питания школьников Углеводороды – самые простые органические соединения
Углеводороды – самые простые органические соединения Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Алюминий. 9 класс
Алюминий. 9 класс Водород - топливо будущего
Водород - топливо будущего Др
Др Кислород. 9 класс
Кислород. 9 класс Углеводы (монозы, биозы)
Углеводы (монозы, биозы)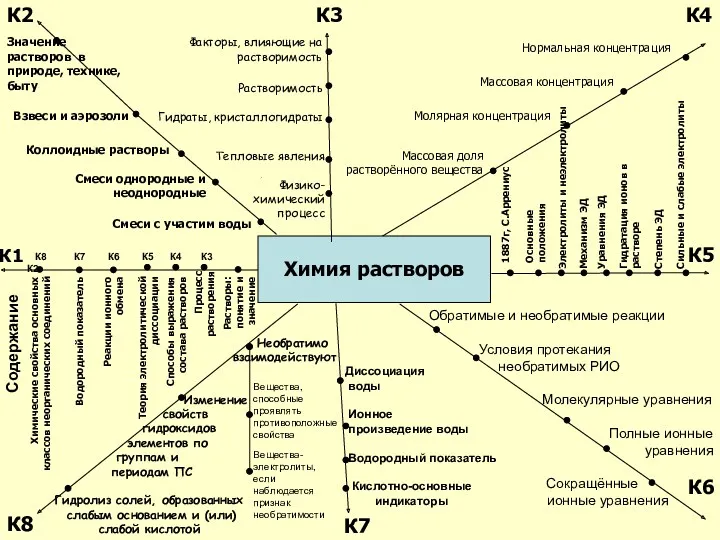 Процессы в растворах. Электролитическая диссоциация
Процессы в растворах. Электролитическая диссоциация Лихеоиндикация. Экологические аспекты переработки полимеров
Лихеоиндикация. Экологические аспекты переработки полимеров Кремний
Кремний Непредельные углеводороды ряда этилена
Непредельные углеводороды ряда этилена Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Оксид кремния
Оксид кремния Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева
Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева Оксид серы(4). Сернистая кислота и её соли
Оксид серы(4). Сернистая кислота и её соли Электролитическая диссоциация
Электролитическая диссоциация История развития органической химии. Теория Бутлерова
История развития органической химии. Теория Бутлерова Сложные эфиры
Сложные эфиры Скорость химических реакций
Скорость химических реакций Как заменить всю химическую косметику натуральной
Как заменить всю химическую косметику натуральной