Содержание
- 2. Биологическая роль углеводов Входят в состав клеток и тканей всех растительных и животных организмов; По массе
- 3. Основные функции углеводов Источник энергии в метаболических процессах (в растениях – крахмал, в животных организмах –
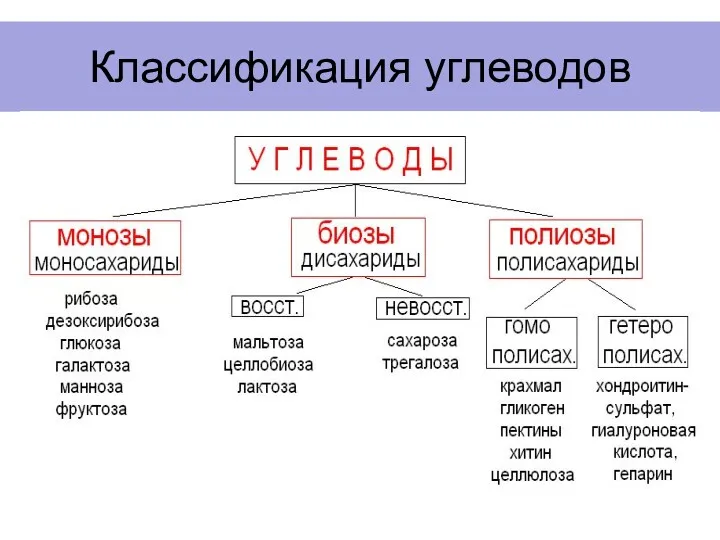
- 4. Классификация углеводов
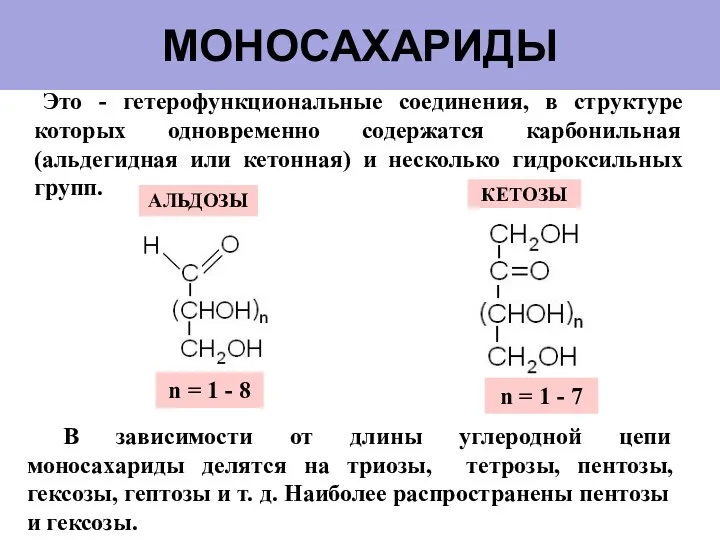
- 5. МОНОСАХАРИДЫ Это - гетерофункциональные соединения, в структуре которых одновременно содержатся карбонильная (альдегидная или кетонная) и несколько
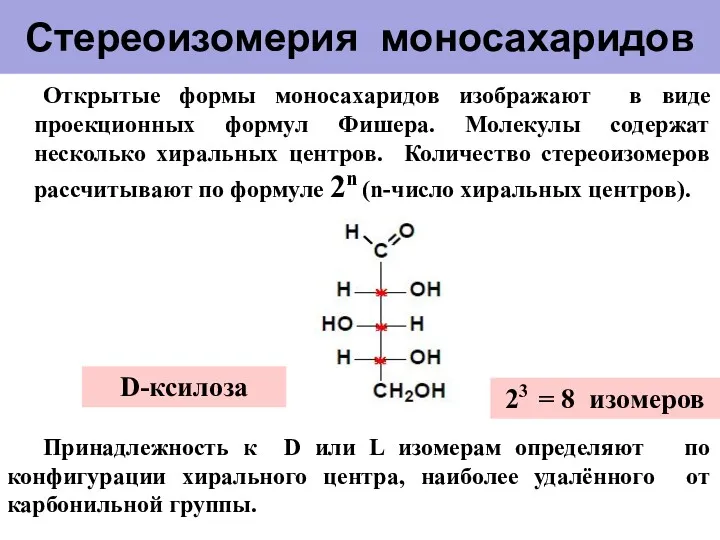
- 6. Стереоизомерия моносахаридов Открытые формы моносахаридов изображают в виде проекционных формул Фишера. Молекулы содержат несколько хиральных центров.
- 7. Энантиомеры – это стереозомеры, которые относятся друг к другу как предмет и его зеркальное отображение. Диастереоизомеры
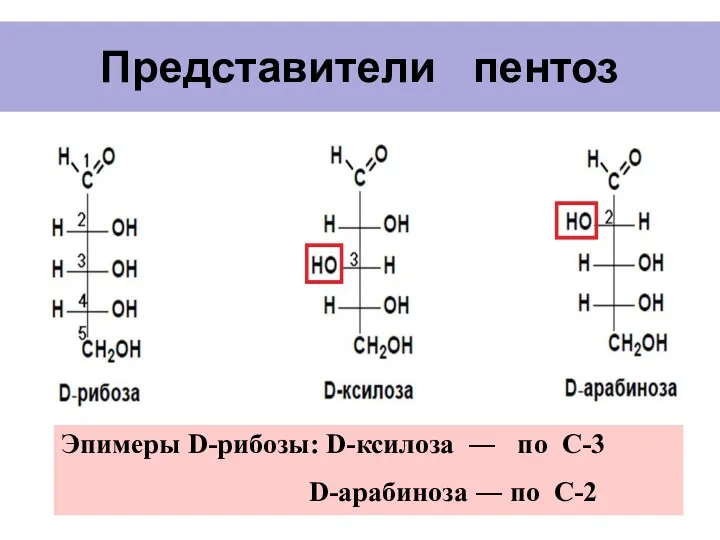
- 8. Представители пентоз Эпимеры D-рибозы: D-ксилоза ― по С-3 D-арабиноза ― по С-2
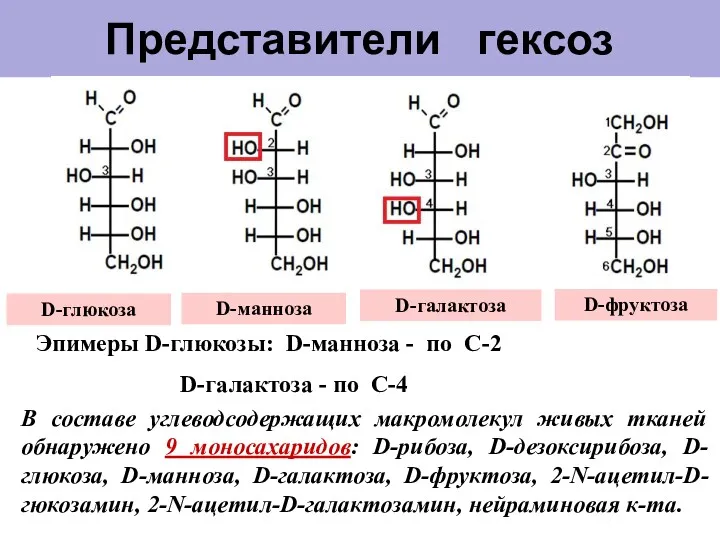
- 9. Представители гексоз D-манноза D-глюкоза D-галактоза D-фруктоза Эпимеры D-глюкозы: D-манноза - по С-2 D-галактоза - по С-4
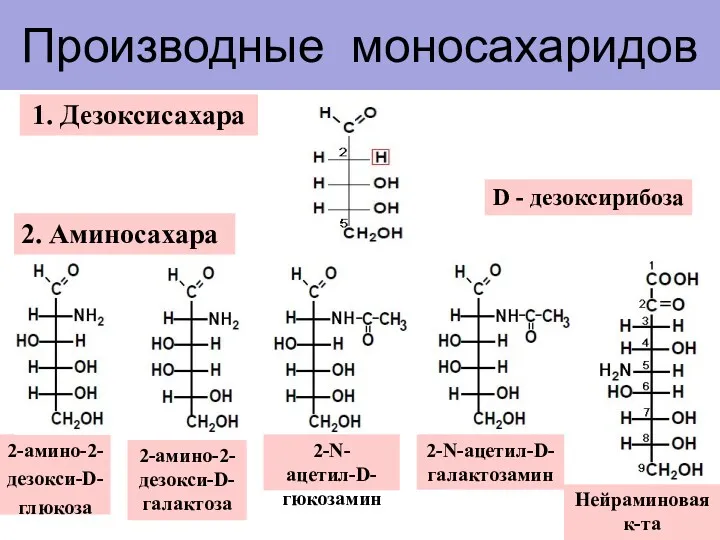
- 10. Производные моносахаридов 1. Дезоксисахара D - дезоксирибоза 2. Аминосахара 2-амино-2-дезокси-D-глюкоза 2-амино-2-дезокси-D-галактоза 2-N-ацетил-D-гюкозамин 2-N-ацетил-D-галактозамин Нейраминовая к-та
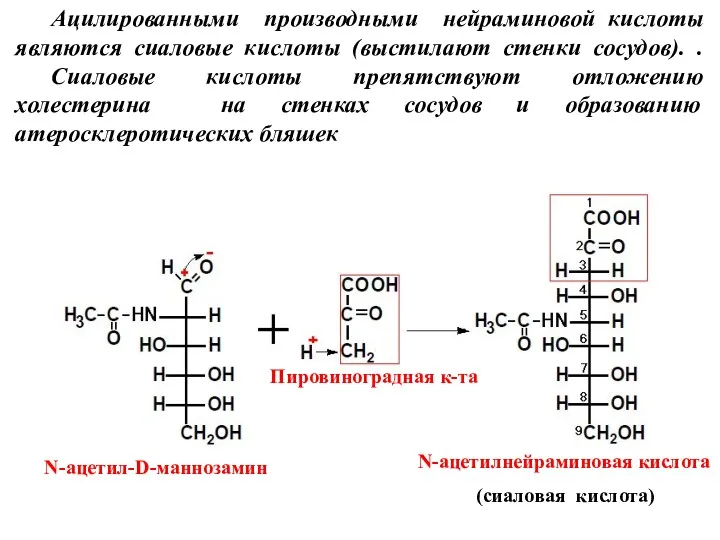
- 11. Ацилированными производными нейраминовой кислоты являются сиаловые кислоты (выстилают стенки сосудов). . Сиаловые кислоты препятствуют отложению холестерина
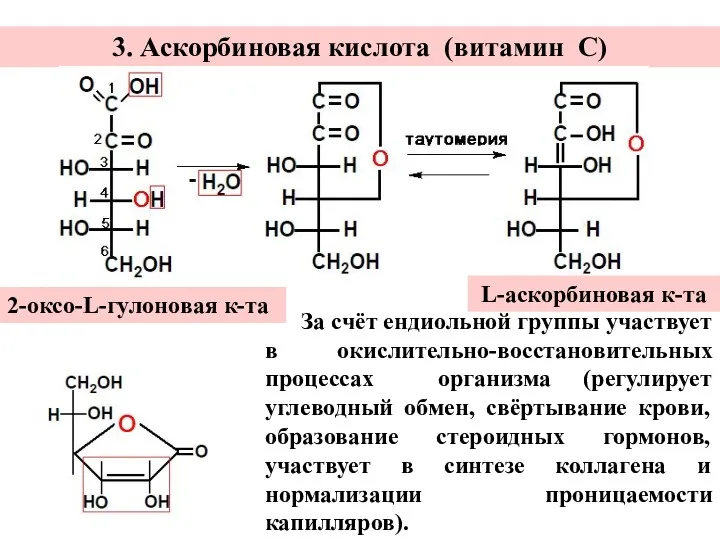
- 12. 3. Аскорбиновая кислота (витамин С) 2-оксо-L-гулоновая к-та L-аскорбиновая к-та За счёт ендиольной группы участвует в окислительно-восстановительных
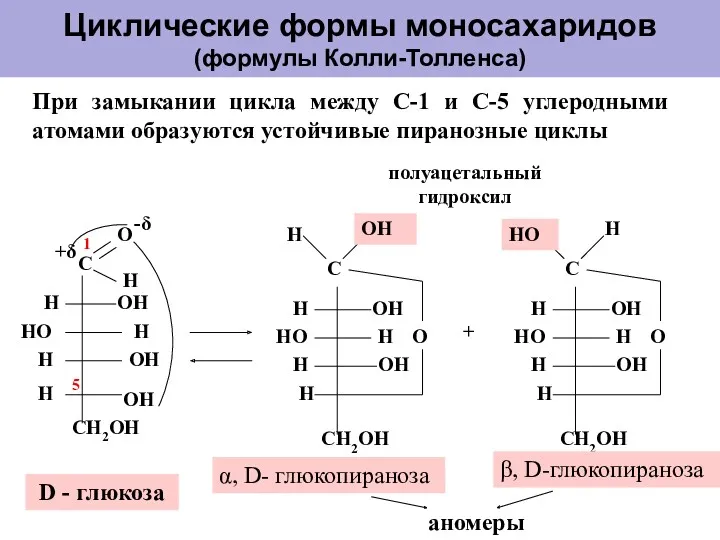
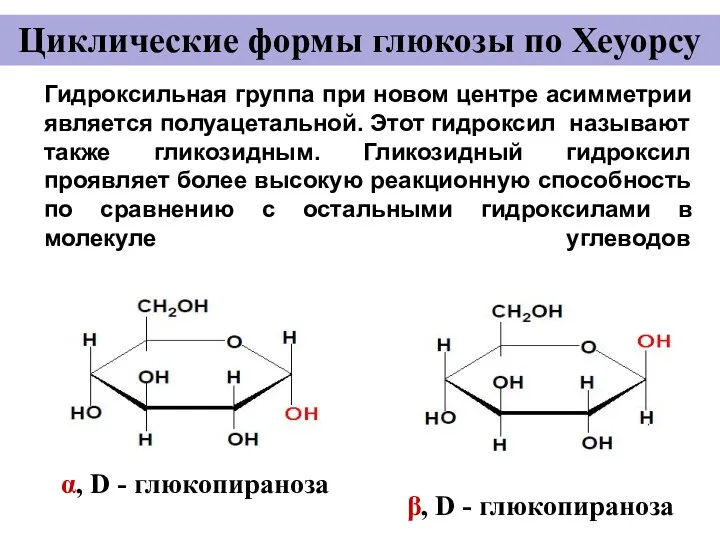
- 13. Циклические формы моносахаридов (формулы Колли-Толленса) + α, D- глюкопираноза β, D-глюкопираноза полуацетальный гидроксил 1 5 D
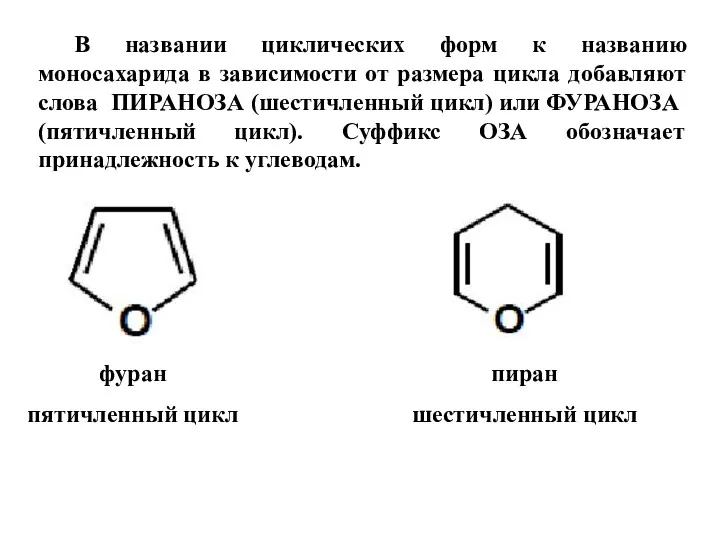
- 14. фуран пятичленный цикл пиран шестичленный цикл В названии циклических форм к названию моносахарида в зависимости от
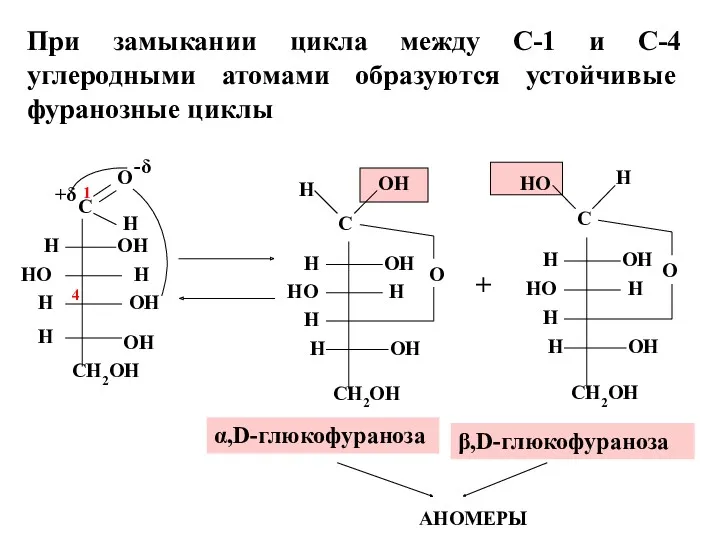
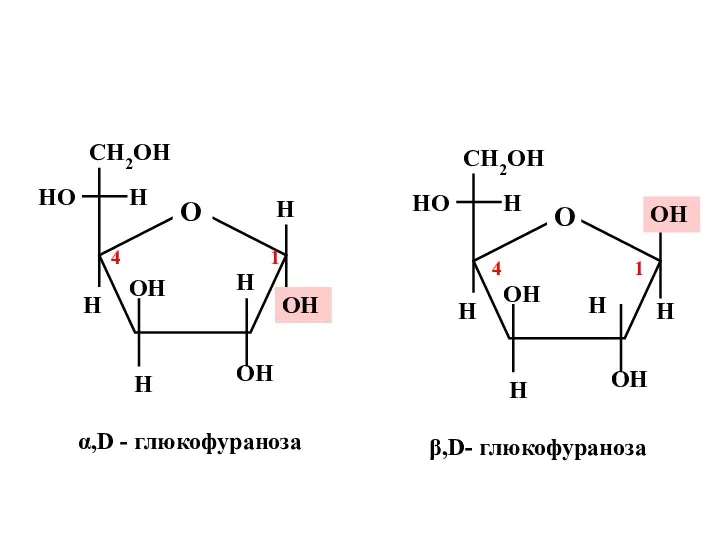
- 15. + α,D-глюкофураноза β,D-глюкофураноза 1 При замыкании цикла между С-1 и С-4 углеродными атомами образуются устойчивые фуранозные
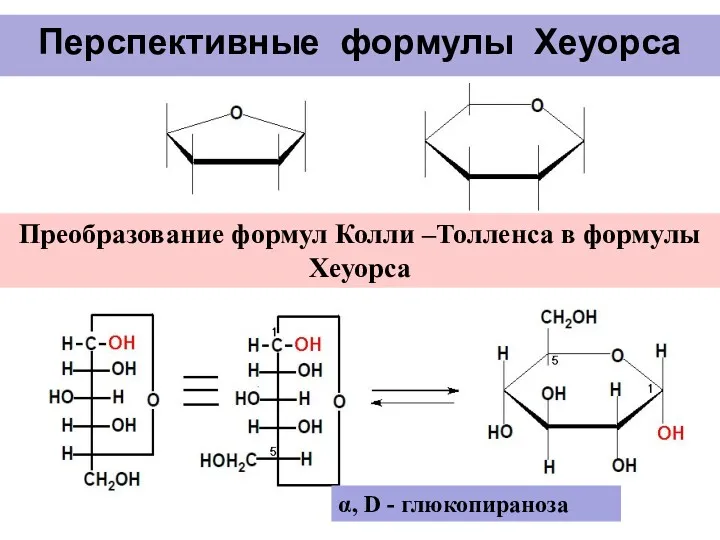
- 16. Перспективные формулы Хеуорса Преобразование формул Колли –Толленса в формулы Хеуорса α, D - глюкопираноза
- 17. Гидроксильная группа при новом центре асимметрии является полуацетальной. Этот гидроксил называют также гликозидным. Гликозидный гидроксил проявляет
- 18. Н α,D - глюкофураноза β,D- глюкофураноза 1 4 1 4 О
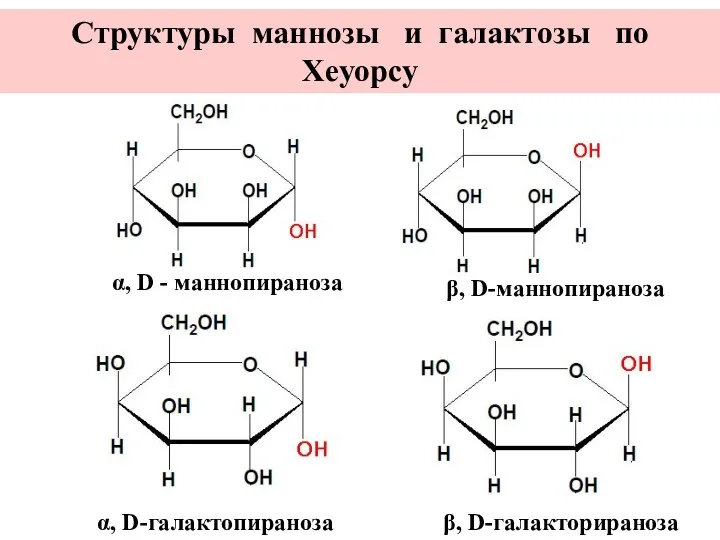
- 19. α, D - маннопираноза β, D-маннопираноза α, D-галактопираноза β, D-галакторираноза Структуры маннозы и галактозы по Хеуорсу
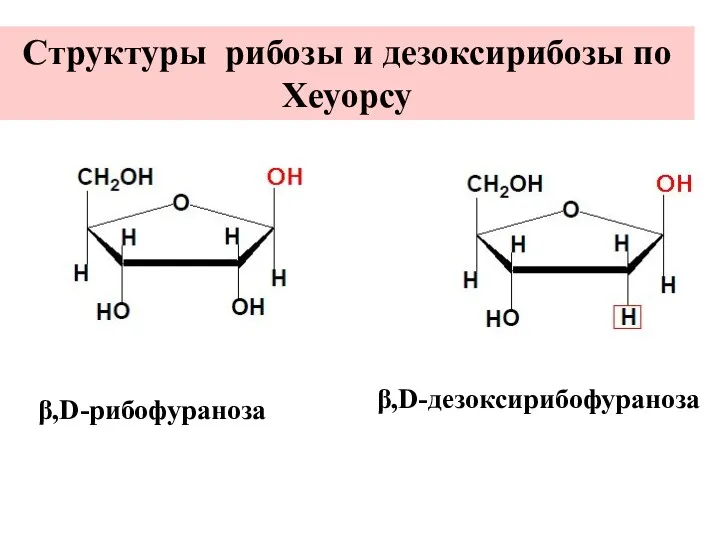
- 20. β,D-рибофураноза β,D-дезоксирибофураноза Структуры рибозы и дезоксирибозы по Хеуорсу
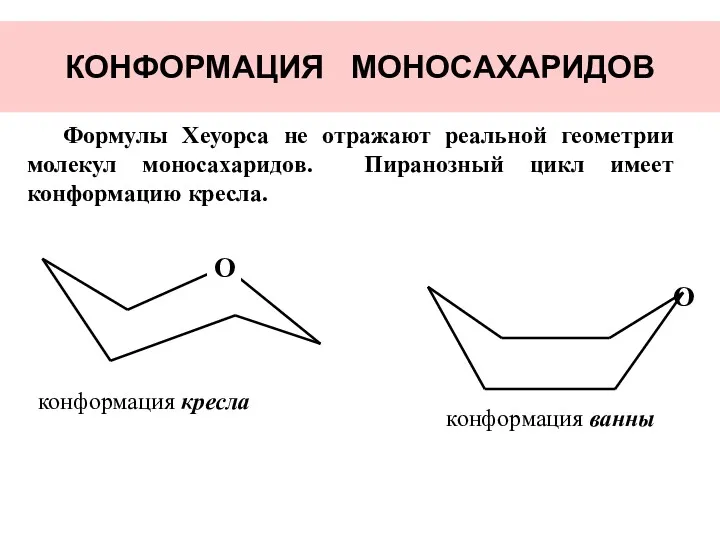
- 21. КОНФОРМАЦИЯ МОНОСАХАРИДОВ конформация кресла конформация ванны Формулы Хеуорса не отражают реальной геометрии молекул моносахаридов. Пиранозный цикл
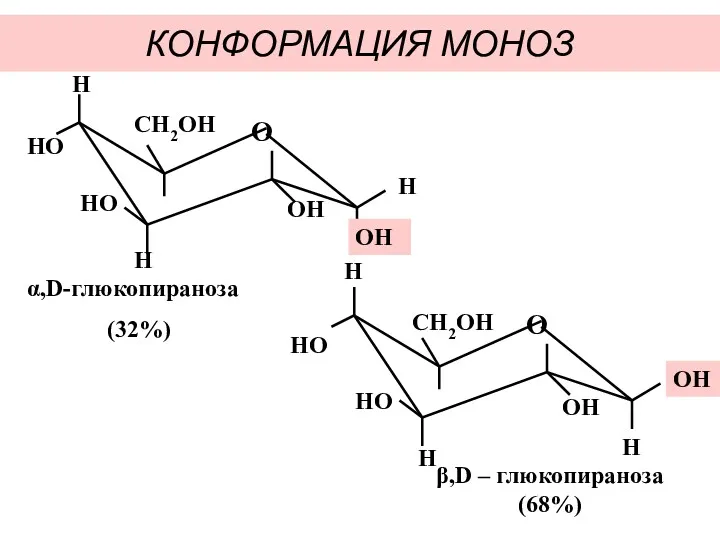
- 22. КОНФОРМАЦИЯ МОНОЗ α,D-глюкопираноза (32%) β,D – глюкопираноза (68%)
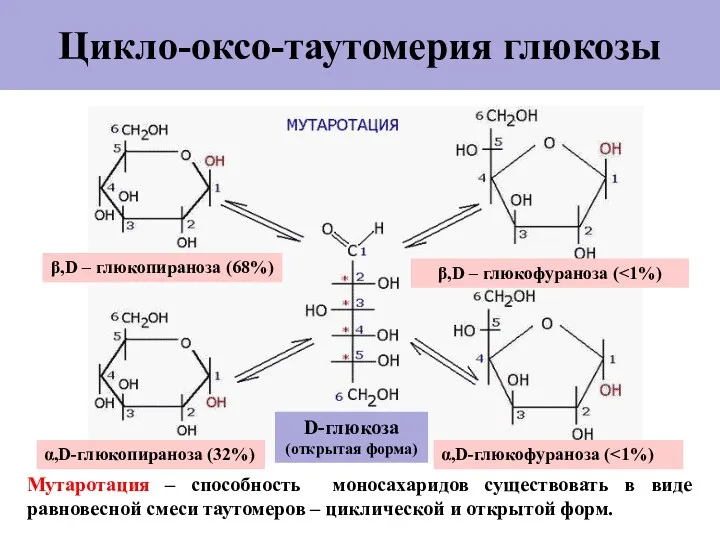
- 23. Цикло-оксо-таутомерия глюкозы Мутаротация – способность моносахаридов существовать в виде равновесной смеси таутомеров – циклической и открытой
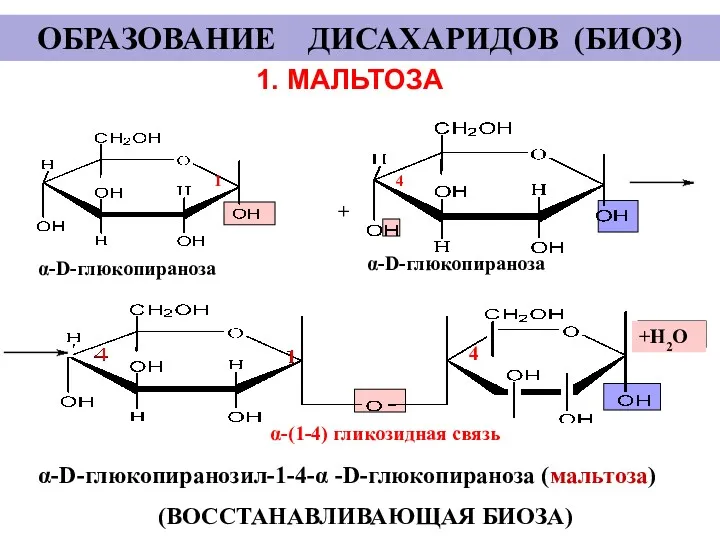
- 24. 1. МАЛЬТОЗА + α-D-глюкопираноза α-D-глюкопираноза α-D-глюкопиранозил-1-4-α -D-глюкопираноза (мальтоза) (ВОССТАНАВЛИВАЮЩАЯ БИОЗА) +Н2О 1 4 ОБРАЗОВАНИЕ ДИСАХАРИДОВ (БИОЗ)
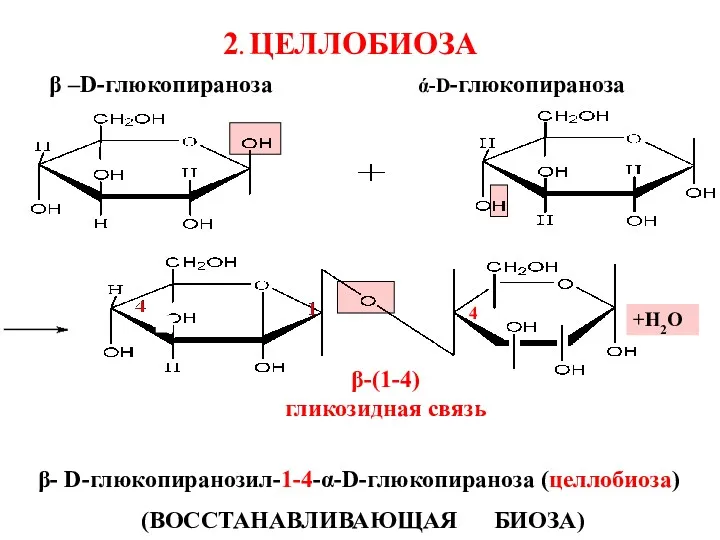
- 25. +Н2О β –D-глюкопираноза β- D-глюкопиранозил-1-4-α-D-глюкопираноза (целлобиоза) (ВОССТАНАВЛИВАЮЩАЯ БИОЗА) ά-D-глюкопираноза β-(1-4) гликозидная связь 4 2. ЦЕЛЛОБИОЗА
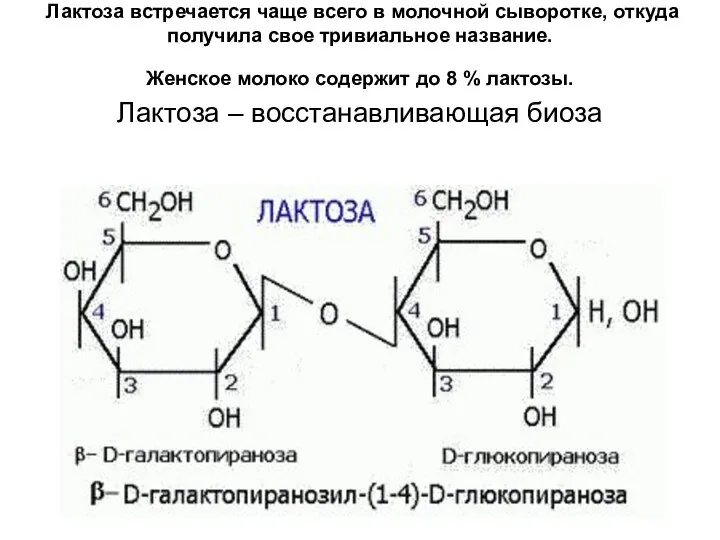
- 26. Лактоза встречается чаще всего в молочной сыворотке, откуда получила свое тривиальное название. Женское молоко содержит до
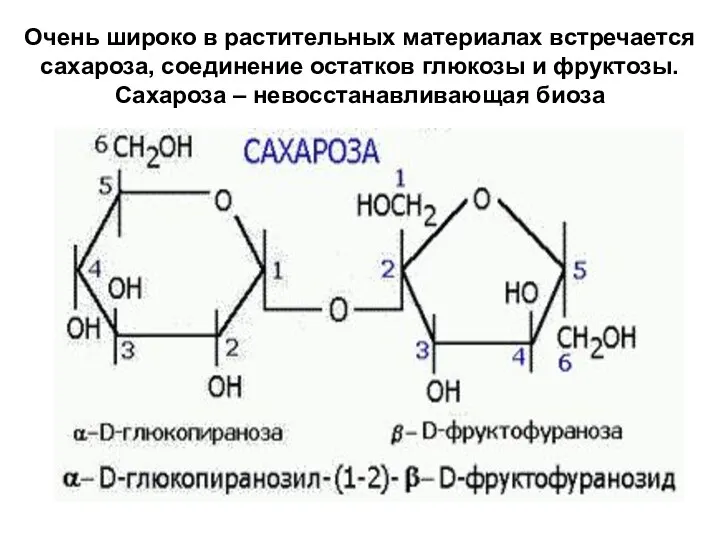
- 27. Очень широко в растительных материалах встречается сахароза, соединение остатков глюкозы и фруктозы. Сахароза – невосстанавливающая биоза
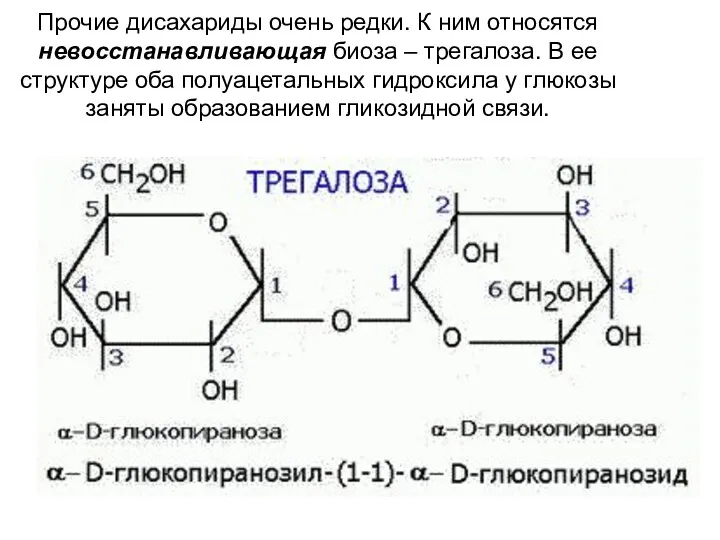
- 28. Прочие дисахариды очень редки. К ним относятся невосстанавливающая биоза – трегалоза. В ее структуре оба полуацетальных
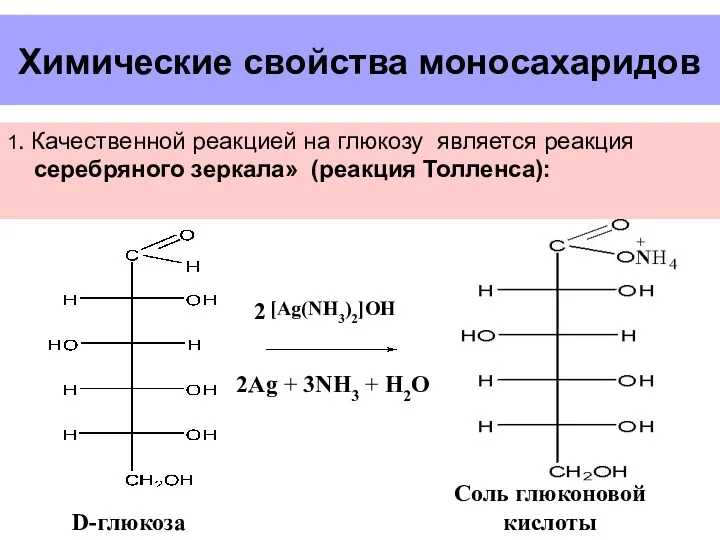
- 29. Химические свойства моносахаридов 1. Качественной реакцией на глюкозу является реакция серебряного зеркала» (реакция Толленса): [Ag(NH3)2]OH D-глюкоза
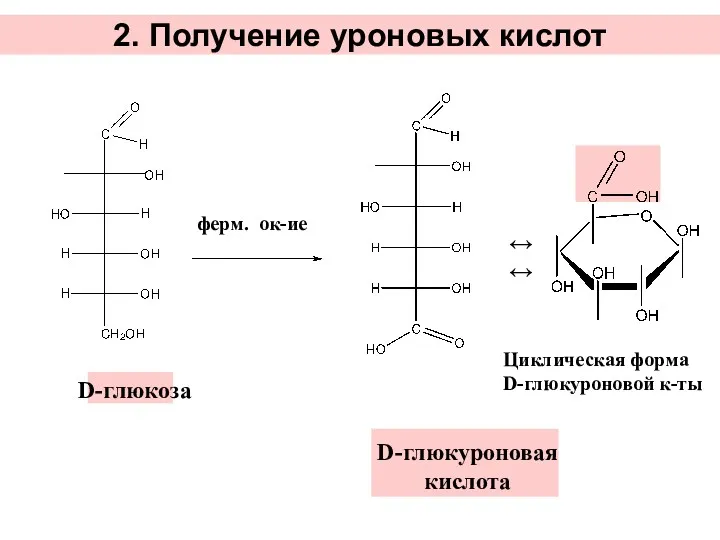
- 30. 2. Получение уроновых кислот ферм. ок-ие ↔↔ D-глюкоза D-глюкуроновая кислота Циклическая форма D-глюкуроновой к-ты
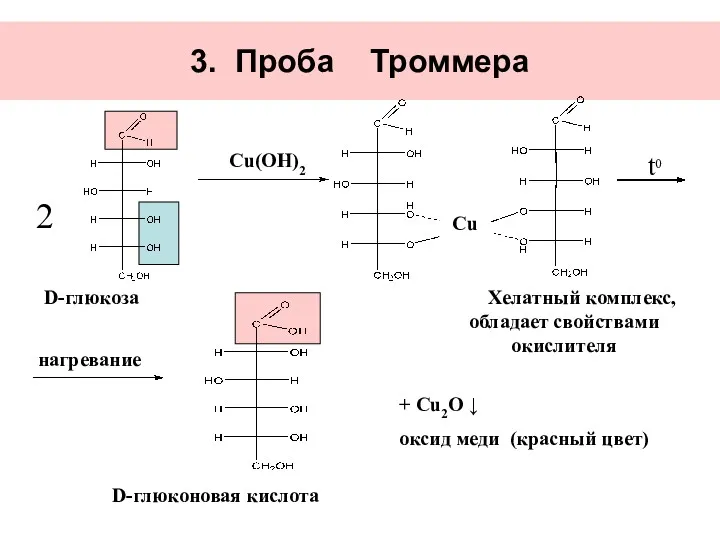
- 31. 3. Проба Троммера Сu(OH)2 нагревание D-глюкоза Хелатный комплекс, обладает свойствами окислителя D-глюконовая кислота + Сu2O ↓
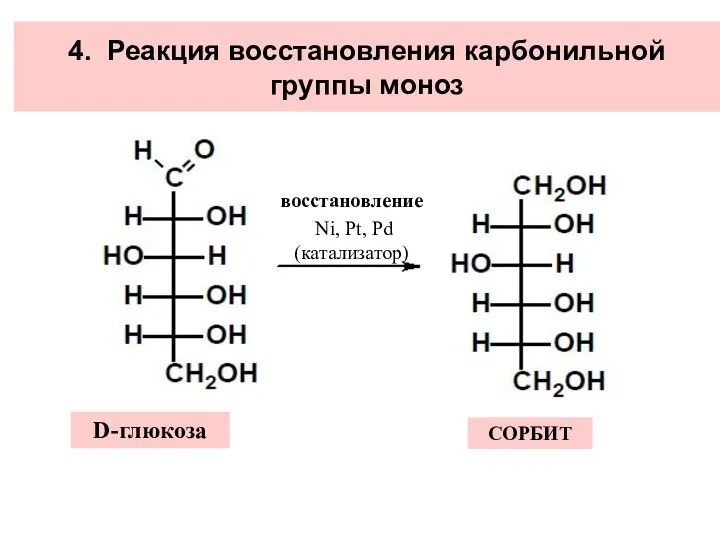
- 32. 4. Реакция восстановления карбонильной группы моноз восстановление Ni, Pt, Pd (катализатор) D-глюкоза СОРБИТ
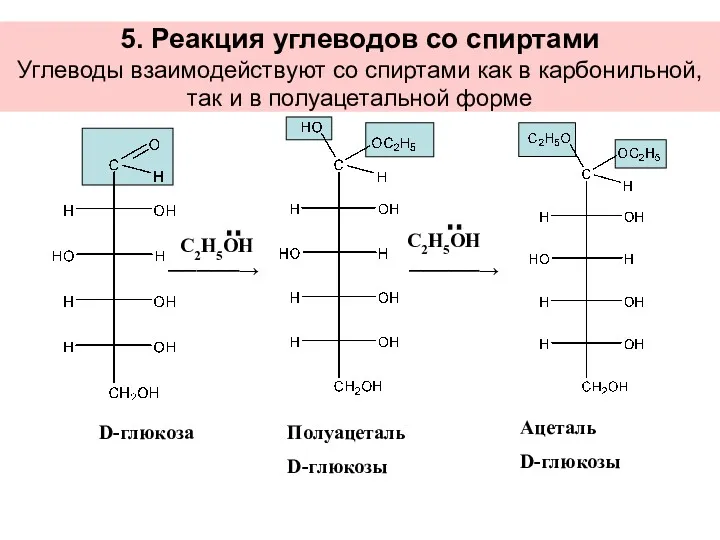
- 33. 5. Реакция углеводов со спиртами Углеводы взаимодействуют со спиртами как в карбонильной, так и в полуацетальной
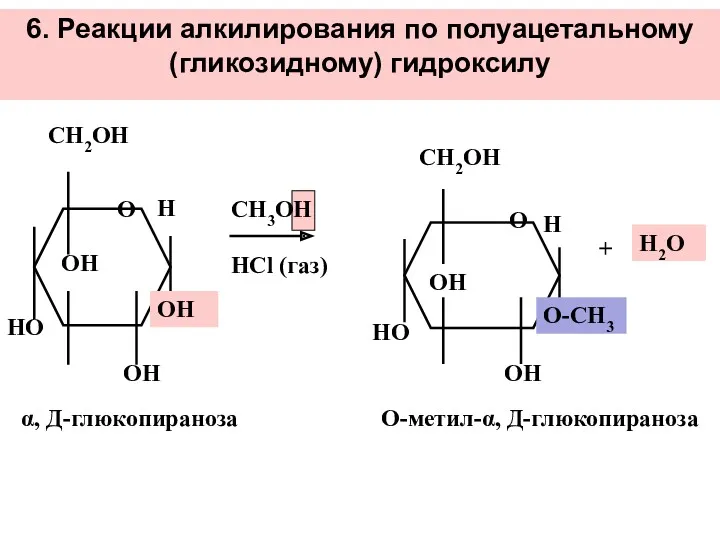
- 34. 6. Реакции алкилирования по полуацетальному (гликозидному) гидроксилу СН3ОН НСl (газ) ОН + Н2О О-метил-α, Д-глюкопираноза α,
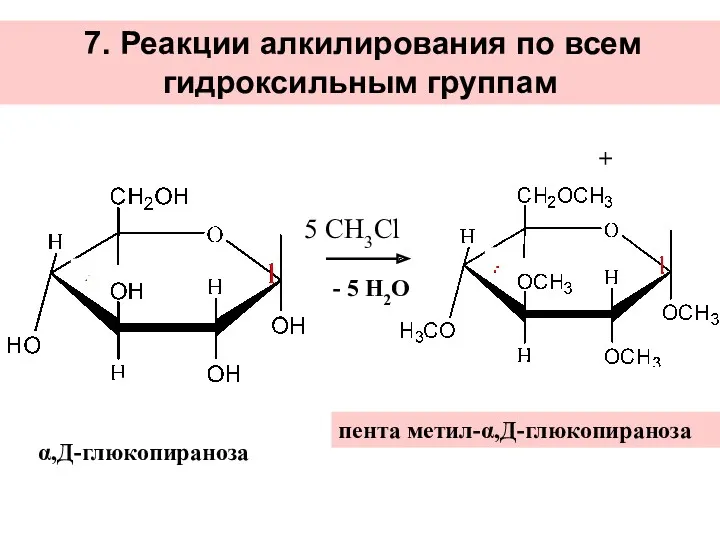
- 35. 7. Реакции алкилирования по всем гидроксильным группам 5 СН3Cl + - 5 Н2О α,Д-глюкопираноза пента метил-α,Д-глюкопираноза
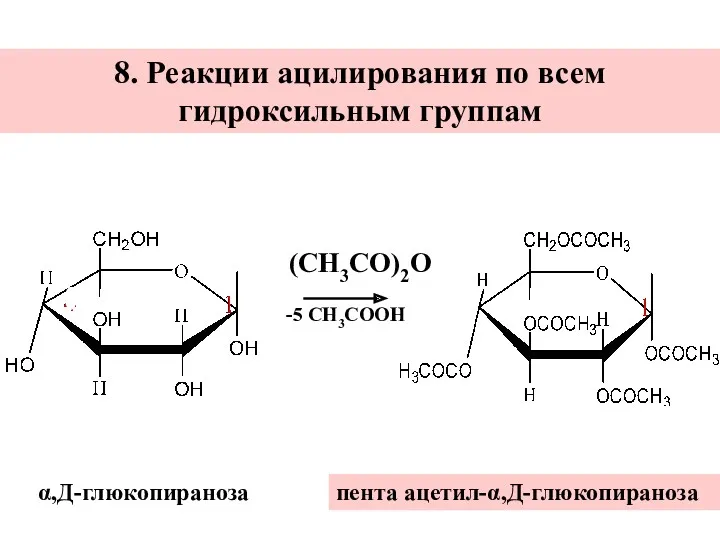
- 36. 8. Реакции ацилирования по всем гидроксильным группам пента ацетил-α,Д-глюкопираноза α,Д-глюкопираноза -5 СН3СООН (СН3СО)2О
- 38. Скачать презентацию



 Строение атома, изотопы
Строение атома, изотопы Кислородсодержащие органические соединения- спирты. 10 класс
Кислородсодержащие органические соединения- спирты. 10 класс Признаки химических реакций. (Практическая работа 5,4)
Признаки химических реакций. (Практическая работа 5,4) Редкоземельные металлы
Редкоземельные металлы Золото. Виды золота
Золото. Виды золота Химическая промышленность
Химическая промышленность Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Гидролиз солей
Гидролиз солей Ароматты комирсутектер Бензол
Ароматты комирсутектер Бензол Основные и опасные свойства природного газа
Основные и опасные свойства природного газа Атомы, молекулы и ионы
Атомы, молекулы и ионы Лекция 4. Физико-химические свойства растворов
Лекция 4. Физико-химические свойства растворов Пурины. Строение пурина
Пурины. Строение пурина Периодическая система химических элементов. Периоды
Периодическая система химических элементов. Периоды Периодический закон и система элементов Д.И. Менделеева
Периодический закон и система элементов Д.И. Менделеева Количество вещества. 8 класс
Количество вещества. 8 класс Азотная кислота и нитраты
Азотная кислота и нитраты Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды
Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды Хром, марганец
Хром, марганец Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Комплексные соединения
Комплексные соединения Щелочной металл натрий
Щелочной металл натрий Алканы в природе
Алканы в природе Оксид фосфора P2O5
Оксид фосфора P2O5 Аккумуляторные батареи
Аккумуляторные батареи Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2)