Слайд 2
КРЕМНИЙ
- это химический элемент.
- это простое вещество.
Слайд 3
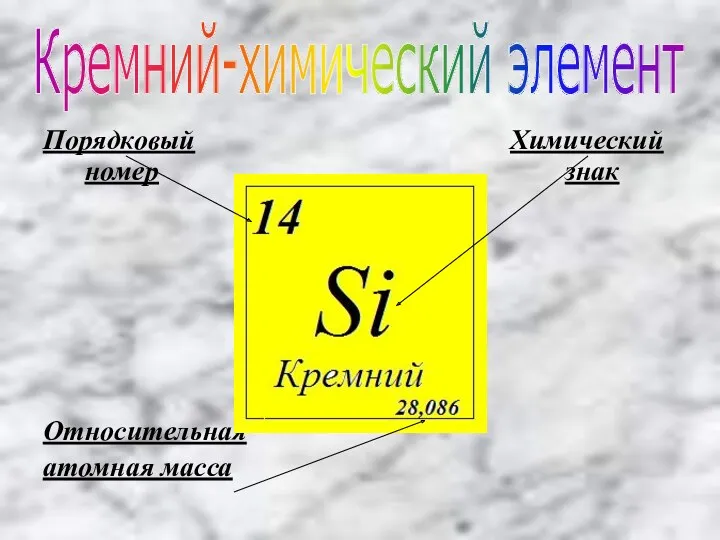
Порядковый Химический
номер знак
Относительная
атомная масса
Кремний-химический элемент
Слайд 4

В периодической системе Д.И.Менделеева,
кремний находится в IV группе, главной
подгруппы, III периода.
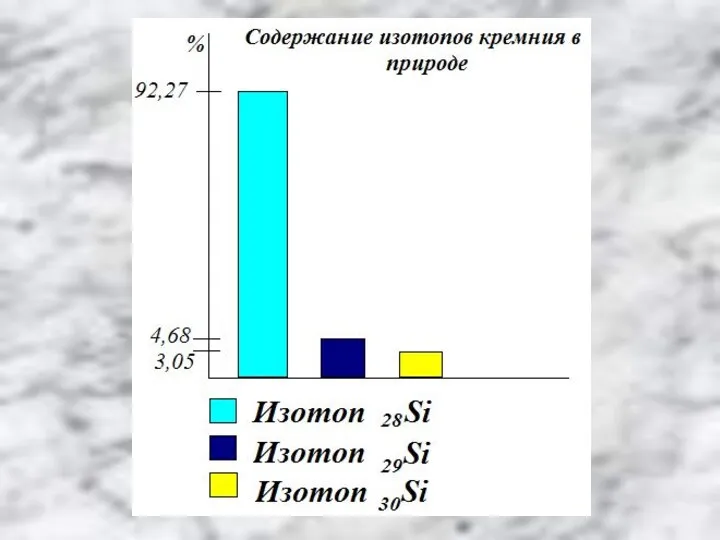
В природе элемент представлен тремя стабильными изотопами: 28Si; 29Si и 30Si.
Число протонов, электронов, нейтронов- 14р+, 14ē, 14n0
Слайд 5
Слайд 6

Электронная конфигурация:
1s22s22p63s23p2
Электронно-графическая формула:
Е 3p
3s
Семейство: р-элемент
Слайд 7

Схема распределения электронов в атоме:
14Si )))
2 8 4
Степени окисления:
-4; 0; +4
SiH4 Si SiCl4
Характер элемента:
Неметалл
+14
Слайд 8

Важнейшие соединения.
Высший оксид – SiO2 (оксид кремния (IV) )
Высший гидроксид –
H2SiO3 (кремниевая
кислота)
Летучее соединение - SiH4 (силан)
Слайд 9

Нахождение в природе
Кремний – один из распространенных в земле элементов
(более 25% массы). Главная часть земной коры состоит из силикатных пород, представляющих собой соединения кремния с кислородом и рядом других элементов.
Соединения, в состав которых входит оксид алюминия, называются алюмо-силикатами. Таковы: белая глина, полевой шпат, слюда.
Слайд 10

Белая глина
Полевой шпат
Слюда
Слайд 11

Значительная часть природного кремния представлена оксидом крем-ния (IV). Свободного оксида
кремния в земной коре около 12%, в виде горных пород – 43%. Оксид кремния, окрашен-ный различными примесями, образует драгоценные и полудрагоценные камни, например, аквамарин, изумруд, топаз и др.
Слайд 12

Слайд 13

История открытия
В чистом виде кремний был выделен в 1811 году
французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром. Название у него латинского происхождения («silex» - кремень). В 1834 году русский химик Герман Иванович Гесс ввел другое наименование - кремний.
Слайд 14

Химическая формула-
Относительная молекулярная масса-
Кремний - простое вещество
Si
28,086 г/моль
Слайд 15

Слайд 16

Кремний кристаллический
Кремний аморфный
Слайд 17

Тип химической связи:
ковалентная неполярная
Тип структуры кристаллической решётки:
атомная
Слайд 18
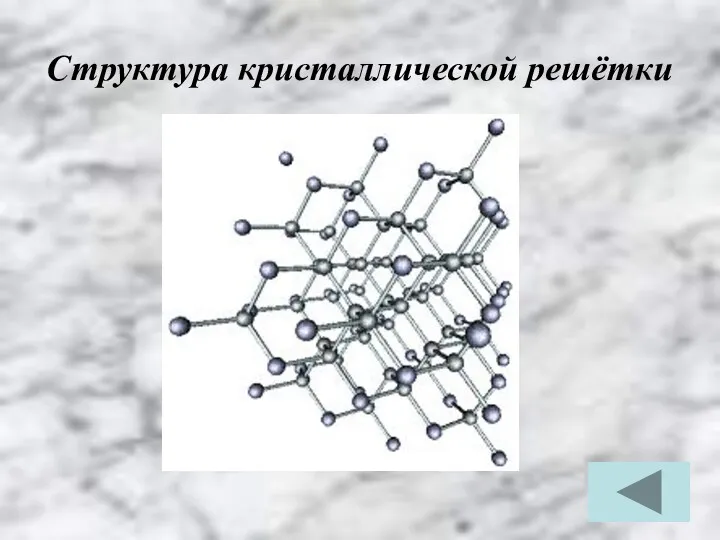
Структура кристаллической решётки
Слайд 19
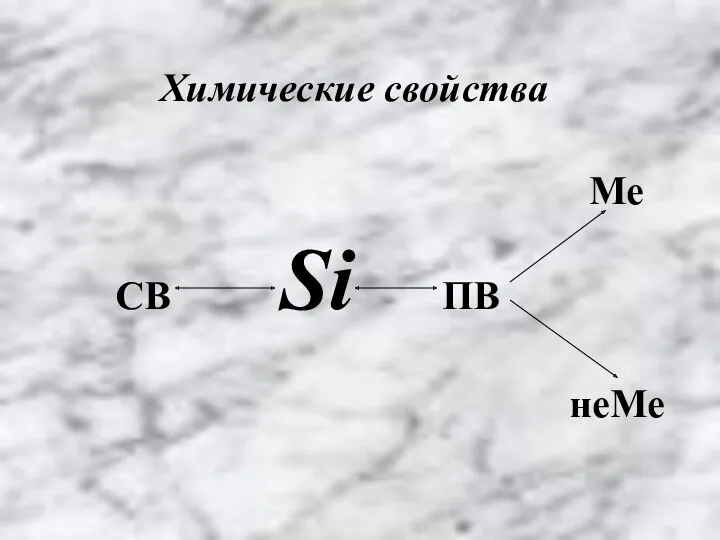
Ме СВ Si ПВ неМе
Химические свойства
Слайд 20

Проявляет восстановительные свойства:
Реагирует с простыми веществами – неметаллами
а) с галогенами:
Si
+2F2 = SiF4
Si + 2Cl2 = SiCl4
Si + 2Br2 = SiBr4
б) с кислородом (при t°)
Si + O2 = SiO2
Слайд 21

2. взаимодействует со сложными веществами:
-кислотами:
3Si+12HF+4HNO3 = 3SiF4+4NO +8H2O
-щелочами:
Si+2NaOH+H2O = Na2SiO3+2H2
Проявляет окислительные
свойства:
а) с металлами:
Si+2Mg = Mg2Si
Слайд 22

Si
Электротехнике
Производство жаропрочных сталей
Солнечные батареи
Слайд 23

Получение
-в промышленности
В электрических печах при высокой температуре происходит восстановление кремния
из его оксида коксом (углём):
SiO2+2C = Si+2CO
-в лаборатории
В качестве восстановителей используют магний или алюминий:
SiO2+2Mg = Si+2MgO
3SiO2+4Al = 3Si+2Al2O3
Слайд 24

Слайд 25

Химическая формула:
SiO2
Молекулярная масса:
М(SiO2)=60
Слайд 26

Физические свойства
Твёрдое тугоплавкое вещество. Не растворимое в воде, из всех
кислот только плавиковая кислота постепенно разлагает его.
Слайд 27

Химические свойства
реагирует с….
-основными оксидами
SiO2+Na2O = Na2SiO3
-щелочами
SiO2+NaOH = Na2SiO3 + H2O
-солям
«летучих» кислот
SiO2+CaCO3 = CaSiO3 + CO2
-плавиковой кислотой
SiO2+4HF= SiF4+2H2O
Слайд 28

Применение
Производство стекла
Керамические изделия
Адсорбенты
Изоляторы
Оптика
Слайд 29

Слайд 30

Химическая формула:
H2SiO3
Молекулярная масса:
М(H2SiO3)=78





























 Ертінділер. Ерітінді концентрациясын білдіру тәсілдері
Ертінділер. Ерітінді концентрациясын білдіру тәсілдері Жиры
Жиры Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль Кислоты, содержащие серу (S)
Кислоты, содержащие серу (S) Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях ОВР в органической химии
ОВР в органической химии Классификация и свойства оксидов
Классификация и свойства оксидов Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Классификация химических реакций
Классификация химических реакций Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Physiology lab
Physiology lab Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Периодическая система химических элементов. Знаки химических элементов
Периодическая система химических элементов. Знаки химических элементов Природный газ
Природный газ Застосування арт-терапевтичних технік на уроках хімії
Застосування арт-терапевтичних технік на уроках хімії Нефть и ее роль в мировой экономике
Нефть и ее роль в мировой экономике Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Швидкість хімічної реакції
Швидкість хімічної реакції Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Новые катализаторы
Новые катализаторы Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Металлы. Общая характеристика
Металлы. Общая характеристика Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Гетероциклы с одним гетероатомом
Гетероциклы с одним гетероатомом Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Химиялық тепе-теңдік
Химиялық тепе-теңдік