Слайд 2

Химиялық тепе-теңдік күйге әрекеттесетін заттардың концентрациясы, температура ал газ күйіндегі заттарға
қысым әсер етеді.
Реакциялаушы жүйенің бір тепе теңдік күйден басқа тепе-теңдік күйге ауысуын химиялық тепе-теңдіктің ығысуы деп аталады.
1884жылы химиялық тепе-теңдіктің ығысу заңдылығы қортындыланып шығарылады. Бұл заңдылықты
«Ле Штателье»деп атайды.
Слайд 3

Химиялық тепе-теңдік
Бірдей жағдайда қарама-қарсы екі бағытта жүретін реакциялар қайтымды реакциялар деп
аталады.
Fe₃O₄ + 4H₂ 3Fe + 4H₂O
Солдан оңға қарай жазылған реакция тура, ал оңнан солға қарай жазылған реакция кері реакция деп аталады.
Слайд 4

Қайтымды реакциядарда, тура және кері реакциялардың жылдамдықтары теңескен күйді химиялық тепе-теңдік
деп атайды.
Химиялық тепе-теңдік кезінде реакйиядар тоқтап қалмайды, тек қарама-қарсы реакцияладың жылдамдықтары ғана теңесетін процесс. Сондықтан оны жылжымалы немесе динамикалық тепе–теңдік деп атайды
Слайд 5
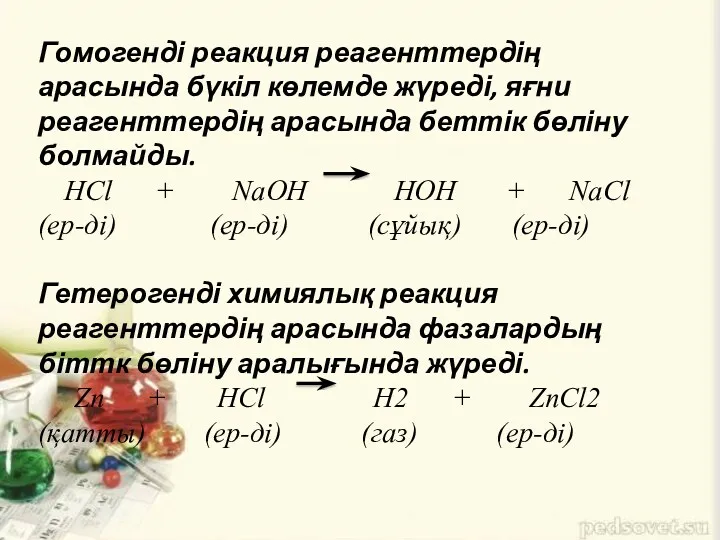
Гомогенді реакция реагенттердің арасында бүкіл көлемде жүреді, яғни реагенттердің арасында беттік
бөліну болмайды.
HCl + NaOH HOH + NaCl
(ер-ді) (ер-ді) (сұйық) (ер-ді)
Гетерогенді химиялық реакция
реагенттердің арасында фазалардың біттк бөліну аралығында жүреді.
Zn + HCl H2 + ZnCl2
(қатты) (ер-ді) (газ) (ер-ді)




 Комплексные соединения
Комплексные соединения Пиролиз углеводородного сырья
Пиролиз углеводородного сырья Ионные уравнения
Ионные уравнения Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Электронное строение атома и Периодический закон
Электронное строение атома и Периодический закон Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Корунд. Разновидности корунда
Корунд. Разновидности корунда Apparatus of installations with circulating ball catalyst
Apparatus of installations with circulating ball catalyst Ветеринариялық гигиена және санитария
Ветеринариялық гигиена және санитария Нефть как дисперсная система
Нефть как дисперсная система Химический КВИЗ
Химический КВИЗ Охрана труда в кабинете (лаборатории) химии образовательного учреждения
Охрана труда в кабинете (лаборатории) химии образовательного учреждения Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Газовая хроматография
Газовая хроматография Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Жиры
Жиры Углеводы. Урок №9. 9 класс
Углеводы. Урок №9. 9 класс Значение пищи и ее состав
Значение пищи и ее состав Chemical kinetics
Chemical kinetics Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Получение ЛС неорганической природы
Получение ЛС неорганической природы Горючее, смазочные материалы и специальные жидкости
Горючее, смазочные материалы и специальные жидкости Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Химическое равновесие. 11 класс
Химическое равновесие. 11 класс Происхождение химичесих элементов
Происхождение химичесих элементов