Содержание
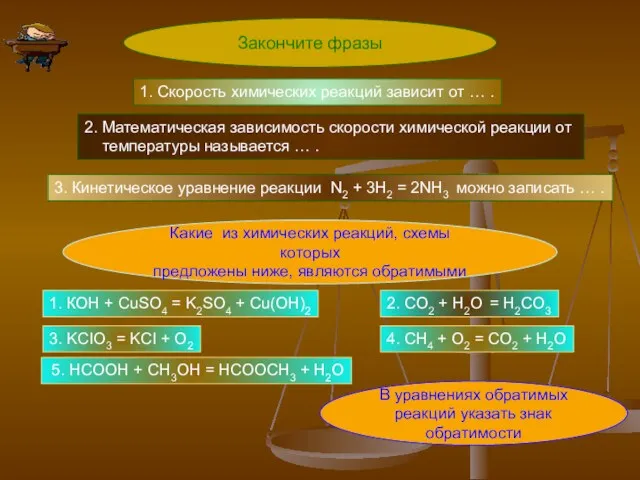
- 2. Закончите фразы 1. Скорость химических реакций зависит от … . 2. Математическая зависимость скорости химической реакции
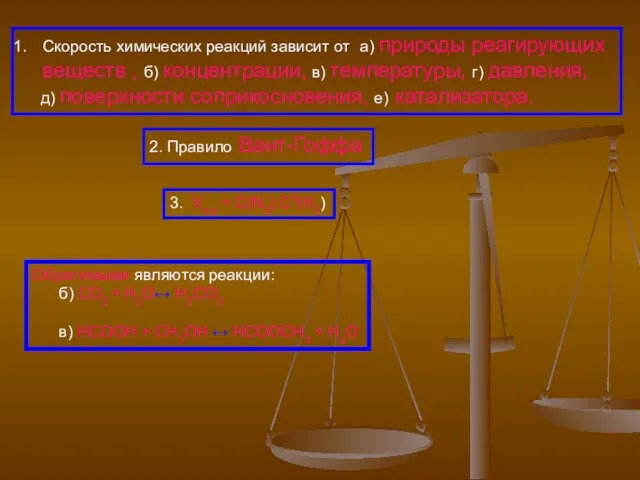
- 3. Скорость химических реакций зависит от а) природы реагирующих веществ , б) концентрации, в) температуры, г) давления,
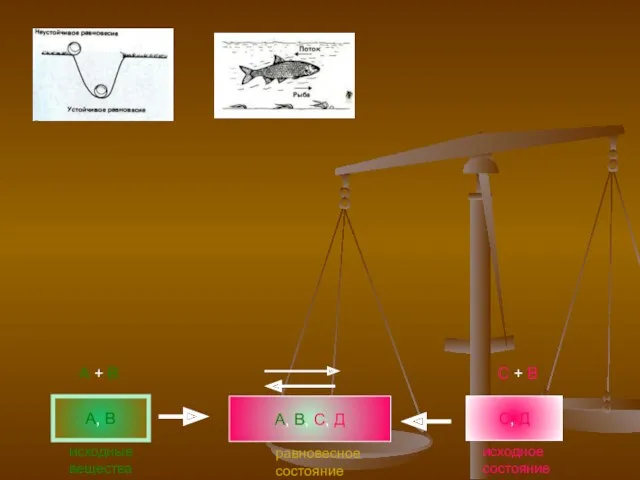
- 4. А, В А, В, С, Д С, Д А + В исходные вещества равновесное состояние исходное
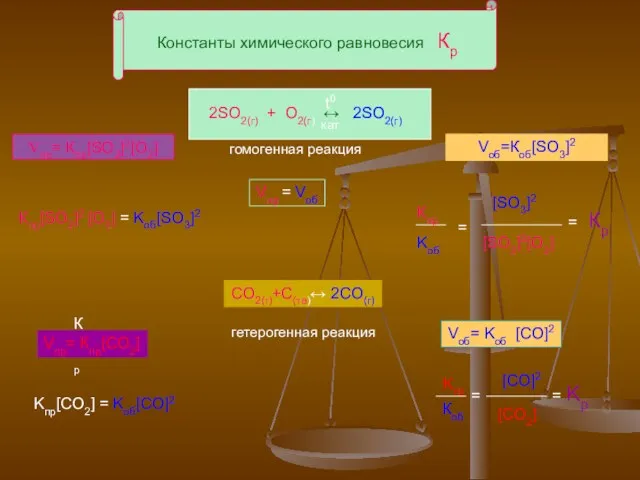
- 5. Константы химического равновесия Кр 2SO2(г) + O2(г) ↔ 2SO2(г) t0 кат Vпр= Кпр[SO2]2[O2] Vпр = Vоб
- 6. Анри Луи Ле Шателье 1850-1936 Французский физикохимик , занимался процессами горения, взрывов. Самое известное, но далеко
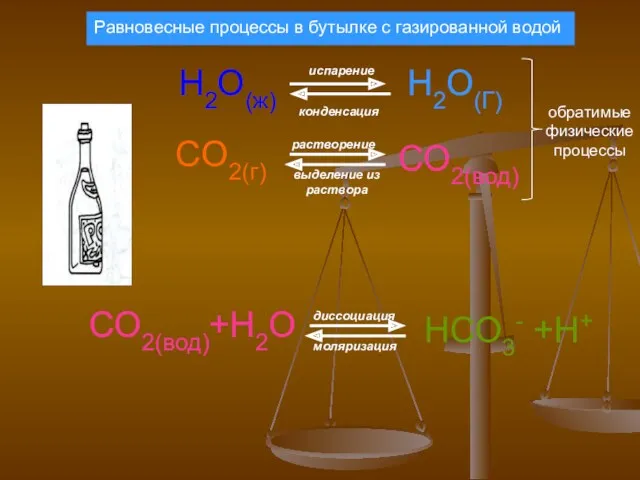
- 7. H2O(ж) испарение конденсация Н2О(Г) CO2(г) СО2(вод) растворение выделение из раствора СО2(вод)+Н2О НСО3- +Н+ диссоциация моляризация обратимые
- 8. Значения констант равновесия некоторых химических реакций
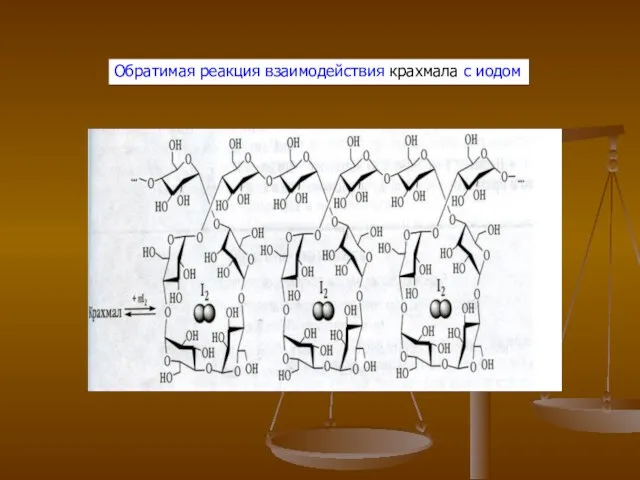
- 9. Обратимая реакция взаимодействия крахмала с иодом
- 10. Даны схемы химических реакций 1) Н2(г) + О2 ↔ Н2О + Q 2) СаСО3(тв) ↔ СаО(тв)
- 12. Скачать презентацию



 Угарный газ
Угарный газ Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Химия в повседневной жизни человека
Химия в повседневной жизни человека Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)
Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ) Простейшие представления о кинетике химических реакций
Простейшие представления о кинетике химических реакций Органическая химия
Органическая химия Кинетическое уравнение математическая запись закона действующих масс
Кинетическое уравнение математическая запись закона действующих масс Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Необоротні і оборотні хімічні процеси. Хімічна рівновага
Необоротні і оборотні хімічні процеси. Хімічна рівновага Химический элемент V группы: сурьма
Химический элемент V группы: сурьма Интоксикация ртутью
Интоксикация ртутью Качественные реакции на органические вещества
Качественные реакции на органические вещества Crystal Defects and Noncrystalline Structure–Imperfection
Crystal Defects and Noncrystalline Structure–Imperfection Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле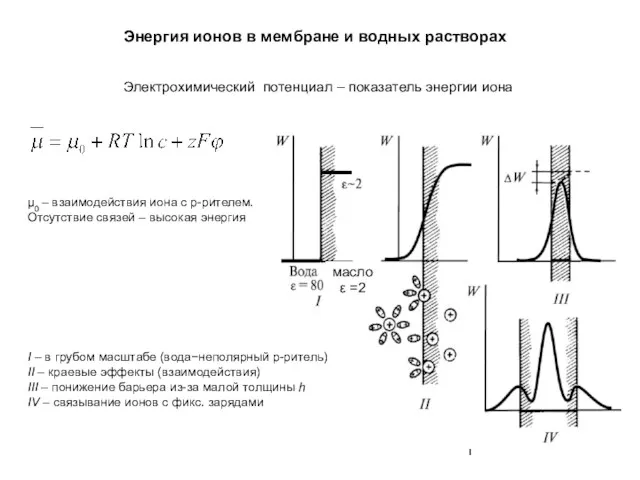 Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Карбонильные соединения
Карбонильные соединения Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Химическая связь
Химическая связь Металлы II группы главной подгруппы
Металлы II группы главной подгруппы Паровые зоны в гидротермальных системах
Паровые зоны в гидротермальных системах Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Состояние атмосферного воздуха в Ярославской области
Состояние атмосферного воздуха в Ярославской области Теплота горения
Теплота горения Ionic polymerization
Ionic polymerization Химия. Изучение жиров
Химия. Изучение жиров Сутектік көрсеткіш ph. Тұздар гидролизі
Сутектік көрсеткіш ph. Тұздар гидролизі