Содержание
- 2. Металлы II группы главной подгруппы Цель: Дать общую характеристику металлам II группы (А) главной подгруппы П.С.Х.Э.
- 3. Положение металлов в Периодической системе Изменение свойств в группе История названия Нахождение в природе Физические свойства
- 4. Металлы II группы главной подгруппы Bе бериллий Mg магний Ca кальций Sr стронций Ba барий Rа
- 5. Щелочноземельные металлы: Mg Ca Sr Ba Rа Происхождение этого названия связано с тем, что их гидроксиды
- 6. Строение атома Mg +12 2ē, 8ē, 2ē Ca +20 2ē, 8ē, 8 ē, 2ē Sr +38
- 7. Бериллий, магний и щелочноземельные металлы находятся в IIA-группе Строение внешнего энергетического уровня ns2 Максимальная степень окисления
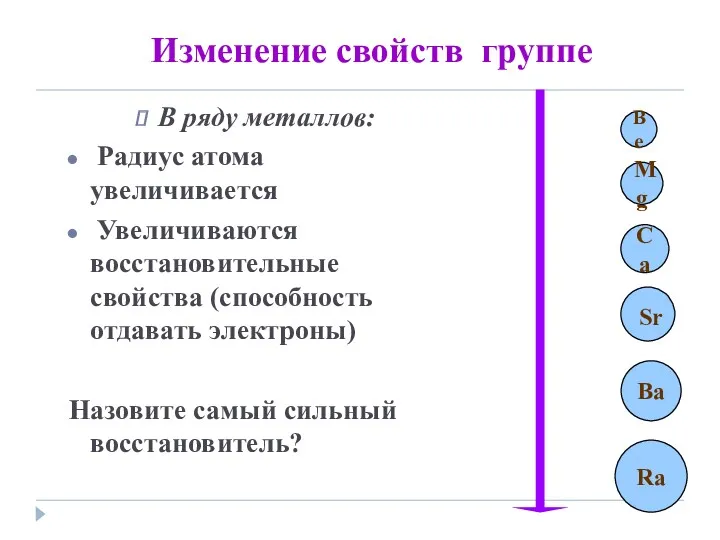
- 8. Изменение свойств группе В ряду металлов: Радиус атома увеличивается Увеличиваются восстановительные свойства (способность отдавать электроны) Назовите
- 9. Щелочные металлы легкие, мягкие и легкоплавкие, серебристы, стронций имеет золотистый оттенок. Стронций - ковкий Физические свойства
- 10. Физические свойства цвет пламени þ t плавления 1,74г/см3 651 С0 1,54г/см3 851С0 2,63г/см3 770С0 3,76г/см3 710С0
- 11. ОТКРЫТИЕ МЕТАЛЛОВ Магний и кальций были впервые получены английским химиком и физиком Г. Дэви в 1808
- 12. Магниевая горная порода – магнезит. Нахождение в природе Как активные металлы, они встречаются в природе только
- 13. MgCO3 Карбонат магния - широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для
- 14. В природе: CaCO3 Карбонат кальция – одно из самых распространённых на Земле соединений. Его содержат горные
- 15. CaSO4∙ 2H2O Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат – сульфата кальция. Используется
- 16. MgSO4 Сульфат магния - известный под названием горькая, или английская, соль, используют в медицине в качестве
- 17. Ca3(PO4)2 Фосфат кальция - входит в состав фосфоритов (горная порода) и апатитов (минерал), а также в
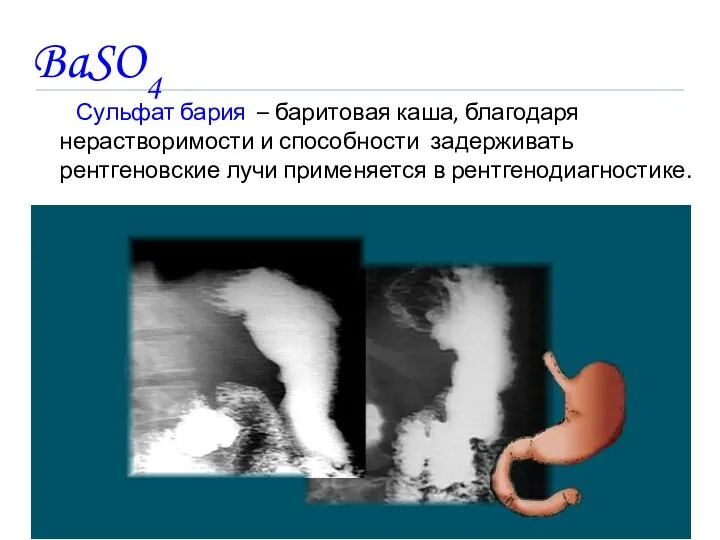
- 18. BaSO4 Сульфат бария – баритовая каша, благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике.
- 19. Са(ОН)2 Гидроксид кальция или гашеная известь называется известковым раствором, образуется при взаимодействии оксида кальция с водой,
- 20. Химические свойства 2Me0 + O02 → 2Me+2O-2 оксид Me0 + H02 → Me+2H2 гидрид Me0 +Cl02
- 21. Особенность бериллия: Бериллий – переходный элемент Бериллий и его соединения проявляют амфотерные свойства, реагируют с кислотами
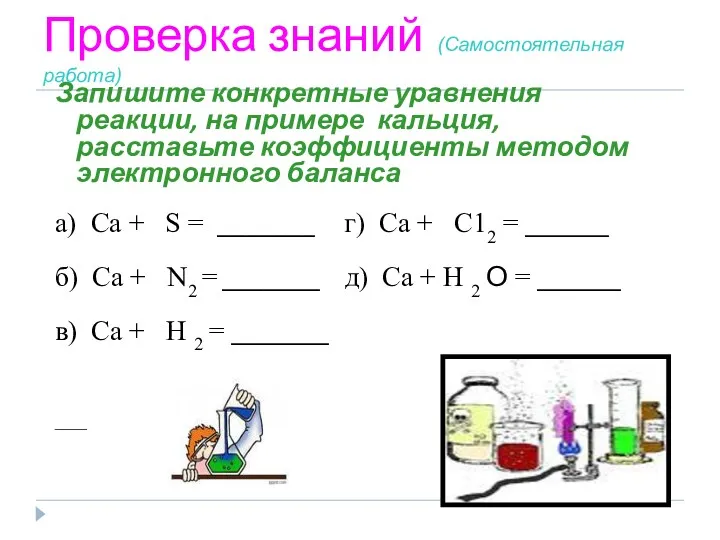
- 22. Проверка знаний (Самостоятельная работа) Запишите конкретные уравнения реакции, на примере кальция, расставьте коэффициенты методом электронного баланса
- 23. Домашнее задание: § 12. упр. № 3, 4,5.
- 24. Итог урока Познакомились с металлами II группы главной подгруппы П.С.Х.Э. Д.И.Менделеева Узнали общую характеристику металлов II
- 25. Используемая литература Габриелян О.С. Химия 9.-Москва.:Дрофа, 2013 Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия 9.
- 26. Спасибо за внимание
- 28. Скачать презентацию





















 Обобщение по теме Основные классы неорганических веществ. 8 класс
Обобщение по теме Основные классы неорганических веществ. 8 класс Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Электролиз
Электролиз Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Биофизические основы патологии клетки. Свободные радикалы и болезни человека
Биофизические основы патологии клетки. Свободные радикалы и болезни человека Растворы и растворимость. (8 класс)
Растворы и растворимость. (8 класс) Полимеры и их использование
Полимеры и их использование Металлы. Распространённость металлов в земной коре
Металлы. Распространённость металлов в земной коре Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов Электролитическая диссоциация
Электролитическая диссоциация Окислительно-восстановительные реакции. Электролиз
Окислительно-восстановительные реакции. Электролиз Альдегиды и кетоны. Лекция 10
Альдегиды и кетоны. Лекция 10 Электролиз
Электролиз Побочная подгруппа 6 и 7 групп
Побочная подгруппа 6 и 7 групп Современные методы образования амидной связи с использованием ацилгалогенидов, ангидридов, активированных эфиров и их аналогов
Современные методы образования амидной связи с использованием ацилгалогенидов, ангидридов, активированных эфиров и их аналогов Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Лекарственные средства, производные барбитуровой кислоты
Лекарственные средства, производные барбитуровой кислоты Растворы. Основные понятия и определения
Растворы. Основные понятия и определения Рідкі кристали
Рідкі кристали Основные понятия и законы химии. Тема1
Основные понятия и законы химии. Тема1 Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Методы восстановления и окисления
Методы восстановления и окисления Алкины. Гомологический ряд
Алкины. Гомологический ряд Химия көшбасшысы
Химия көшбасшысы Фосфор. Гипофосфатемия и гиперфосфатемия
Фосфор. Гипофосфатемия и гиперфосфатемия становление органической химии
становление органической химии Дифузія в побуті
Дифузія в побуті