Слайд 2

Окислительно-восстановительные реакции
переход е от одних атомов (или ионов) к другим атомам,
в
результате которых изменяется состояние окисления атомов.
Слайд 3

Окислительно-восстановительные реакции
окисление - отдача е.
восстановление - присоединение е.
восстановитель - вещество, которое
отдает е, т.е. окисляется
окислитель - вещество, которое принимает е, т.е. восстанавливается
Слайд 4

Окислительно-восстановительные реакции
Число е, отдаваемых восстановителем,
=
числу е, присоединяемых окислителем.
Слайд 5

Окислительно-восстановительные реакции
Mg + Cl2 = MgCl2
Mg0 – 2е → Mg+2 -
восстановитель (окисляется)
Cl20 + 2е → 2Cl-1 – окислитель (восстанавливается)
Слайд 6

Окислительно-восстановительные реакции
Вещество-окислитель
и вещество-восстановитель называют
сопряженной окислительно-восстановительной парой или системой.
Слайд 7

Типы окислительно-восстановительных реакций
межмолекулярные
протекают с изменением степени окисления атомов
в различных молекулах:
Mg + Cl2 = MgCl2
Слайд 8

Типы окислительно-восстановительных реакций
внутримолекулярные
– сопровождаются изменением степени окисления различных атомов в одной
и той же молекуле (реакции разложения):
2KClO3 = 2KCl + 3O2
Слайд 9

Типы окислительно-восстановительных реакций
диспропорционирования
– протекают с одновременным изменением степени окисления атомов одного
и того же элемента:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Слайд 10

Метод электронного баланса
подсчет числа отдаваемых и присоединяемых е проводится в соответствии
со значениями степеней окисления до и после реакции
Слайд 11

Метод электронного баланса
KMnO4 + KI + H2SO4 →
K2SO4 + MnSO4
+ I2 + H2O
Степень окисления изменяют только марганец и йод.
Слайд 12

Метод электронного баланса
Mn +7 + 5е → Mn +2 (восстановление)
2I -1
– 2е → I20 (окисление)
Слайд 13

Метод электронного баланса
Mn +7 + 5е → Mn +2 2
2I
-1 – 2е → I20 5
____________________
2Mn +7 + 10 I -1 → 2Mn +2 +5I2 0
Слайд 14

Метод электронного баланса
2KMnO4 + 10KI + H2SO4 →
K2SO4 + 2MnSO4
+ 5I2 + H2O
Слайд 15

Метод электронного баланса
суммарное уравнение:
2KMnO4 + 10KI + 8H2SO4 →
6K2SO4 +
2MnSO4 + 5I2 + 8H2O
Слайд 16

Ионно-электронный метод
(метод полуреакций)
- составление сокращенного ионного уравнения с участием
ионов, участвующих в процессах окисления и восстановления.
Слайд 17

Ионно-электронный метод
K+ + MnO4- + K+ + I- + 2H+ +
SO42-
→ 2K+ + SO42- + Mn2+ + SO42- + I2 + H2O
Слайд 18

Ионно-электронный метод
MnO4- + I- + 2H+ →
Mn2+ + I2 +
H2O
Слайд 19

Ионно-электронный метод
первая полуреакция:
MnO4- + 8H+ + 5е → Mn2+ + 4H2O
вторая
полуреакция:
2I - – 2е → I20
Слайд 20

Ионно-электронный метод
MnO4- + 8H+ + 5е →
Mn2+ + 4H2O 2 (восстановление)
2I
- – 2е → I20 5 (окисление)
______________________________
2MnO4- + 10I- + 16H+ →
2Mn2+ + 5I2 + 8H2O
Слайд 21

Ионно-электронный метод
суммарное уравнение:
2KMnO4 + 10KI + 8H2SO4 → 6K2SO4 + 2MnSO4
+ 5I2 + 8H2O
Слайд 22
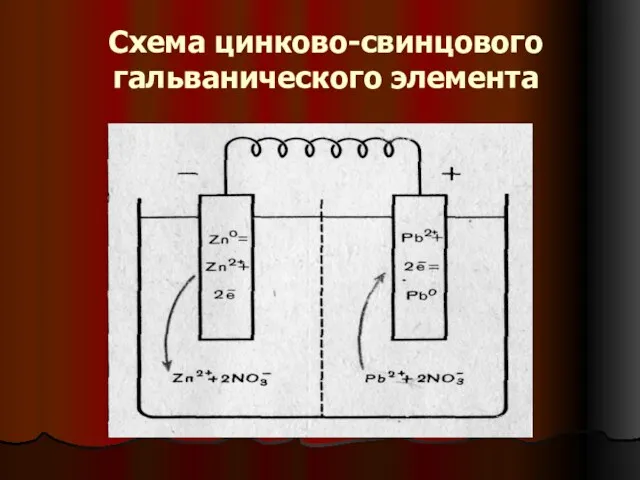
Схема цинково-свинцового гальванического элемента
Слайд 23

В гальваническом элементе
e идут от «-» полюса к «+» полюсу
восстановительные процессы
– на катоде «+»
окислительные процессы – на аноде
«-»
Химическая реакция протекает самопроизвольно.
Энергия реакции превращается в электрическую.
Слайд 24
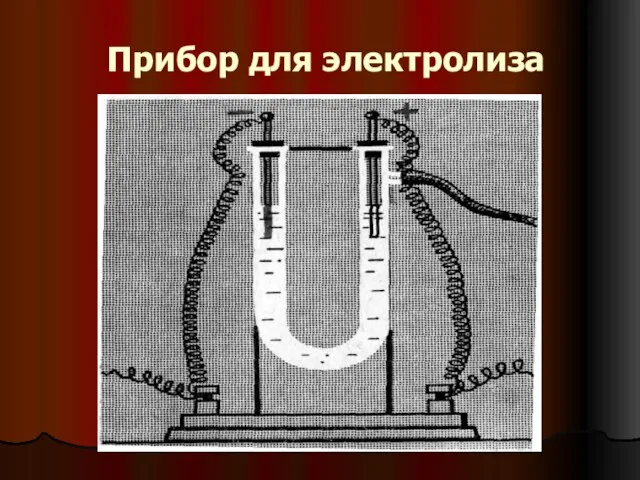
Слайд 25

Электролиз – ОВР, протекающие на электродах при прохождении через раствор или
расплав электролита электрического тока.
























 Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Фазовое равновесие
Фазовое равновесие Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Хром. Физические свойства и применение
Хром. Физические свойства и применение Валентность и степень окисления
Валентность и степень окисления Минералы и горные породы
Минералы и горные породы Алюминий и его соединения
Алюминий и его соединения Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Агрегатное состояние веществ и типы химических связей
Агрегатное состояние веществ и типы химических связей Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Азотная кислота и ее соли. 9 класс
Азотная кислота и ее соли. 9 класс Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Спирты
Спирты Оксиды углерода
Оксиды углерода Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация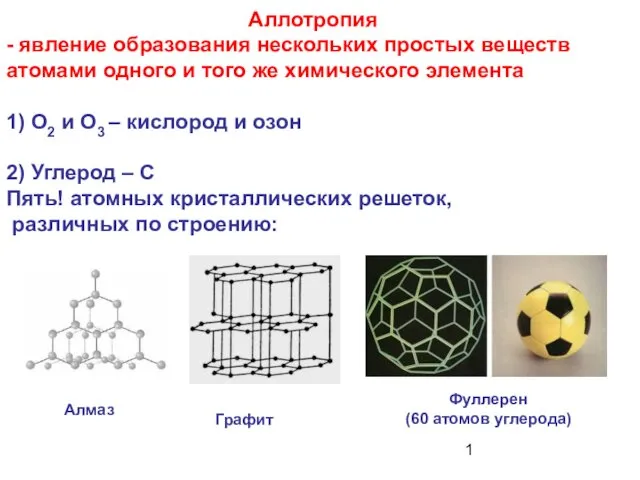 Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента
Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента Соли. 11 класс
Соли. 11 класс Аминокислоты
Аминокислоты Органические и неорганические кислоты
Органические и неорганические кислоты Отложения и коррозия
Отложения и коррозия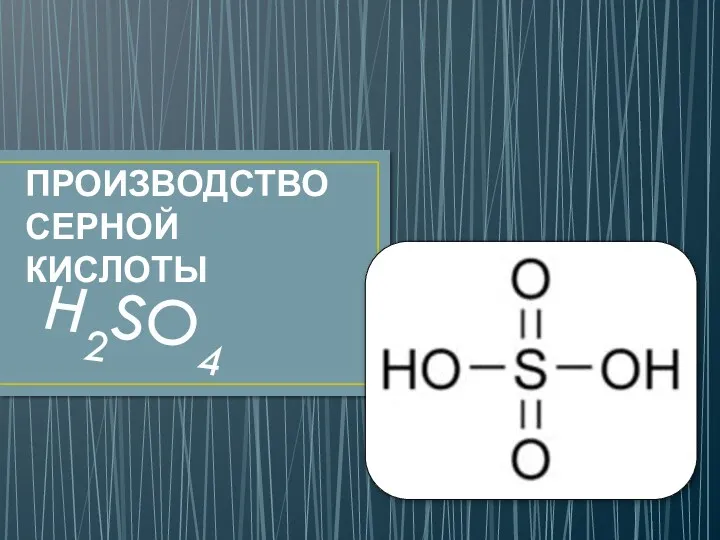 Производство серной кислоты
Производство серной кислоты Метод молекулярных орбиталей
Метод молекулярных орбиталей Водород. Общая характеристика, нахождение в природе. Получение и физические свойства
Водород. Общая характеристика, нахождение в природе. Получение и физические свойства Кисень та хімічні властивості кисню. 7 клас
Кисень та хімічні властивості кисню. 7 клас Химические свойства воды
Химические свойства воды Состав, строение и свойства аминокислот
Состав, строение и свойства аминокислот Сера
Сера Теория твердения минеральных вяжущих веществ
Теория твердения минеральных вяжущих веществ