Содержание
- 2. 29.11.2016 Русецкая О.П. Электролитическая диссоциация
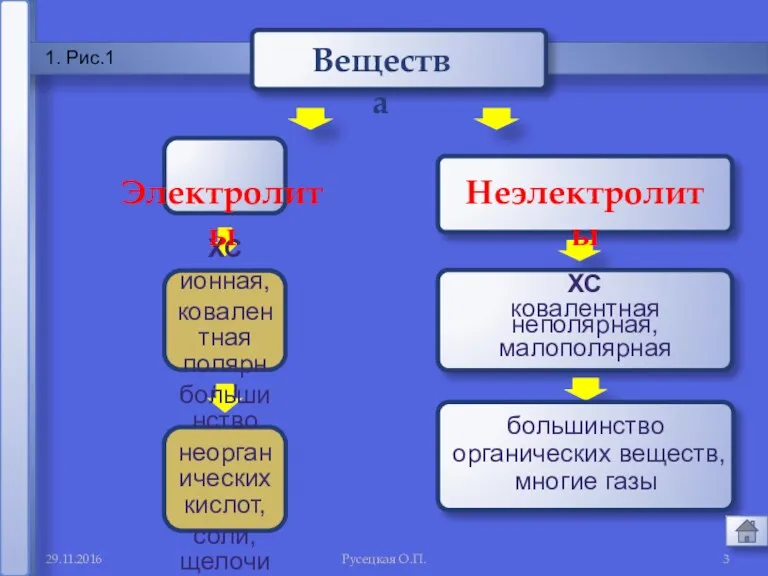
- 3. 29.11.2016 Русецкая О.П. 1 1. Рис.1 ХС ионная, ковалентная полярная большинство неорганических кислот, соли, щелочи Электролиты
- 4. 29.11.2016 «Капля воды и камень точит» 1. Электролиты и неэлектролиты Вода – хороший растворитель, т.к. молекулы
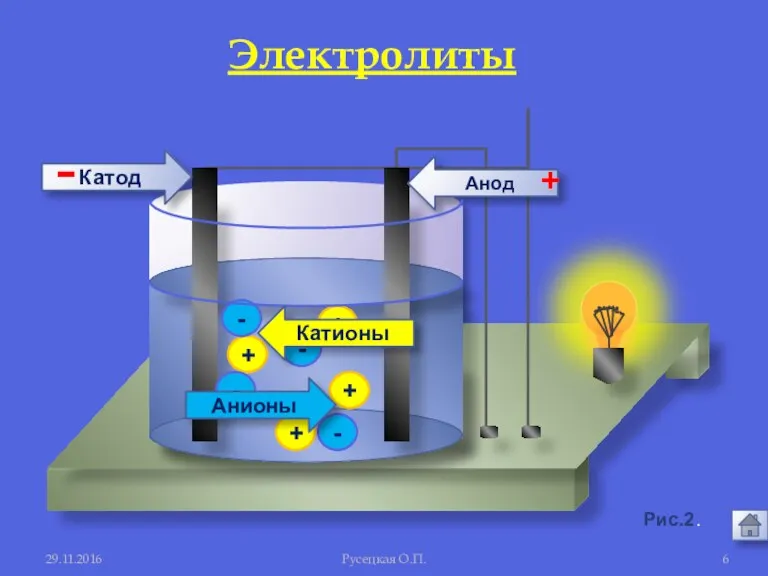
- 5. 29.11.2016 Русецкая О.П. 1. Электролиты и неэлектролиты это вещества, растворы и расплавы которых проводят электрический ток.
- 6. + + + + - - - - Анионы Катионы Анод Катод - + 29.11.2016 Русецкая
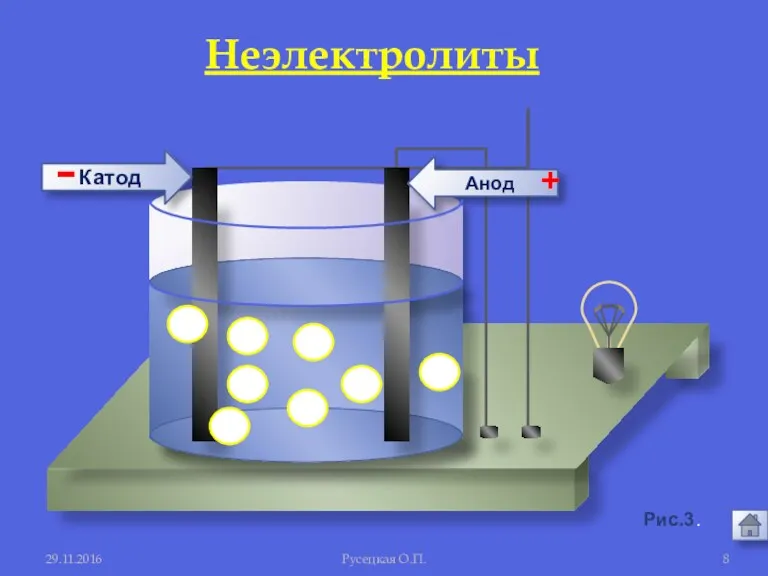
- 7. 29.11.2016 Русецкая О.П. 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический
- 8. Анод Катод - + 29.11.2016 Русецкая О.П. Рис.3. Неэлектролиты
- 9. 29.11.2016 «Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация процесс распада молекул
- 10. 29.11.2016 «Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация Аррениус Сванте Август
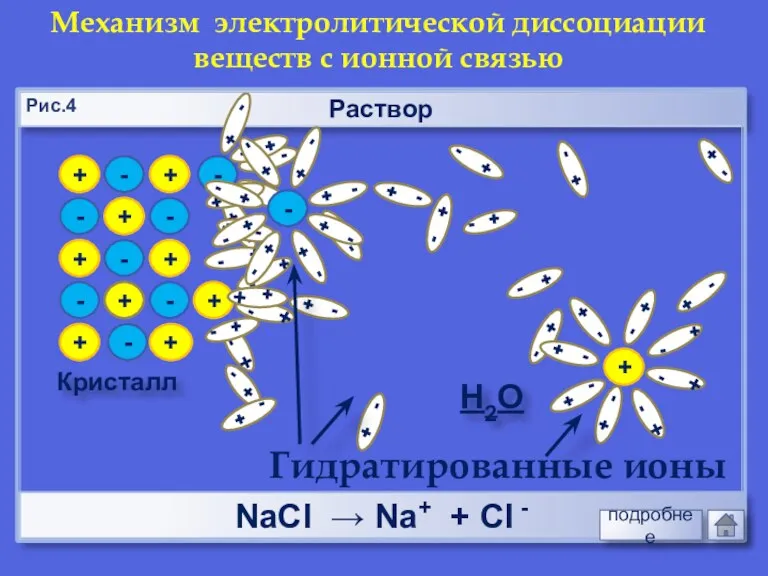
- 11. + + - - + + - - Раствор Кристалл - + + + - -
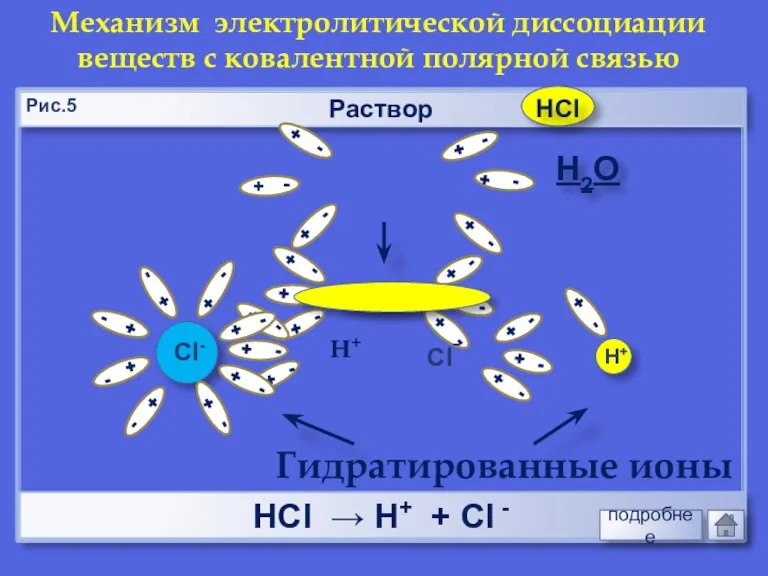
- 12. Раствор НCl → Н+ + Cl - Механизм электролитической диссоциации веществ с ковалентной полярной связью Н2О
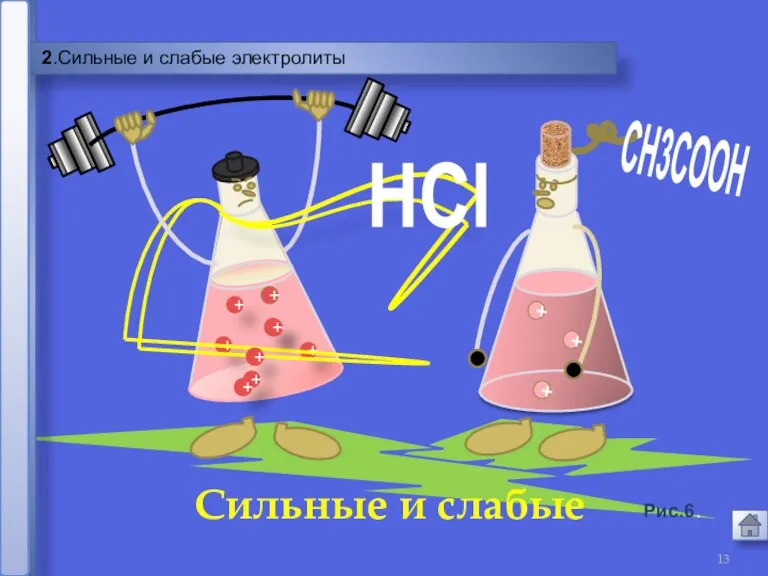
- 13. 2.Сильные и слабые электролиты HCl + + + Сильные и слабые Рис.6.
- 14. 29.11.2016 Русецкая О.П. отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. Степень электролитической
- 15. 2.Сильные и слабые электролиты Электролиты
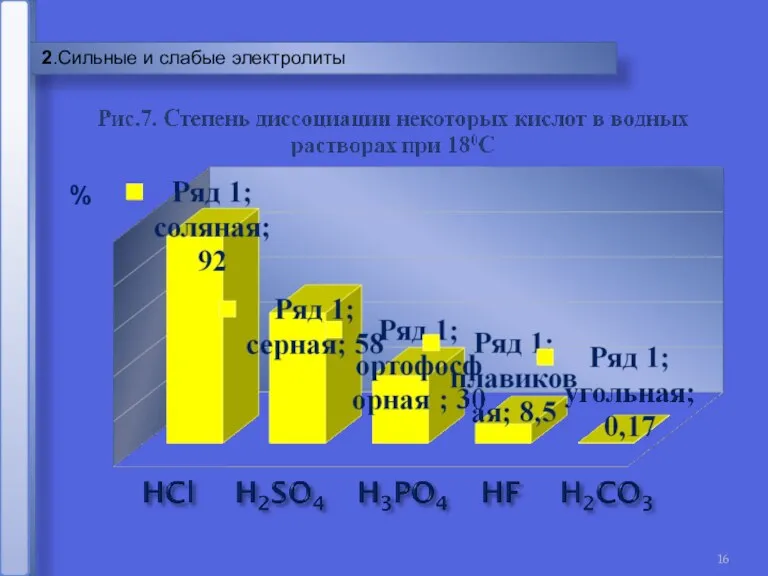
- 16. 2.Сильные и слабые электролиты %
- 17. 29.11.2016 Русецкая О.П. это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются
- 18. 29.11.2016 Русецкая О.П. это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются
- 19. 29.11.2016 Русецкая О.П. это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы
- 20. 6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных
- 21. 6. Рис.8. Характерные симптомы дефицита химических элементов в организме человека подробнее
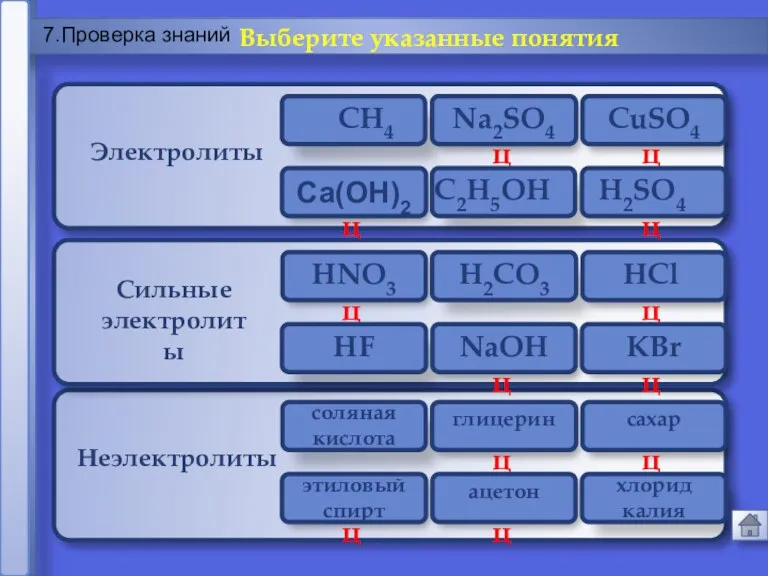
- 22. Ошибка Молодец Молодец Ошибка Молодец Молодец Сильные электролиты Ca(OH)2 Электролиты Неэлектролиты 7.Проверка знаний Выберите указанные понятия
- 23. 29.11.2016 Русецкая О.П. Электролитическая диссоциация 7. Проверка знаний 29.11.2016 Русецкая О.П. Электролитическая диссоциация в растворах –
- 24. 29.11.2016 29.11.2016 29.11.2016 29.11.2016 29.11.2016 29.11.2016 Механизм электролитической диссоциации NaCl Разрушение кристаллической решетки под действием молекул
- 26. Скачать презентацию















 Классификация химических реакций
Классификация химических реакций Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5
Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5 Виды химической связи
Виды химической связи Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Основные виды химических связей
Основные виды химических связей Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Чистые вещества и смеси
Чистые вещества и смеси Геохимическая классификация элементов
Геохимическая классификация элементов Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Тепловой эффект химической реакции
Тепловой эффект химической реакции Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Водород. Положение в периодической системе
Водород. Положение в периодической системе Основные виды химических связей
Основные виды химических связей Центрифугирование в почвоведении
Центрифугирование в почвоведении Нахождение металлов в природе. Общие способы получения металлов. 9 класс
Нахождение металлов в природе. Общие способы получения металлов. 9 класс Химия нефти и газа
Химия нефти и газа Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Генетическая связь между классами неорганических веществ. Химический тренажёр
Генетическая связь между классами неорганических веществ. Химический тренажёр Түсті металдар
Түсті металдар Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Типы химических реакций в органической химии
Типы химических реакций в органической химии Трансмиссионные масла
Трансмиссионные масла Тепловой эффект химических реакций
Тепловой эффект химических реакций Титриметрический метод анализа
Титриметрический метод анализа Синтетические моющие средства. Использование их в повседневной жизни
Синтетические моющие средства. Использование их в повседневной жизни Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены