Содержание
- 2. Металлы в природе Активные металлы Na, K, Ca, Ba, Mg Металлы средней Активности Fe, Al, Zn,
- 3. Природные минералы, содержание металлов в которых представляет промышленный интерес, называются РУДАМИ.
- 4. МЕТАЛЛУРГИЯ- промышленный способ получения металлов. Только некоторые металлы (золото, платина) находятся в природе в свободном (самородном)
- 5. М Е Т А Л Л У Р Г И Я Задача металлургии – получение металлов
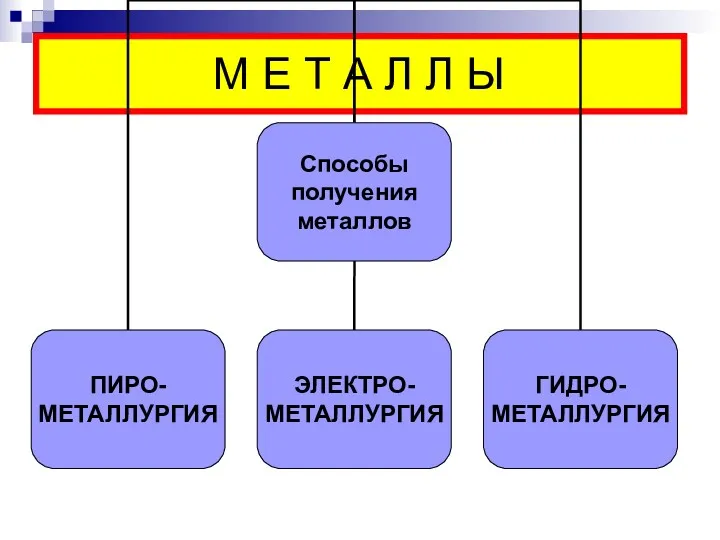
- 6. М Е Т А Л Л Ы
- 7. ПИРОМЕТАЛЛУРГИЯ - восстановление безводных соединений при высоких температурах. Восстановители: углерод и оксид углерода (II) (карботермия); алюминий,
- 8. ПИРОМЕТАЛЛУРГИЯ Карботермия. Восстановители: C и CO. Например: Fe2O3 + 3CO = 2Fe + 3CO2 Если руда
- 9. ПИРОМЕТАЛЛУРГИЯ Металлотермия. В качестве восстановителей используют химически более активные металлы: Al, Mg, Ca, Na. Например: Cr2O3
- 10. ПИРОМЕТАЛЛУРГИЯ Водородотермия. Восстанавливают металлы из их оксидов H2. Например: MoO3 + 3H2 = Mo + 3H2
- 11. ЭЛЕКТРОМЕТАЛЛУРГИЯ – восстановление электрическим током.
- 12. ЭЛЕКТРОМЕТАЛЛУРГИЯ Электролиз расплавов. Например: NaCl = Na+ + Cl- (расплав) K(-) Na+ + ē = Na0
- 13. ЭЛЕКТРОМЕТАЛЛУРГИЯ Электролиз растворов. Например: NiSO4 = Ni2+ + SO42- K(-) Ni2+ +2ē = Ni0 2 A(+)
- 14. ГИДРОМЕТАЛЛУРГИЯ – восстановление из растворов солей. Металлы, входящие в состав руды, переводят в раствор, а затем
- 15. ГИДРОМЕТАЛЛУРГИЯ Восстановление металлов из руд с помощью серной кис-лоты – один из основных процессов гидрометаллургии. Например:
- 16. Примеры заданий по теме: «Общие способы получение металлов». Задания с выбором ответа. 1. Реакция возможна между
- 17. Примеры заданий по теме: «Общие способы получение металлов». 3. Какой из металлов вытесняет медь из сульфата
- 18. Примеры заданий по теме: «Общие способы получение металлов». 6. Для осуществления превращений в соответствии со схемой:
- 19. Примеры заданий по теме: «Общие способы получение металлов». 8. Гидрометаллургический метод получения металлов отражает реакция: 1)
- 20. Примеры заданий по теме: «Общие способы получение металлов». 10. Оксид углерода (II) проявляет восстановительные свойства при
- 21. Примеры заданий по теме: «Общие способы получение металлов». Задания с кратким ответом. 1. При электролизе раствора
- 22. Примеры заданий по теме: «Общие способы получение металлов». 6. Верны ли следующие суждения о промышленных способах
- 24. Скачать презентацию




















 Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Отрицательное влияние азотных минеральных удобрений на почву
Отрицательное влияние азотных минеральных удобрений на почву Предмет органической химии. Основные положения теории химического строения органических соединений
Предмет органической химии. Основные положения теории химического строения органических соединений Бета-окисление жирных кислот
Бета-окисление жирных кислот Аммиак
Аммиак Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Характеристика элементов VIII-В группы. Семейство железа
Характеристика элементов VIII-В группы. Семейство железа Химические реакции
Химические реакции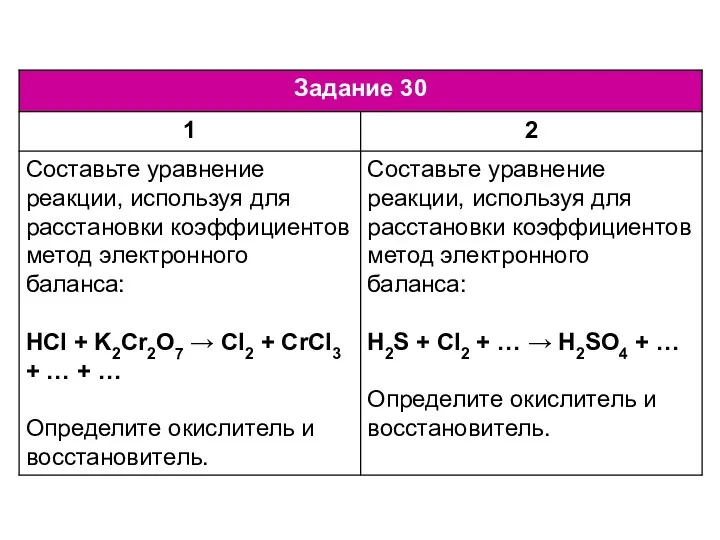 ЕГЭ по химии. Задание 30-34
ЕГЭ по химии. Задание 30-34 Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Природный и искусственный камень
Природный и искусственный камень Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях
Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях Электролитическая диссоциация
Электролитическая диссоциация Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Молекулалық орбиталдың негіздері ТФП 315
Молекулалық орбиталдың негіздері ТФП 315 АТФ Аденозинтрифосфат
АТФ Аденозинтрифосфат Растворы
Растворы Фенолы. Классификация и изомерия
Фенолы. Классификация и изомерия Properties of Atoms and the Periodic Table
Properties of Atoms and the Periodic Table Кевлар. Структура кевлара
Кевлар. Структура кевлара XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Первичная переработка нефти
Первичная переработка нефти 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva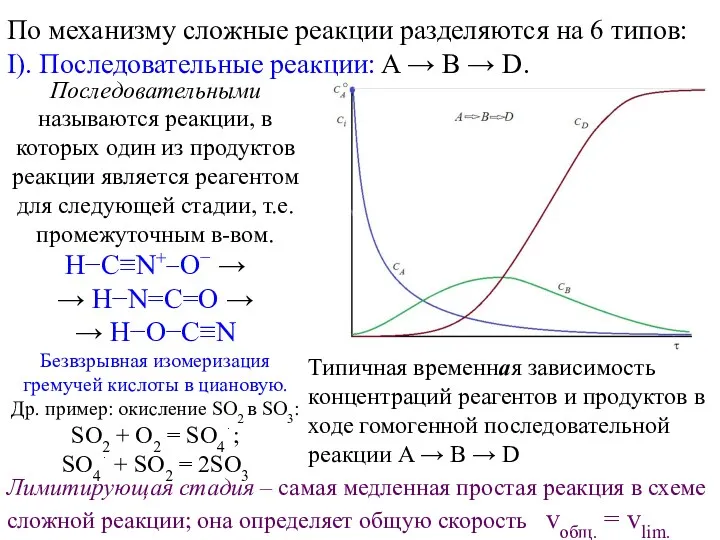 Сложные реакции по механизму
Сложные реакции по механизму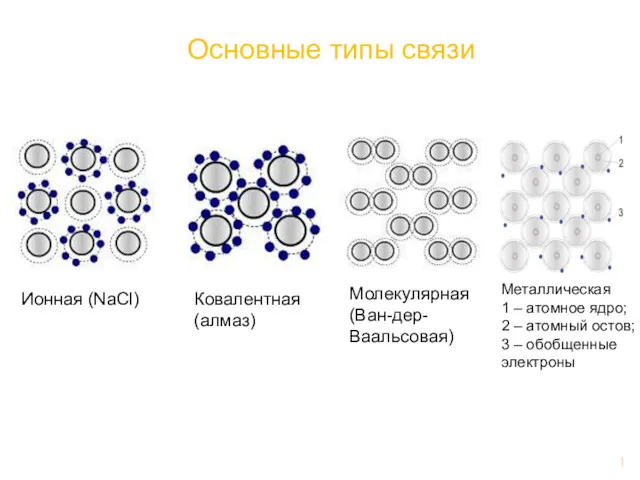 Основные типы связи
Основные типы связи Метал конструкциялық материалдар
Метал конструкциялық материалдар Химическая термодинамика
Химическая термодинамика