Содержание
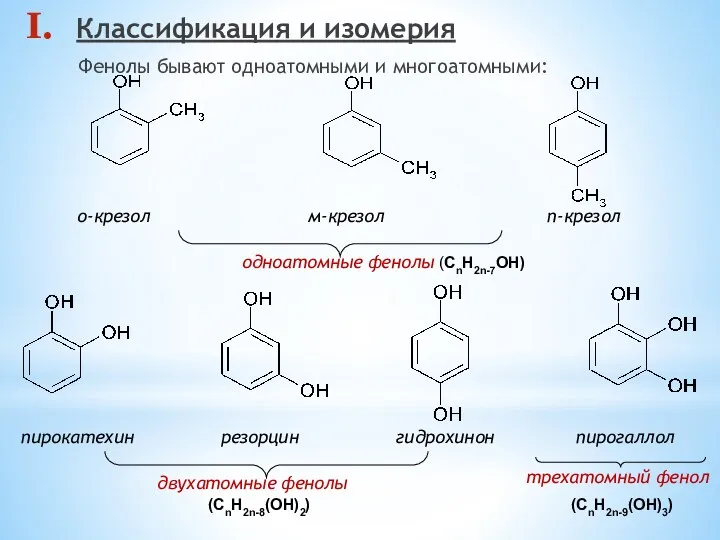
- 2. Классификация и изомерия Фенолы бывают одноатомными и многоатомными: пирокатехин резорцин гидрохинон пирогаллол о-крезол м-крезол п-крезол одноатомные
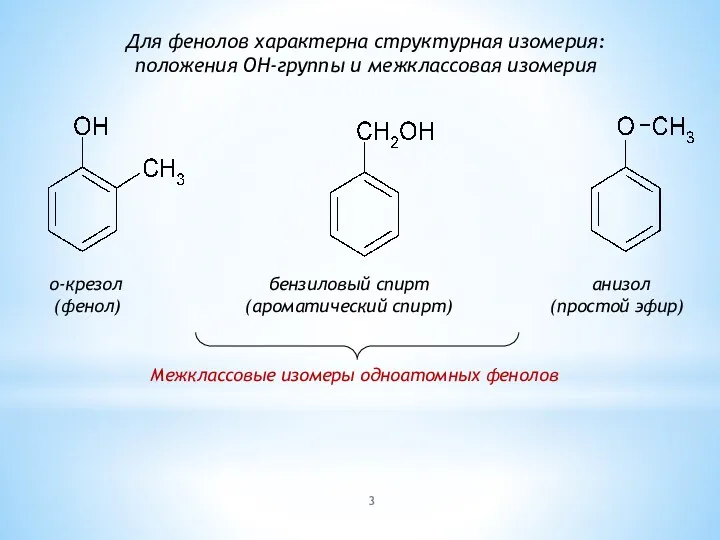
- 3. о-крезол бензиловый спирт анизол (фенол) (ароматический спирт) (простой эфир) Для фенолов характерна структурная изомерия: положения OH-группы
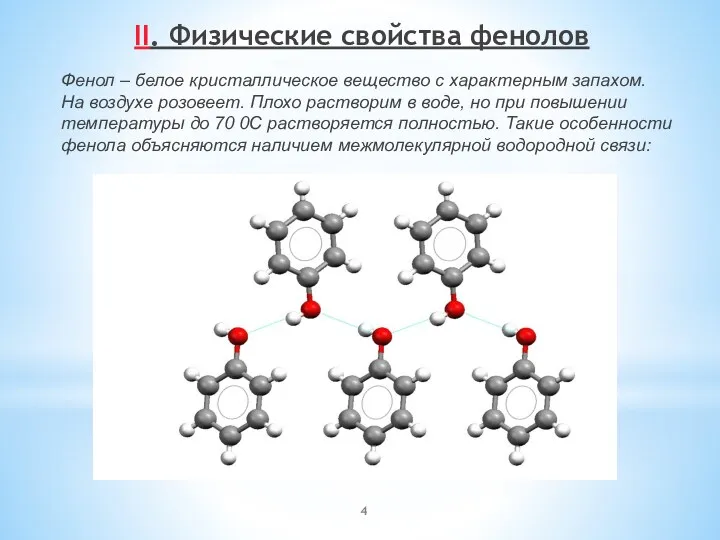
- 4. II. Физические свойства фенолов Фенол – белое кристаллическое вещество с характерным запахом. На воздухе розовеет. Плохо
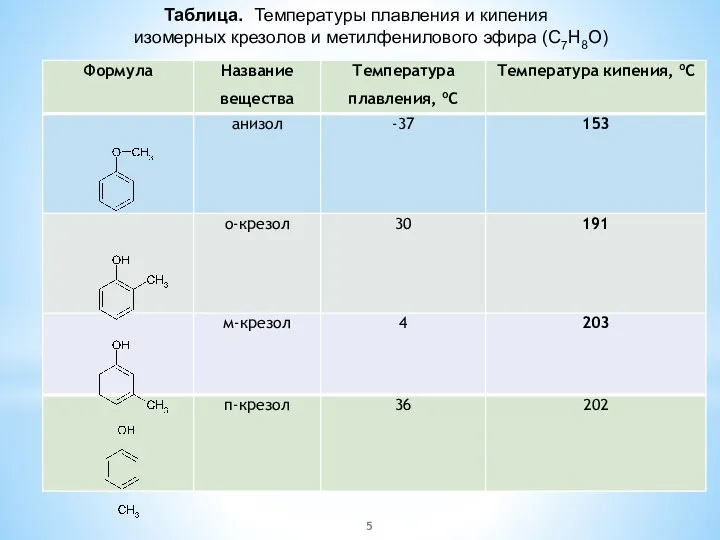
- 5. Таблица. Температуры плавления и кипения изомерных крезолов и метилфенилового эфира (C7H8O)
- 6. Фенол очень токсичен, при попадании на кожу вызывает ожоги. Фенол обладает хорошими дезинфицирующими свойствами; это было
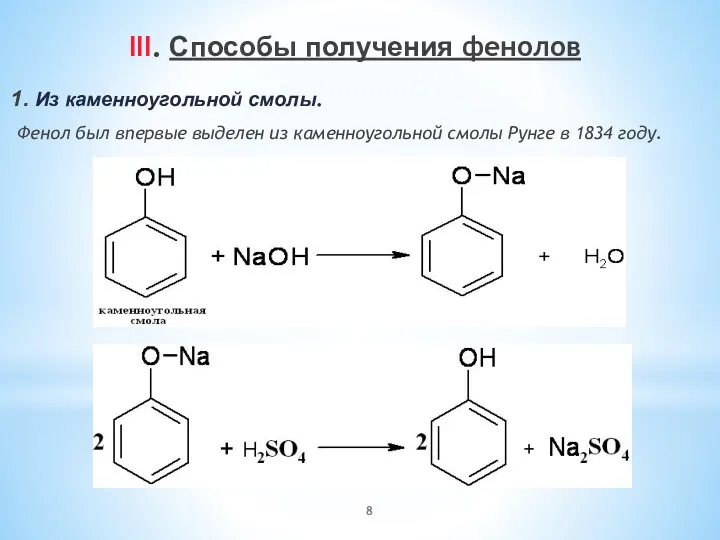
- 8. III. Способы получения фенолов 1. Из каменноугольной смолы. Фенол был впервые выделен из каменноугольной смолы Рунге
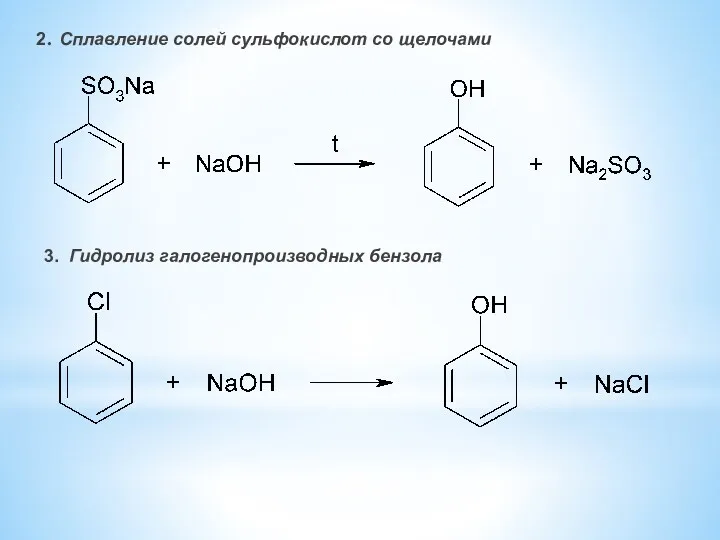
- 9. 2. Сплавление солей сульфокислот со щелочами 3. Гидролиз галогенопроизводных бензола
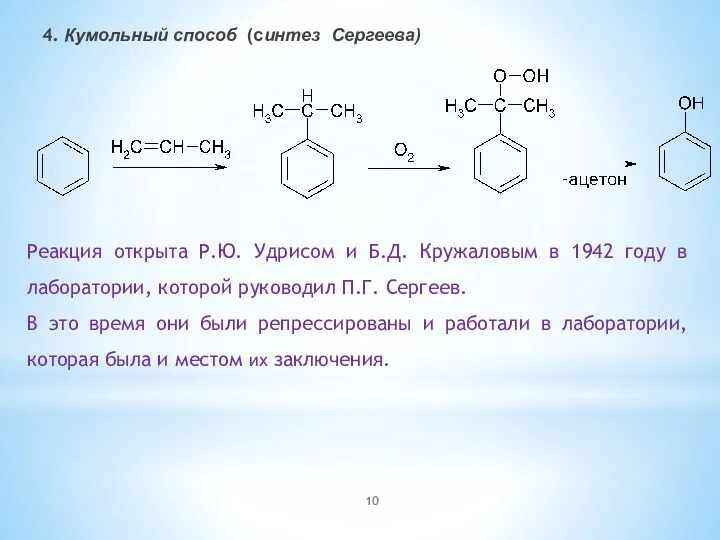
- 10. 4. Кумольный способ (синтез Сергеева) Реакция открыта Р.Ю. Удрисом и Б.Д. Кружаловым в 1942 году в
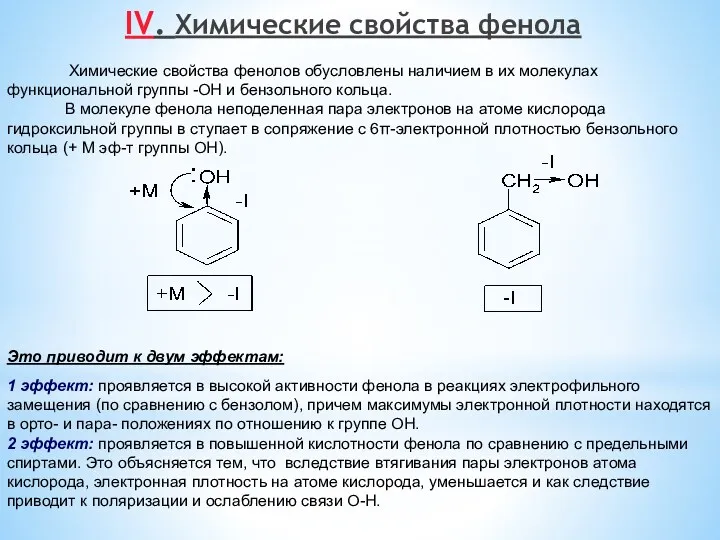
- 11. IV. Химические свойства фенола Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы -ОН и
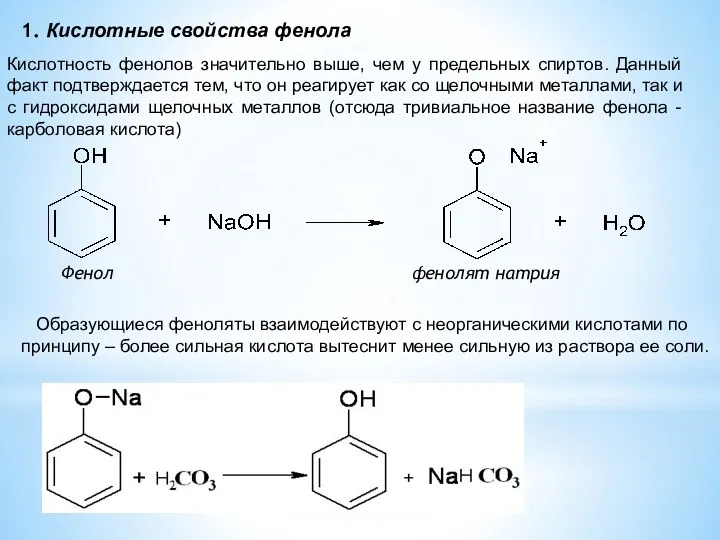
- 12. 1. Кислотные свойства фенола Фенол фенолят натрия Кислотность фенолов значительно выше, чем у предельных спиртов. Данный
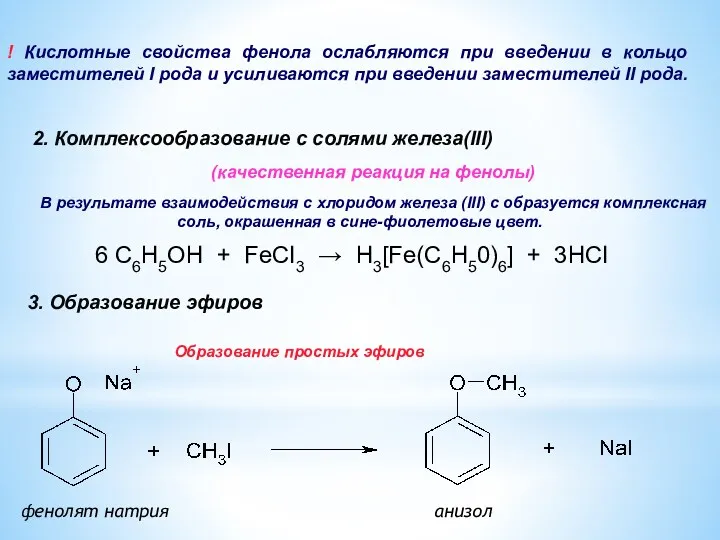
- 13. 3. Образование эфиров фенолят натрия анизол ! Кислотные свойства фенола ослабляются при введении в кольцо заместителей
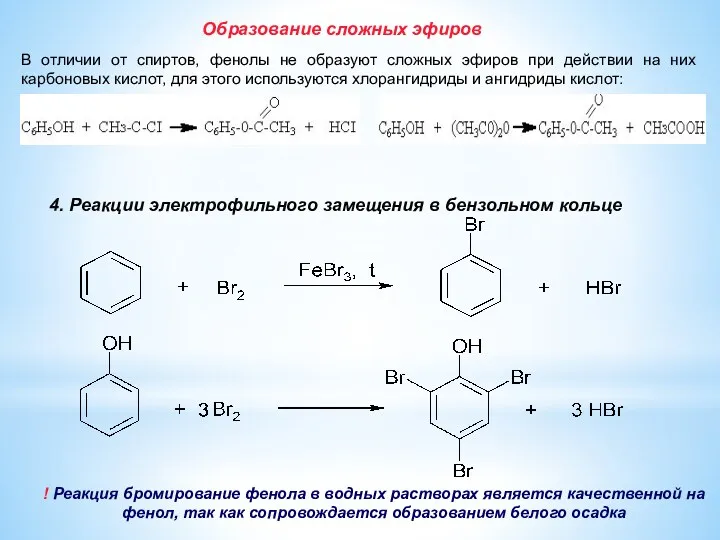
- 14. Образование сложных эфиров В отличии от спиртов, фенолы не образуют сложных эфиров при действии на них
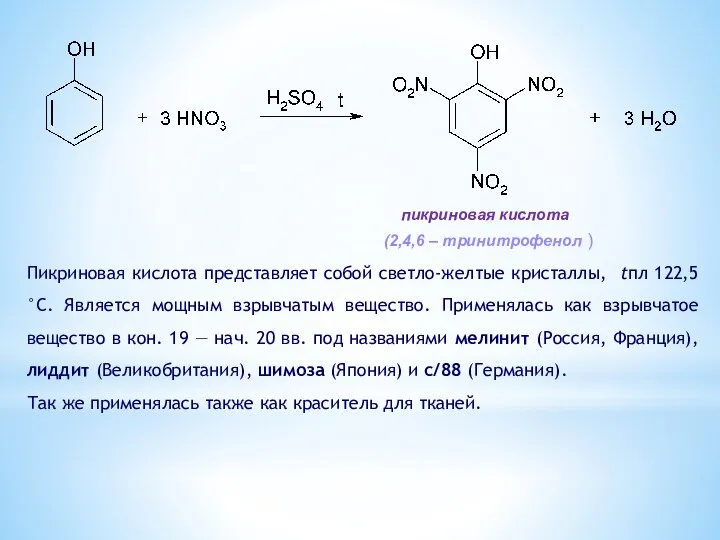
- 15. Пикриновая кислота представляет собой светло-желтые кристаллы, tпл 122,5 °С. Является мощным взрывчатым вещество. Применялась как взрывчатое
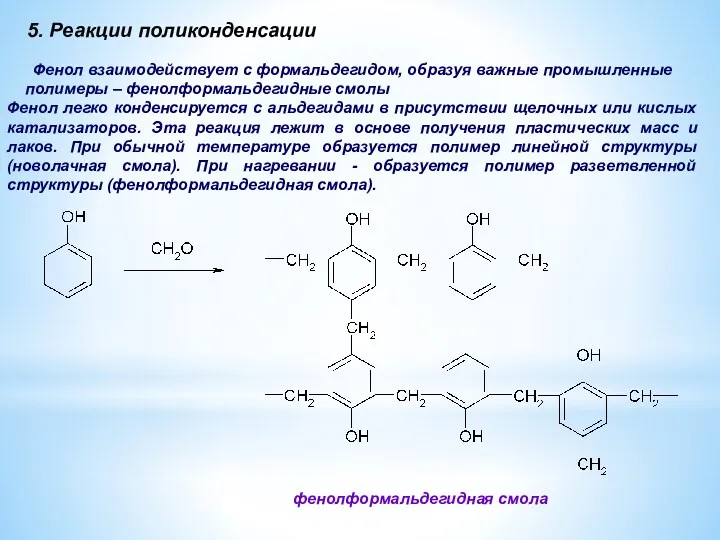
- 16. 5. Реакции поликонденсации Фенол взаимодействует с формальдегидом, образуя важные промышленные полимеры – фенолформальдегидные смолы фенолформальдегидная смола
- 17. Фенолформальдегидные смолы являются вязкими жидкостями или твердыми веществами. Отвержденные фенолоформальдегидные смолы обладают электроизоляционными и механическими свойствами.
- 18. 6. Реакции окисления Фенол легко окисляется даже при действии кислорода воздуха. Так, при стоянии на воздухе
- 20. Скачать презентацию




 Основы термодинамики
Основы термодинамики Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Особенности органических веществ. Теория химического строения А.М.Бутлерова
Особенности органических веществ. Теория химического строения А.М.Бутлерова Водород. Сущность водорода как химического элемента
Водород. Сущность водорода как химического элемента Аналитическая химия. Количественный анализ (ч.1. титриметрия)
Аналитическая химия. Количественный анализ (ч.1. титриметрия) Кислоты
Кислоты Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Получение и установление состава кристаллогидрата фосфата цинка
Получение и установление состава кристаллогидрата фосфата цинка Простые вещества
Простые вещества Электролиз. Коррозия и защита металлов
Электролиз. Коррозия и защита металлов Классификация и свойства природных энергоносителей
Классификация и свойства природных энергоносителей Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Кислоты. Состав кислот
Кислоты. Состав кислот Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Арены
Арены Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства
Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Расчет реактора установки гидроочистки бензина
Расчет реактора установки гидроочистки бензина Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Жидкостная экстракция
Жидкостная экстракция Эфирные масла
Эфирные масла Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Природные источники углеводородов
Природные источники углеводородов Неорганические соединения галогенов
Неорганические соединения галогенов Изотопы, их свойства и применение
Изотопы, их свойства и применение Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Алкадиены
Алкадиены