Содержание
- 2. Хим. связь - силы, которые обуславливают связь между атомами. Результат связывания – образование более сложных структур.
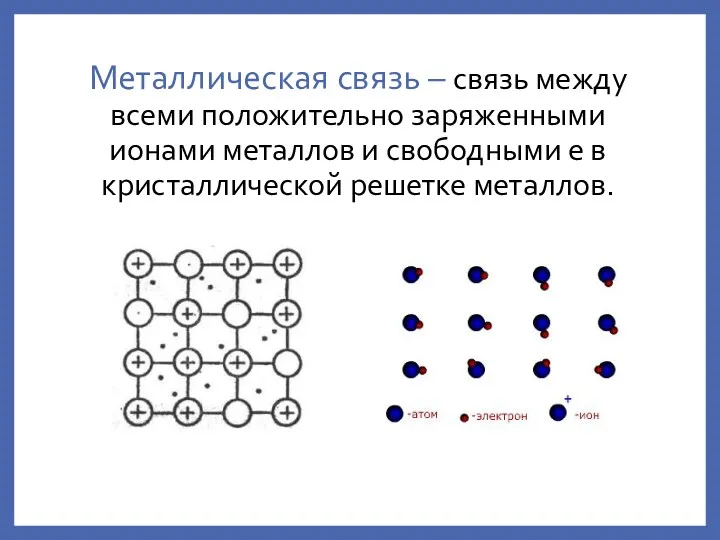
- 4. Металлическая связь – связь между всеми положительно заряженными ионами металлов и свободными е в кристаллической решетке
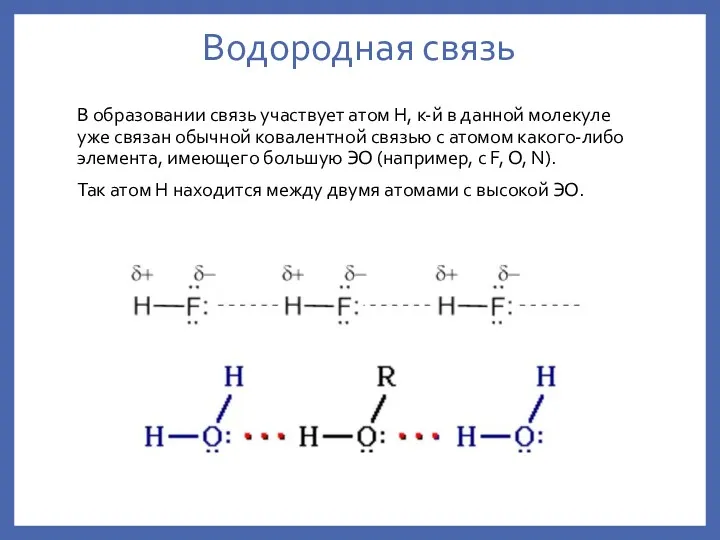
- 5. Водородная связь В образовании связь участвует атом H, к-й в данной молекуле уже связан обычной ковалентной
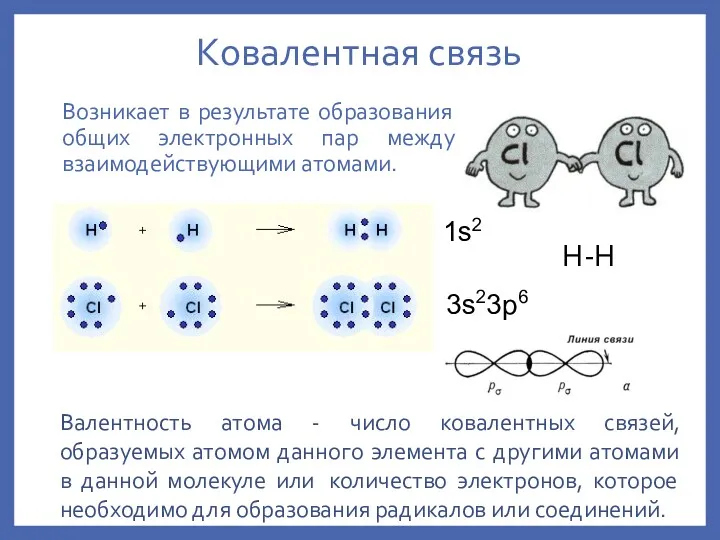
- 6. Ковалентная связь Возникает в результате образования общих электронных пар между взаимодействующими атомами. 1s2 3s23p6 H-H Валентность
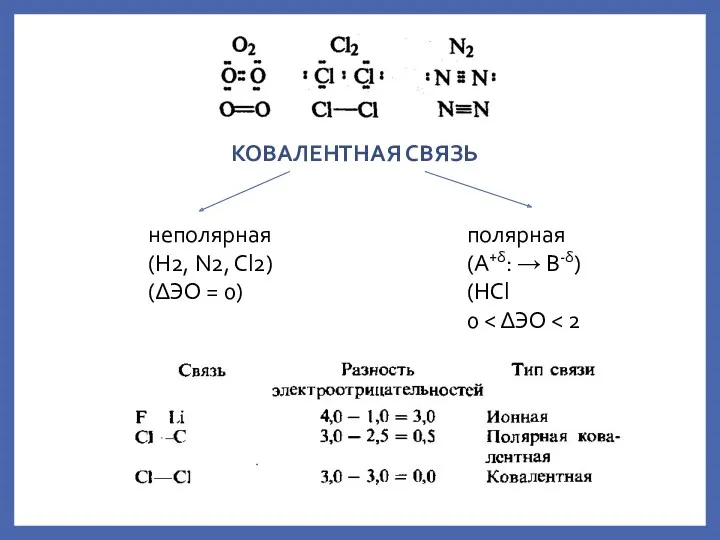
- 7. КОВАЛЕНТНАЯ СВЯЗЬ неполярная (H2, N2, Cl2) (ΔЭО = 0) полярная (A+δ: → B-δ) (HCl 0
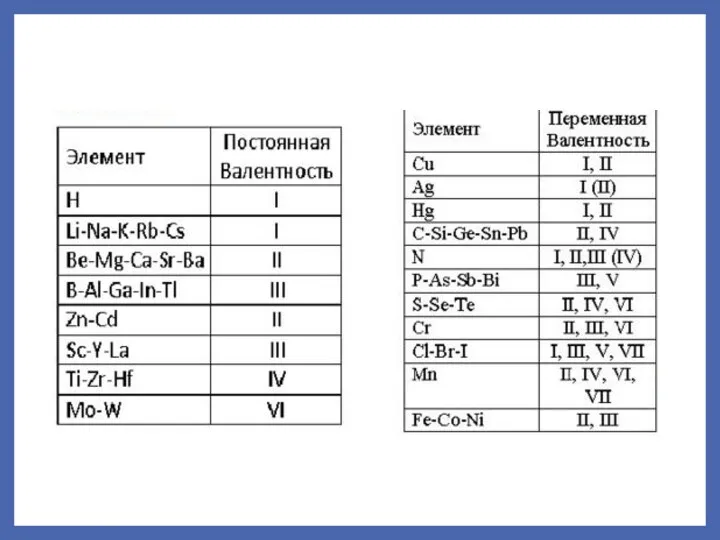
- 8. ВАЛЕНТНОСТЬ постоянная переменная Переход атома в возбужденное состояние обуславливает увеличение валентности элемента и является причиной существования
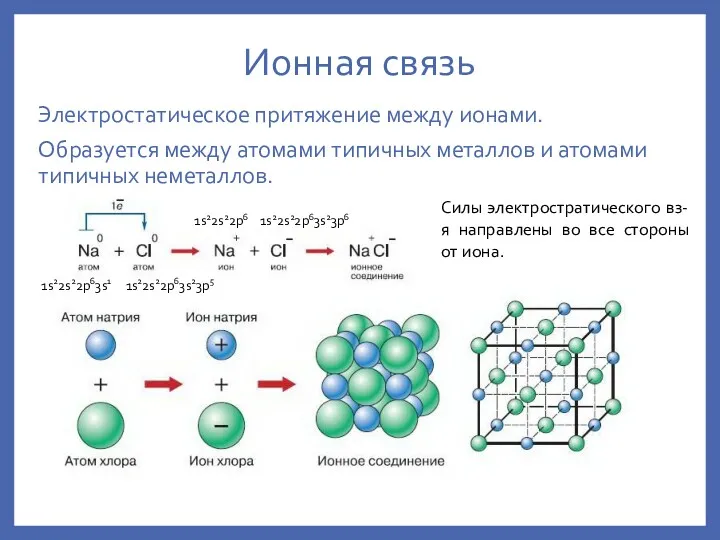
- 10. Ионная связь Электростатическое притяжение между ионами. Образуется между атомами типичных металлов и атомами типичных неметаллов. 1s22s22p63s1
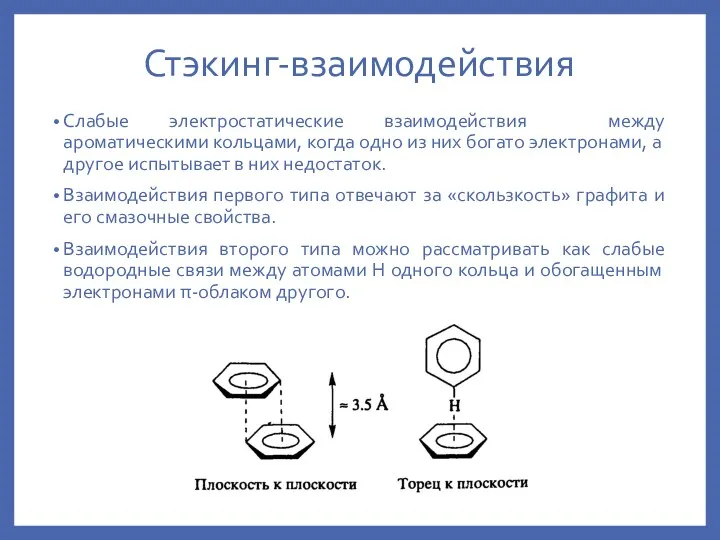
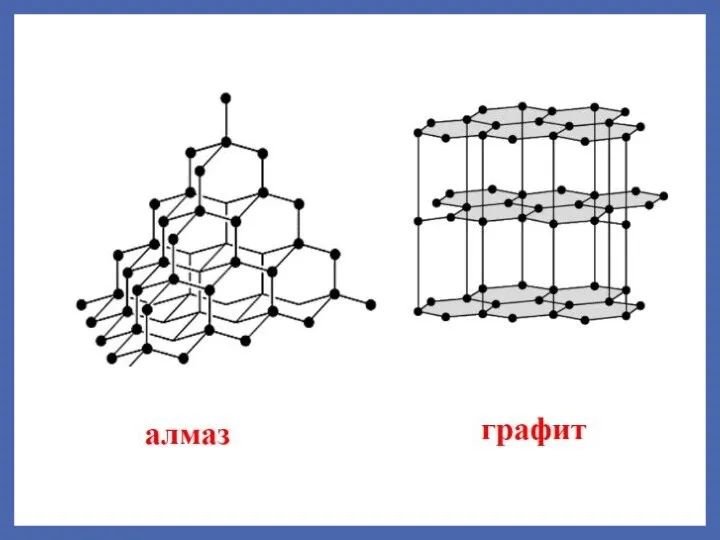
- 11. Стэкинг-взаимодействия Слабые электростатические взаимодействия между ароматическими кольцами, когда одно из них богато электронами, а другое испытывает
- 14. Взаимодействия Ван-дер-Ваальса Возникают благодаря поляризации электронного облака из-за соседства близлежащих ядер, приводящей к слабому электростатическому притяжению.
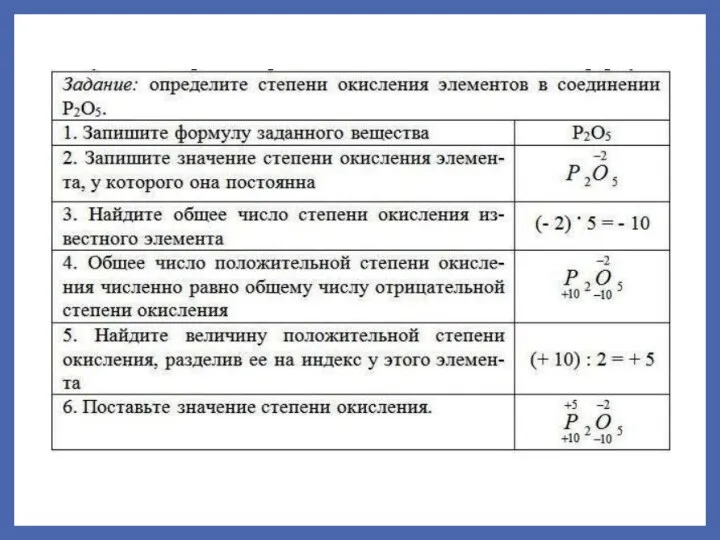
- 15. Степень окисления Реальный или условный заряд атома в данном соединении. СО простых веществ, соединений с неполярной
- 16. Определение степени окисления элемента в соединении проводят, используя следующие положения: 1. Cтепень окисления кислорода в соединениях
- 18. Определите степени окисления химических элементов по формуле бинарного соединения. Составьте формулы бинарных соединений. KO; CaO; NaO;
- 19. Установите соответствие между степенями окисления элемента и рядом соединений, в которых они проявляются. Исходя из степени
- 20. а) ковалентная неполярная CF4 KI O3 C60 I2 Mg3N2 Cl2 NaCl NaNO2 б) ионная KNO3 Se
- 22. Скачать презентацию










 Бензин. Производство бензина
Бензин. Производство бензина Types of chemical reactions
Types of chemical reactions соединения VI группы продвинутая версия
соединения VI группы продвинутая версия Азотсодержащие органические соединения
Азотсодержащие органические соединения Органическая химия. Лекция 13
Органическая химия. Лекция 13 Химическое равновесие. Смещение химического равновесия
Химическое равновесие. Смещение химического равновесия Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Изотопный обмен
Изотопный обмен Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса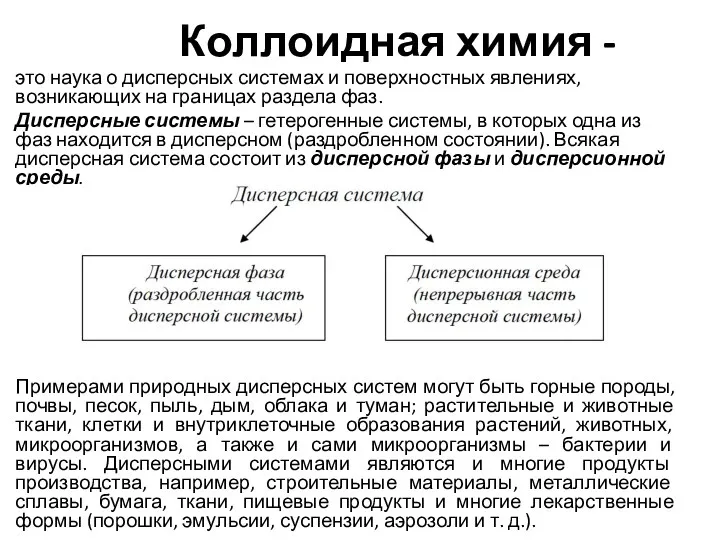 Коллоидная химия
Коллоидная химия Алкены. Этиленовые углеводороды, олефины
Алкены. Этиленовые углеводороды, олефины Nucleic acids
Nucleic acids Общая и медицинская химия
Общая и медицинская химия Создание косметических средств
Создание косметических средств Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат
Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат Алюминий и бор
Алюминий и бор Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа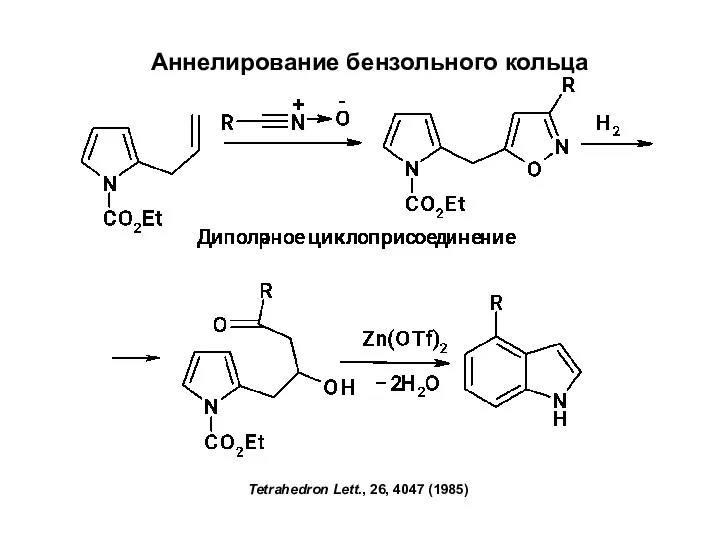 Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение атома. Теории строения атома
Строение атома. Теории строения атома Анализ начальных участков изотерм адсорбции
Анализ начальных участков изотерм адсорбции Многоатомные спирты
Многоатомные спирты Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Азот и его свойства
Азот и его свойства Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Процесс электролиза
Процесс электролиза