Содержание
- 2. Гомологический ряд алкенов С2Н4 этен (этилен) С3Н6 пропен С4Н8 бутен С5Н10 пентен С6Н12 гексен С7Н14 гептен
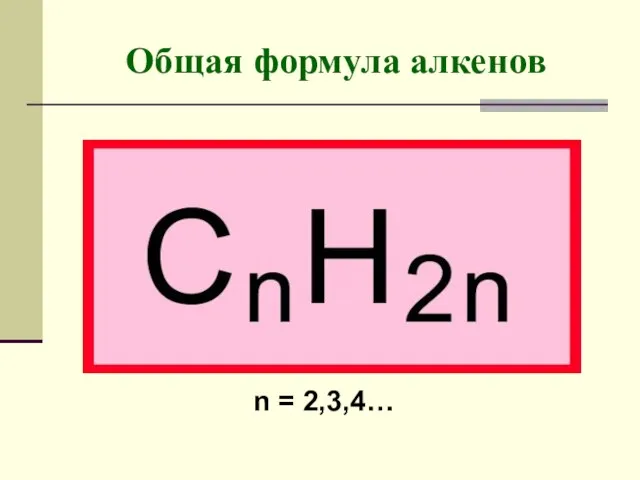
- 3. Общая формула алкенов n = 2,3,4…
- 4. Определение алкенов АЛКЕНЫ - непредельные углеводороды, содержащие одну двойную связь и соответствующие общей формуле СnН2n
- 5. Характеристика химических связей в молекулах алкенов Все связи ковалентные Одна связь двойная, а остальные одинарные Атом
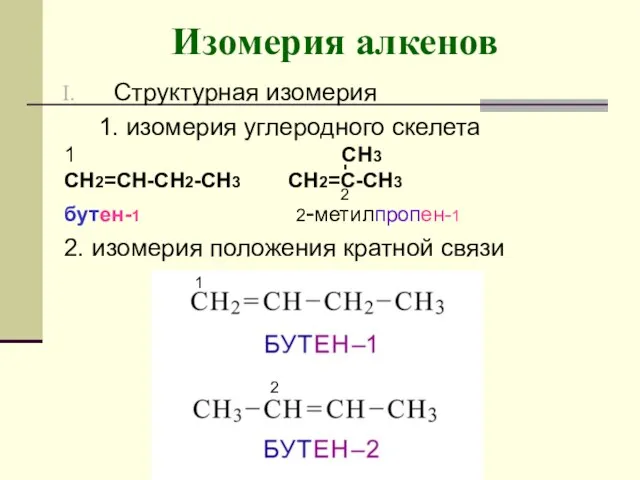
- 6. Изомерия алкенов Структурная изомерия 1. изомерия углеродного скелета 1 CH3 СН2=СН-СН2-СН3 СН2=С-СН3 бутен-1 2-метилпропен-1 2. изомерия
- 7. Физические свойства алкенов Агрегатное состояние: Температура кипения и плавления: увеличивается с увеличением Мr! 2
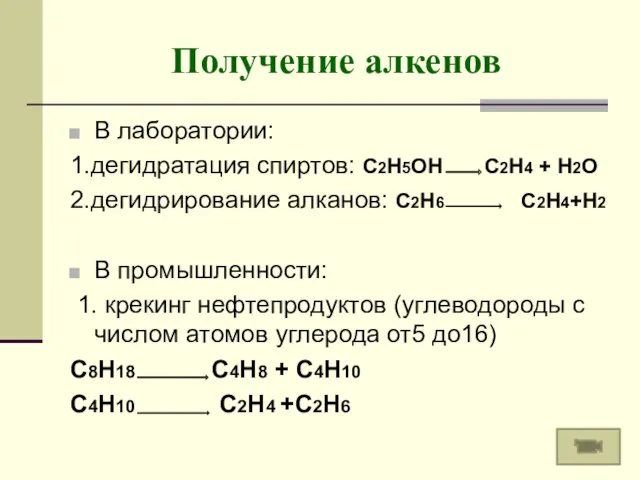
- 8. Получение алкенов В лаборатории: 1.дегидратация спиртов: C2H5OH C2H4 + H2O 2.дегидрирование алканов: С2Н6 С2Н4+Н2 В промышленности:
- 10. Химические свойства алкенов Горение C2H4 + 3О2 2СО2 + 2Н2О +Q Присоединение а) гидрирование C2H4 +
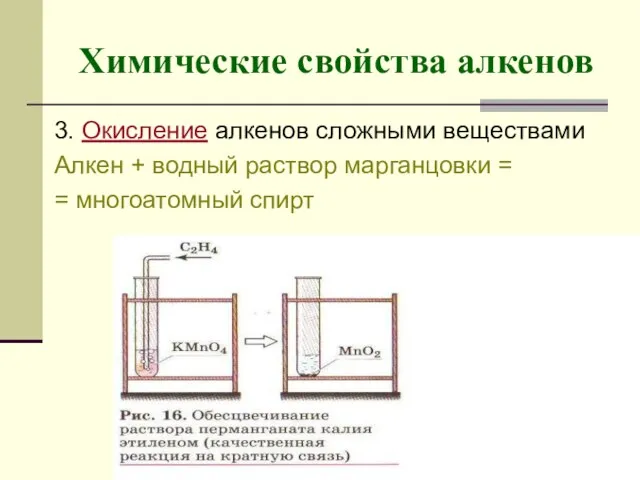
- 13. Химические свойства алкенов 3. Окисление алкенов сложными веществами Алкен + водный раствор марганцовки = = многоатомный
- 15. Применение алкенов
- 16. РЕФЛЕКСИЯ ИЗУЧЕННОГО Алкены - этиленовые? – самый простой –этилен Алкены – непредельные? – есть кратная связь
- 18. Скачать презентацию











 Биосенсорные системы
Биосенсорные системы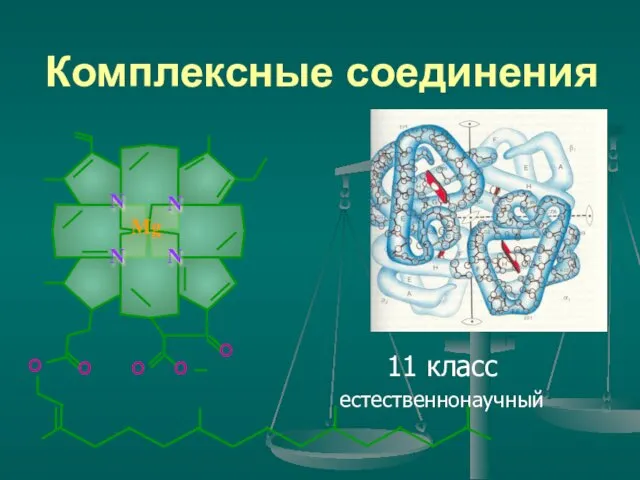 Комплексные соединения
Комплексные соединения Тест по неорганической химии
Тест по неорганической химии Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Химические реакции
Химические реакции Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості Шестая группа элементов
Шестая группа элементов Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Кристаллизация
Кристаллизация Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Химическая связь в кристаллах
Химическая связь в кристаллах Осадительное титрование
Осадительное титрование Дисперсні системи
Дисперсні системи Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций становление органической химии
становление органической химии Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Поширення металів у природі
Поширення металів у природі Воспламенение (зажигание) газовых смесей
Воспламенение (зажигание) газовых смесей Химическая связь
Химическая связь Материаловедение и технология обработки материалов
Материаловедение и технология обработки материалов Товары бытовой химии
Товары бытовой химии Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Катализ кислотами и основаниями. Лекция 3
Катализ кислотами и основаниями. Лекция 3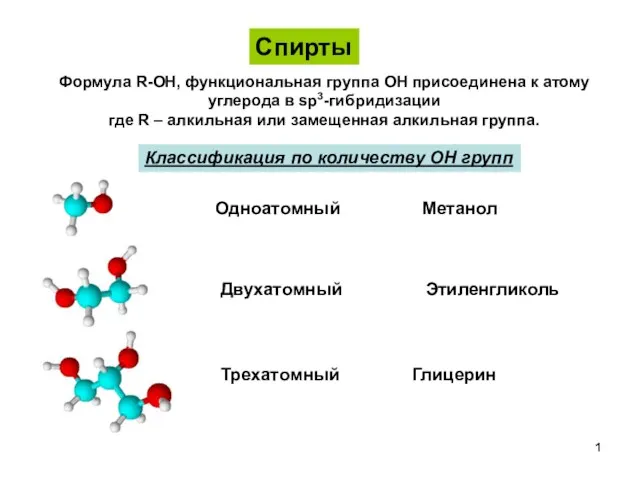 Спирты, фенолы, простые эфиры
Спирты, фенолы, простые эфиры