Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза презентация
Содержание
- 2. Объяснять процессы, протекающие при прохождении электрического тока через раствор, содержащий заряженные ионы. Прогнозировать продукты электролиза. Цели
- 3. Учащийся достиг цели обучения, если: Различает процессы электролиза растворов и расплавов Определяет продукты электролиза водных растворов
- 5. Подумай и ответь! Starter Корзина идей
- 6. Starter Корзина идей 1. Докажите, что электролиз – это окислительно-восстановительный процесс 2. Назовите процесс, идущий на
- 7. Ответьте на вопросы, используя интерактивную доску Padlet.com. Padlet.com. https://padlet.com/uralbaeva_kar/w7bfuzvq1vmcfndz Starter Задание №1 Назовите составные части электролизера
- 8. Ответьте на вопросы, используя интерактивную доску Padlet.com. Padlet.com. https://padlet.com/uralbaeva_kar/rahaxowsxrpjfk9l What are the products of electrolysis? Задание
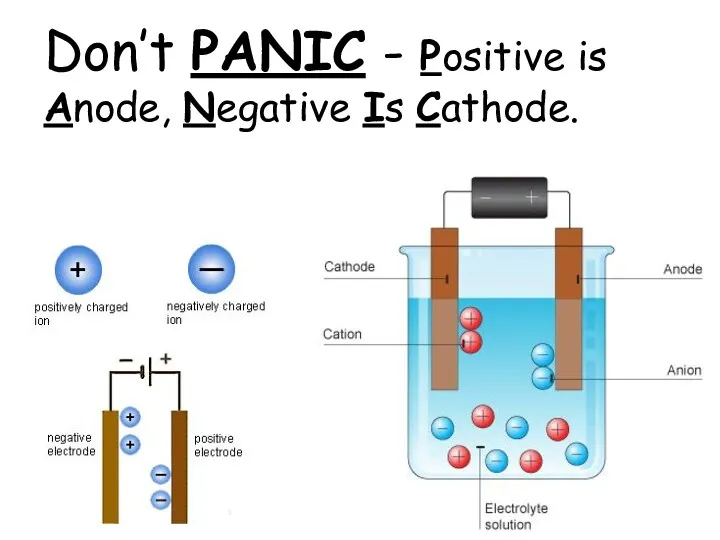
- 9. Don’t PANIC - Positive is Anode, Negative Is Cathode.
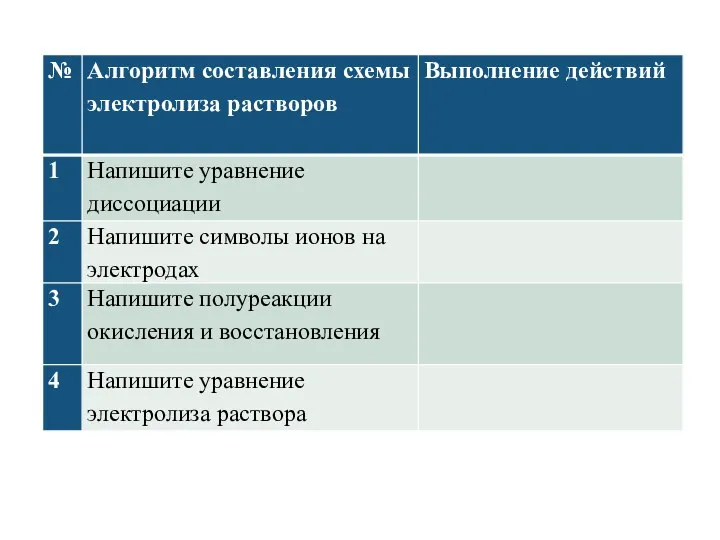
- 11. Электролиз водного раствора хлорида калия KCl (-)Катод K+ + Cl- Анод(+) восстановление молекул воды: KOH окисление
- 12. Электролиз водных растворов Электролиз водных растворов солей сложнее электролиза расплавленных солей, поскольку ионы, образованные при диссоциации
- 13. Катодные процессы Разделим вытеснительный ряд металлов на 3 части: Правило №1. Если металл в соли —
- 14. Катодные процессы Правило №2. Если металл в соли — активный (то есть расположен от Li+ до
- 15. Катодные процессы Правило №3. Если металл в соли – средней активности (между Al3+ и Н+), то
- 16. Запомни правила на катоде!
- 17. Катодные процессы в растворах электролитов
- 18. Анодные процессы Процессы, происходящие на аноде, зависят от природы анода. Аноды бывают растворимыми (медь, серебро, цинк)
- 19. Анодные процессы Правило №1. Если на анод попадает бескислородный кислотный остаток, то он окисляется до свободного
- 20. Анодные процессы Правило №2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается
- 21. Анодные процессы Правило №3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного
- 22. Это надо знать!
- 23. Анодные процессы в водных растворах
- 24. Изменение восстановительной активности анионов Анионы по способности окисляться располагаются в следующем порядке: I-, Br-, S2-, Cl-,
- 25. Электролиз водных растворов солей I. Активные металлы А) металл и остаток бескислородных кислот Б) металл и
- 26. Электролиз расплава хлорида меди (ІІ) CuCl2 (-)Катод Cu2+ + 2Cl- Анод(+) восстановление: окисление: Cu2+ +2е- =
- 29. Электролиз водного раствора хлорида меди (ІІ) CuSO4 (-)Катод Cu2+ + SO42- Анод(+) H2SO4 Cu2+ + 2е-
- 31. Электролиз раствора сульфата калия К2SO4 (-)Катод 2К+ + SO42- Анод(+) 2H2O + 2e- = Н2↑ +
- 32. Электролиз раствора хлорида натрия
- 33. Используя интерактивную доску Padlet.com. Выполните задания. Напишите уравнения электролиза растворов следующих солей: Na2CO3, BaCl2, Li2SO4 Padlet.com.
- 34. Используя интерактивную доску Padlet.com. Решите задачу: При электролизе водного раствора нитрата серебра на аноде выделилось 5,6
- 35. 1. Напишите уравнение электролиза расплавов и водных растворов: бромида меди, йодида калия, сульфата ртути. 2. Рассчитайте
- 37. Скачать презентацию































 Типичные окислители
Типичные окислители Количество вещества. 8 класс
Количество вещества. 8 класс Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Основания. Классификация оснований
Основания. Классификация оснований Водородный показатель
Водородный показатель Химические свойства металлов. Взаимодействие с простыми веществами
Химические свойства металлов. Взаимодействие с простыми веществами Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Использование технологии уровневой дифференциации на уроках химии
Использование технологии уровневой дифференциации на уроках химии Кристаллические решётки и их виды
Кристаллические решётки и их виды Алкалоиды, производные тропана
Алкалоиды, производные тропана Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров фосфор и его соединения
фосфор и его соединения Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Жидкое и растворимое стекло
Жидкое и растворимое стекло Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций O-alkylation catalysts
O-alkylation catalysts Электролитическая диссоциация
Электролитическая диссоциация Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу
Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу Топырақ биоремедиациясы
Топырақ биоремедиациясы Равновесие в растворах электролитов
Равновесие в растворах электролитов Галогены. Свойства галогенов
Галогены. Свойства галогенов Ртуть
Ртуть Циклоалканы. 10 класс
Циклоалканы. 10 класс Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов