Содержание
- 2. Метод электронно-ионного баланса Окислительно-восстановительные реакции бывает сложно уровнять. K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 +
- 3. Один пример 1. Сначала записываем схему реакции: S + HNO3 = H2SO4 + NO
- 4. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. S + HNO3 = H2SO4
- 5. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 6. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 7. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 8. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 9. Метод электронно-ионного баланса Сначала записываем схему реакции. Определяем окислитель и восстановитель. Под схемой реакции записываем в
- 10. Метод электронно-ионного баланса Попробуем: HCl + Cu + O2 ? CuCl2 + H2O
- 11. Окислители можно разделить на группы По проявлению окислительных свойств Окислители – акцепторы электронов Группа 1 Температура
- 12. Группа 1: Окислители, проявляющие окислительные свойства при повышенной или очень высокой температуре. Cl2, F2, KClO3, K2FeO4,
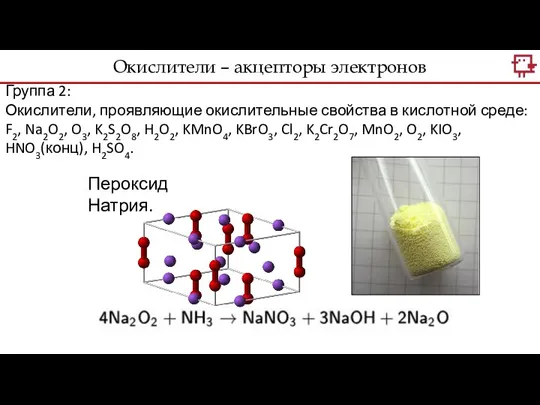
- 13. Группа 2: Окислители, проявляющие окислительные свойства в кислотной среде: F2, Na2O2, O3, K2S2O8, H2O2, KMnO4, KBrO3,
- 14. Группа 3: Окислители, проявляющие окислительные свойства в щелочной среде: F2, K2S2O8, Сl2O4, Na2O2, Br2, H2O2, KMnO4,
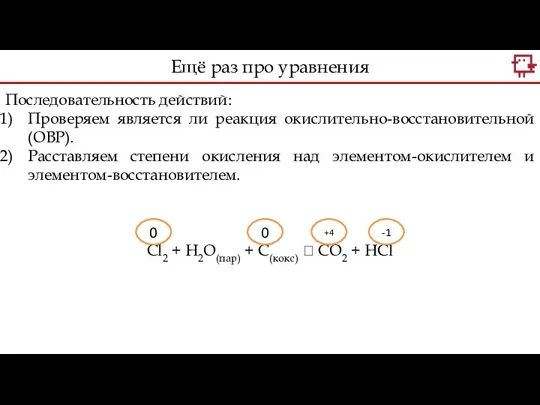
- 15. Последовательность действий: Проверяем является ли реакция окислительно-восстановительной (ОВР). Чем ОВР отличается от других реакций? Cl2 +
- 16. Последовательность действий: Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и элементом-восстановителем. Cl2
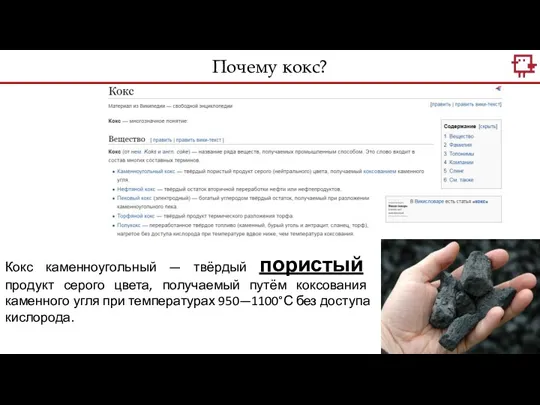
- 17. Кокс каменноугольный — твёрдый пористый продукт серого цвета, получаемый путём коксования каменного угля при температурах 950—1100°С
- 18. Последовательность действий: Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и элементом-восстановителем. Cl2
- 19. Последовательность действий : Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и элементом-восстановителем.
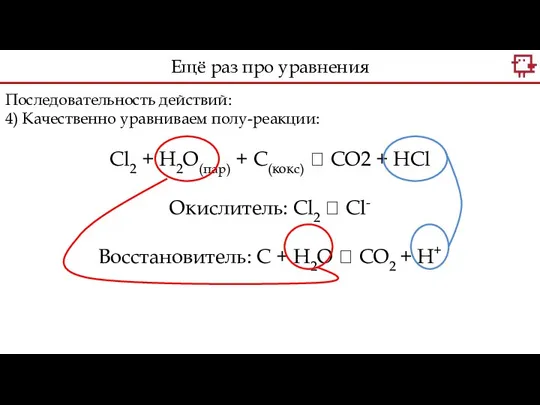
- 20. Последовательность действий: 4) Качественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ? CO2 + HCl Окислитель:
- 21. Последовательность действий: 4) Качественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ? CO2 + HCl Окислитель:
- 22. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ?
- 23. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ?
- 24. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции. 6) Считаем заряды и уравниваем их
- 25. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции. 6) Считаем заряды и уравниваем их
- 26. Последовательность действий: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции. 6) Считаем заряды и уравниваем их
- 27. Последовательность действий: 8) Складываем полу-реакции с учётом коэффициентов: Сl2 ? 2Cl- С + 2H2O ? CO2
- 28. Последовательность действий: 8) Складываем полу-реакции с учётом коэффициентов: Сl2 ? 2Cl- С + 2H2O ? CO2
- 29. SO2 + SeO2 + H2O ? Se + H2SO4 УРАВНЯТЬ!!!
- 31. Скачать презентацию
























 Электролитическая диссоциация
Электролитическая диссоциация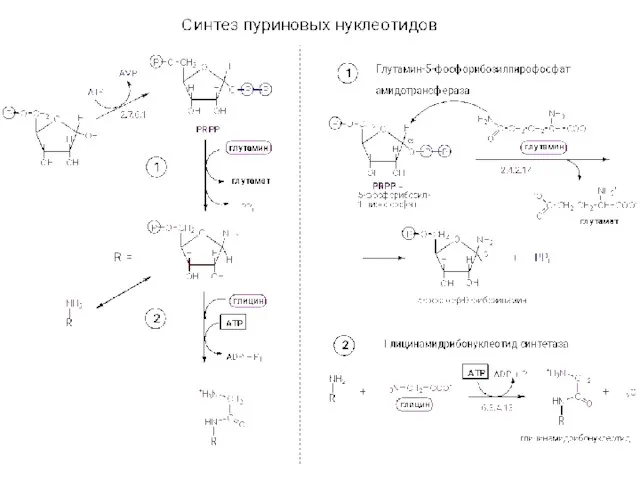 Синтез нуклеотидов
Синтез нуклеотидов Строение атома. 8 класс
Строение атома. 8 класс Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Атомы, молекулы и ионы
Атомы, молекулы и ионы Классификация карбоновых кислот. (Лекция 12)
Классификация карбоновых кислот. (Лекция 12) Кристаллические решетки. Кристаллические вещества
Кристаллические решетки. Кристаллические вещества Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Нефть. Лекция 5
Нефть. Лекция 5 Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Серная кислота
Серная кислота Дисперсные системы
Дисперсные системы Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Хімічний елемент Літій
Хімічний елемент Літій Углеводороды ациклические, циклические
Углеводороды ациклические, циклические Классификация химических элементов
Классификация химических элементов Механизмы реакций органических соединений
Механизмы реакций органических соединений Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие Химия и продукты питания
Химия и продукты питания Кристаллические решетки
Кристаллические решетки Азот қышқылы
Азот қышқылы Общие свойства металлов
Общие свойства металлов Виды химических связей и типы кристаллических решеток
Виды химических связей и типы кристаллических решеток