Содержание
- 2. ЦЕЛИ УРОКА Создание условий для 1) формирования у учащихся знаний неметаллах, положении химических элементов неметаллов в
- 3. ЗАДАЧИ УРОКА 1) ознакомить учащихся с понятием о неметаллах; 2) использовать знания о строении атома, чтобы
- 4. ПЛАН УРОКА Организационный момент Актуализация знаний Определение темы и целей урока Изучение нового материала Закрепление знаний
- 5. НЕМЕТАЛЛЫ
- 6. НЕМЕТАЛЛЫ – ЭТО ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ, АТОМЫ КОТОРЫХ ПРИНИМАЮТ ЭЛЕКТРОНЫ ДЛЯ ЗАВЕРШЕНИЯ ВНЕШНЕГО ЭНЕРГЕТИЧЕСКОГО УРОВНЯ, ОБРАЗУЯ ПРИ
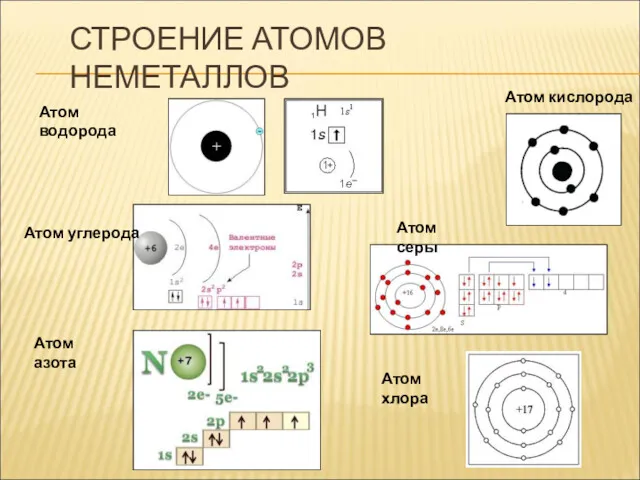
- 7. СТРОЕНИЕ АТОМОВ НЕМЕТАЛЛОВ Атом водорода Атом углерода Атом серы Атом азота Атом хлора Атом кислорода
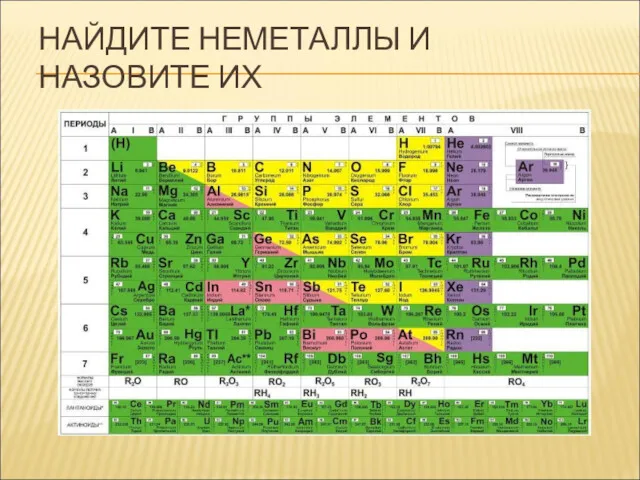
- 8. НАЙДИТЕ НЕМЕТАЛЛЫ И НАЗОВИТЕ ИХ
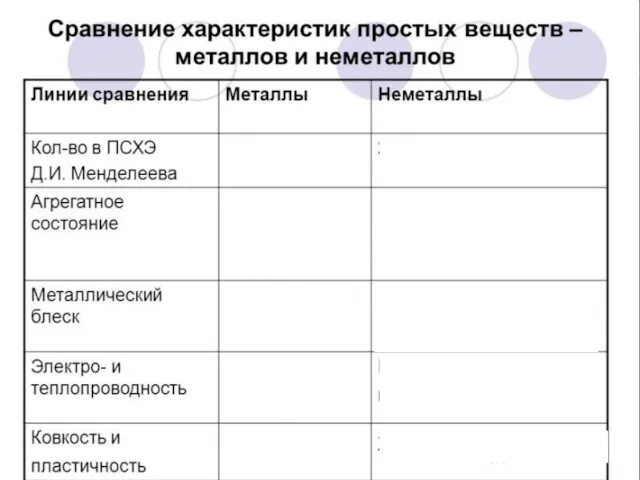
- 9. ЧЕМ ПРАВЕЕ И ВЫШЕ СТОИТ ЭЛЕМЕНТ В ПСХЭ, ТЕМ ЯРЧЕ ВЫРАЖЕНЫ ЕГО НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА
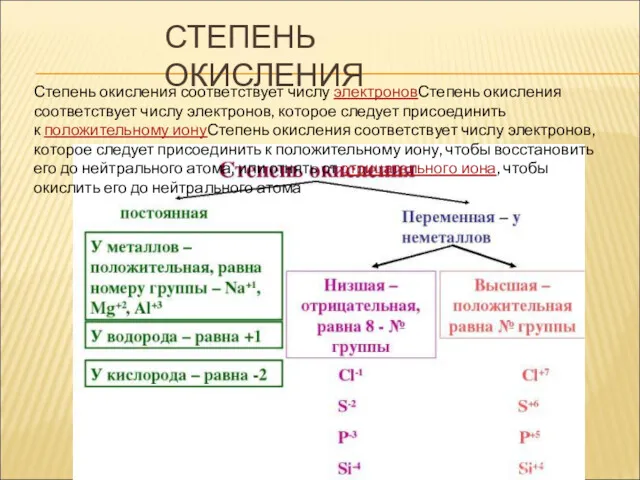
- 11. СТЕПЕНЬ ОКИСЛЕНИЯ Степень окисления соответствует числу электроновСтепень окисления соответствует числу электронов, которое следует присоединить к положительному
- 12. ОПРЕДЕЛИТЕ СТЕПЕНИ ОКИСЛЕНИЯ НЕМЕТАЛЛОВ В СОЕДИНЕНИЯХ Укажите какие из оксидов являются высшими для данных неметаллов, а
- 13. Способность присоединять электроны обусловливает окислительные свойства неметаллов Окислительные свойства неметаллов проявляются в первую очередь при их
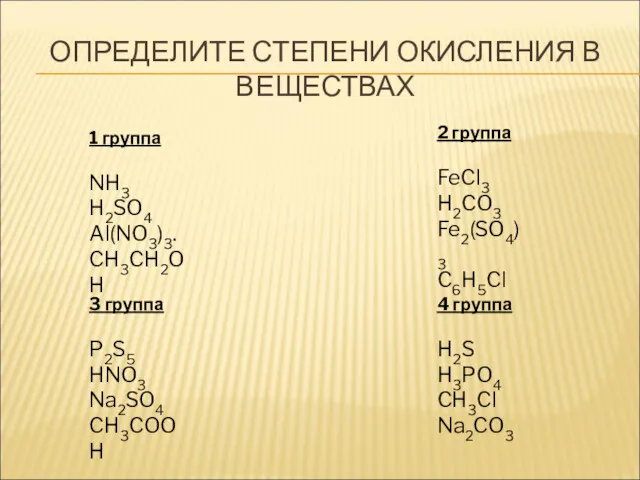
- 14. 1 группа NH3 H2SO4 Al(NO3)3. CH3CH2OH 2 группа FeCl3 H2CO3 Fe2(SO4)3 C6H5Cl ОПРЕДЕЛИТЕ СТЕПЕНИ ОКИСЛЕНИЯ В
- 15. ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ Используя учебник на странице продолжите уравнения, расставьте стехиометрические коэффициенты и степени окисления Окислительные
- 16. Большинство неметаллов могут выступать в химических реакциях как в роли восстановителя, так и в роли окислителя
- 17. ПОЛУЧЕНИЕ НЕМЕТАЛЛОВ Выпишите в тетрадь из учебника на странице 122 основные способы получения неметаллов
- 18. ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ МАТЕРИАЛА Перед вами на партах находятся задания для закрепления и проверки усвоения материала
- 20. Скачать презентацию












 Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов 20231113_tipy_him._reaktsiy_prezentatsiya
20231113_tipy_him._reaktsiy_prezentatsiya Физико-химические свойства поливинилового спирта и поливинилформаля
Физико-химические свойства поливинилового спирта и поливинилформаля Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Химико-лесной комплекс
Химико-лесной комплекс Металлы в организме человека
Металлы в организме человека Тепловой эффект химических реакций
Тепловой эффект химических реакций Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Занимательные опыты в качественном анализе
Занимательные опыты в качественном анализе Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Теория электролитической диссоциации
Теория электролитической диссоциации Производство чугуна и стали
Производство чугуна и стали Основания. 8 класс
Основания. 8 класс Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Строение атома. Лекция №2
Строение атома. Лекция №2 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Химия воды
Химия воды