Содержание
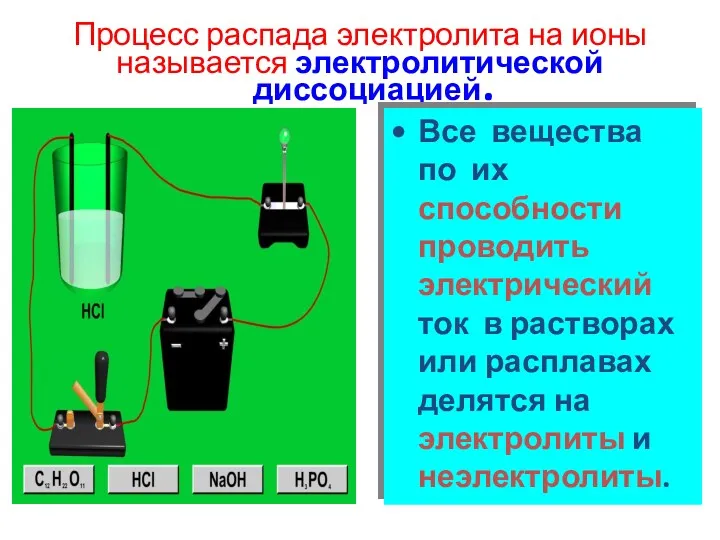
- 2. Процесс распада электролита на ионы называется электролитической диссоциацией. Все вещества по их способности проводить электрический ток
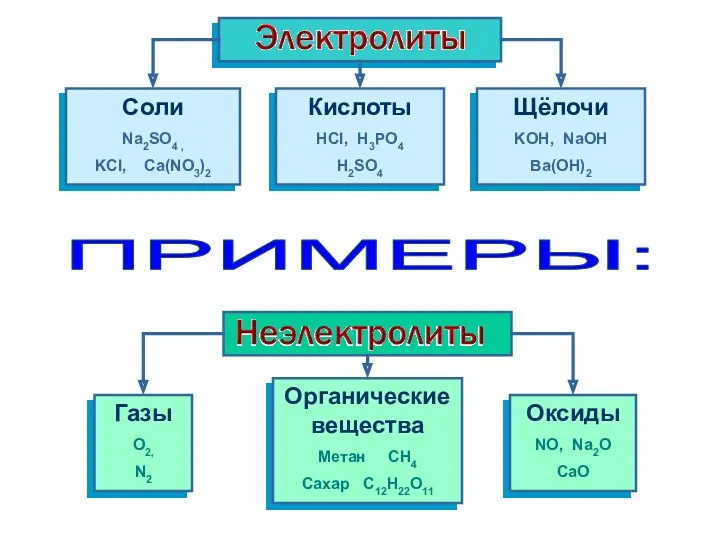
- 3. их растворы или расплавы ПРОВОДЯТ электрический ток их растворы или расплавы НЕ ПРОВОДЯТ электрический ток Вид
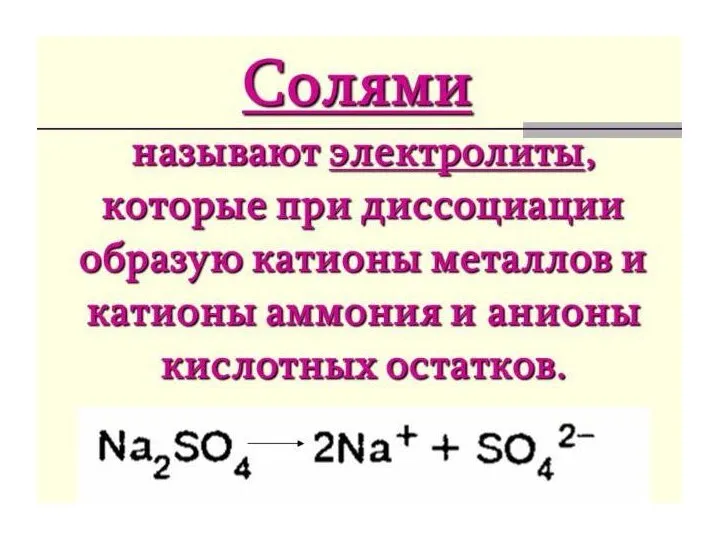
- 4. Cоли Na2SO4 , KCl, Ca(NO3)2 Кислоты HCl, H3PO4 H2SO4 Щёлочи KOH, NaOH Ba(OH)2 Газы O2, N2
- 5. Электролитическая диссоциация химических элементов Основные положения теории: Электролиты при растворении в воде распадаются (диссоциируют) на ионы
- 6. Электролитическая диссоциация химических элементов Основные положения теории: 2. При действии электрического тока ионы приобретают направленное движение:
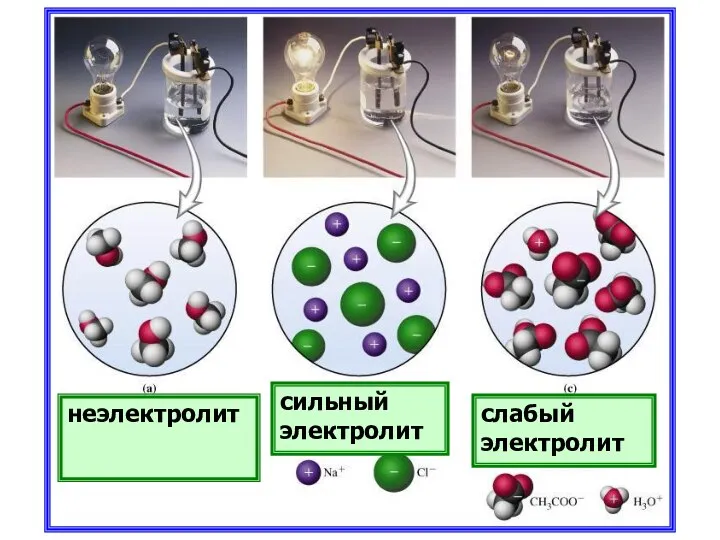
- 7. неэлектролит сильный электролит слабый электролит
- 10. В растворах электролиты диссоциируют ( распадаются) на положительные и отрицательные ионы. Процесс распада электролита на ионы
- 11. Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая
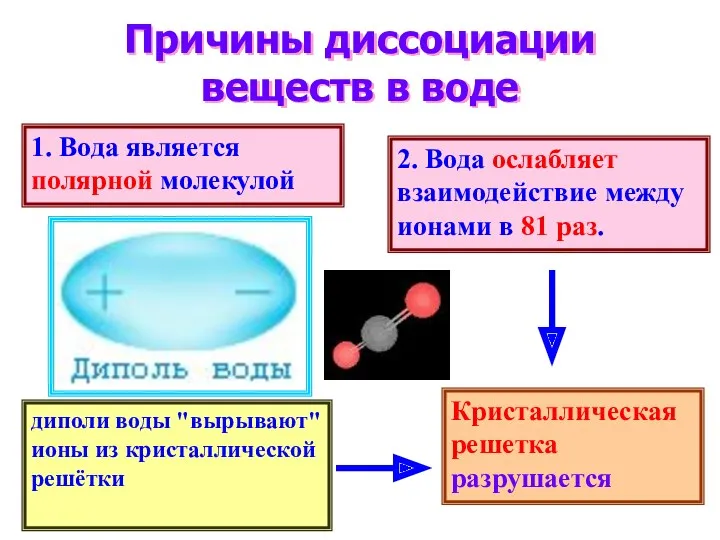
- 12. Причины диссоциации веществ в воде 1. Вода является полярной молекулой 2. Вода ослабляет взаимодействие между ионами
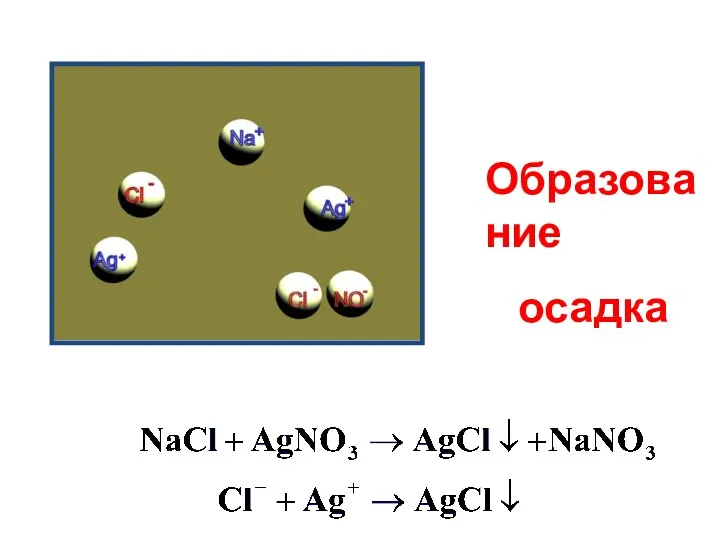
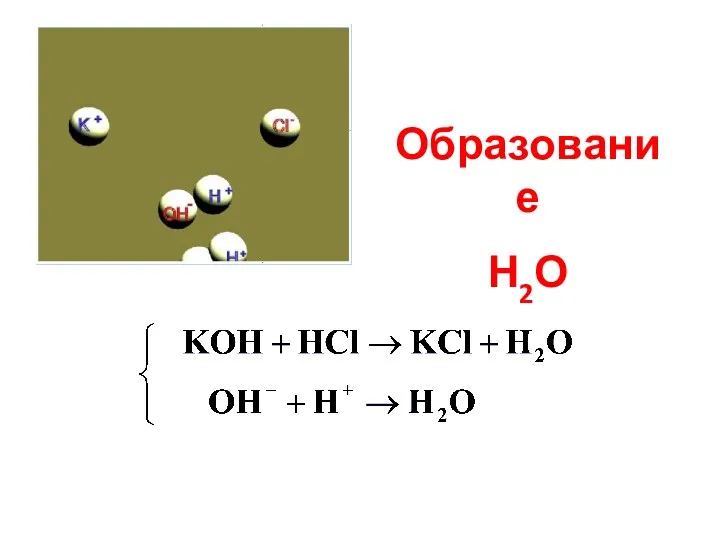
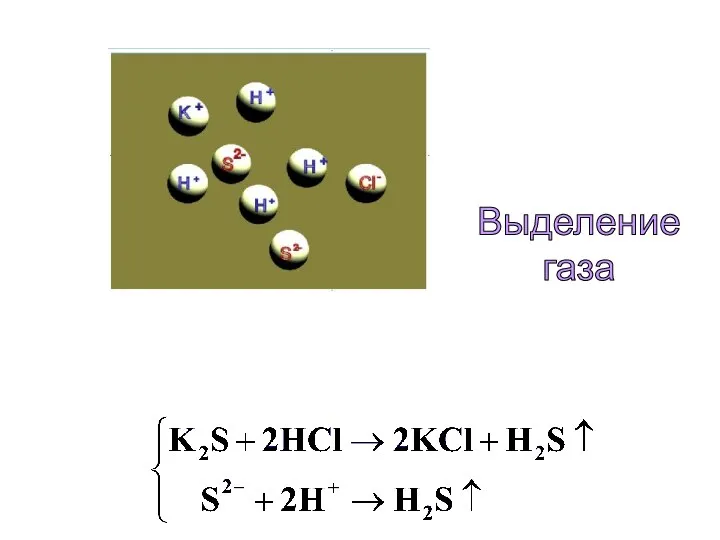
- 13. Реакции в растворах электролитов протекают до конца если: Образуется или растворяется осадок; Выделяется газ; Образуется малодиссоциирующее
- 14. Образование осадка
- 15. Образование Н2О
- 16. Выделение газа
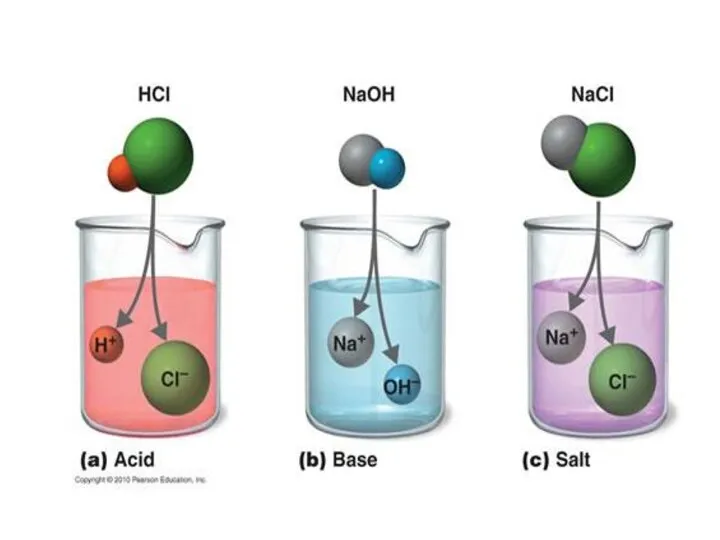
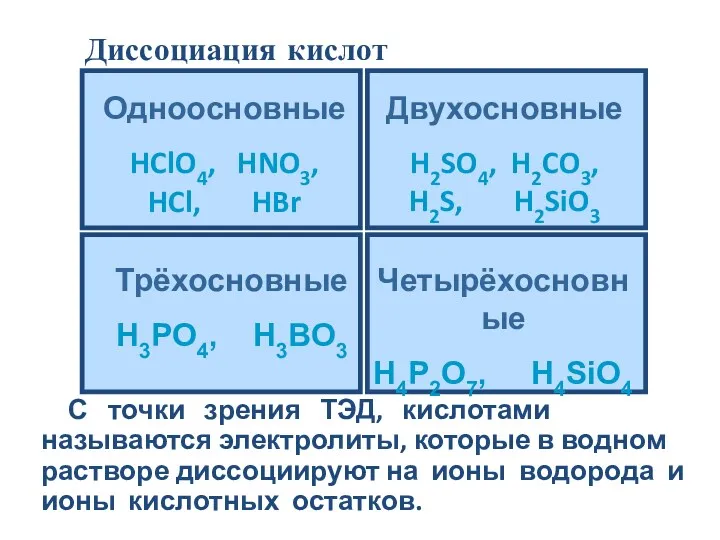
- 17. С точки зрения ТЭД, кислотами называются электролиты, которые в водном растворе диссоциируют на ионы водорода и
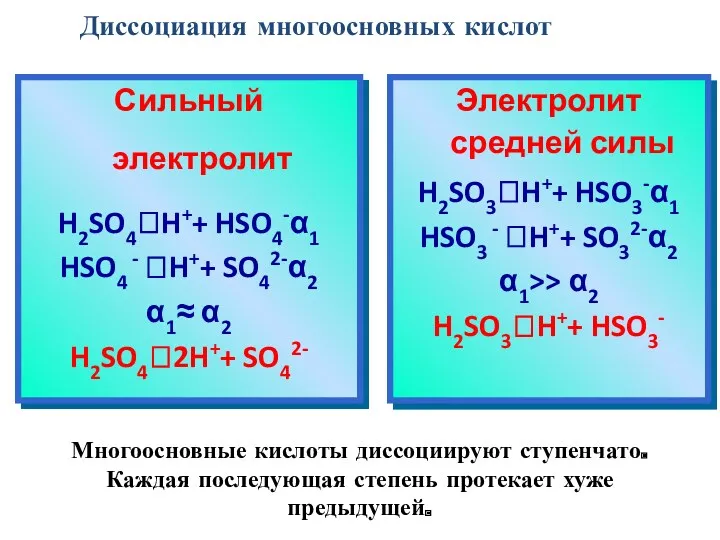
- 18. Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. Сильный электролит H2SO4⮀H++ HSO4-α1 HSO4 -
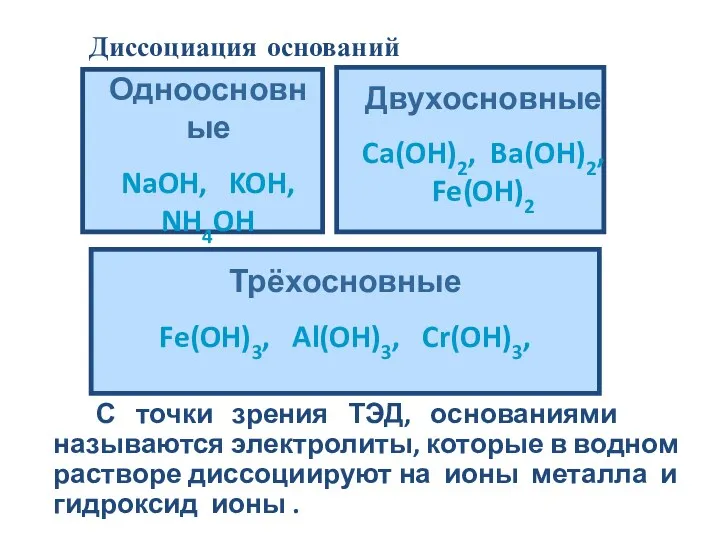
- 19. С точки зрения ТЭД, основаниями называются электролиты, которые в водном растворе диссоциируют на ионы металла и
- 20. NaOH = Na+ + OH- Ba(OH)2 = BaOH+ + OH- → Ba2+ + 2OH- KOH =
- 22. Составление ионных уравнений
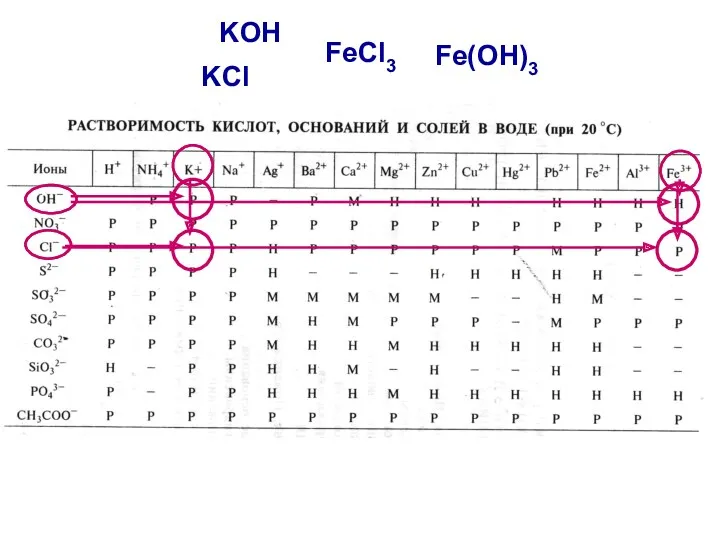
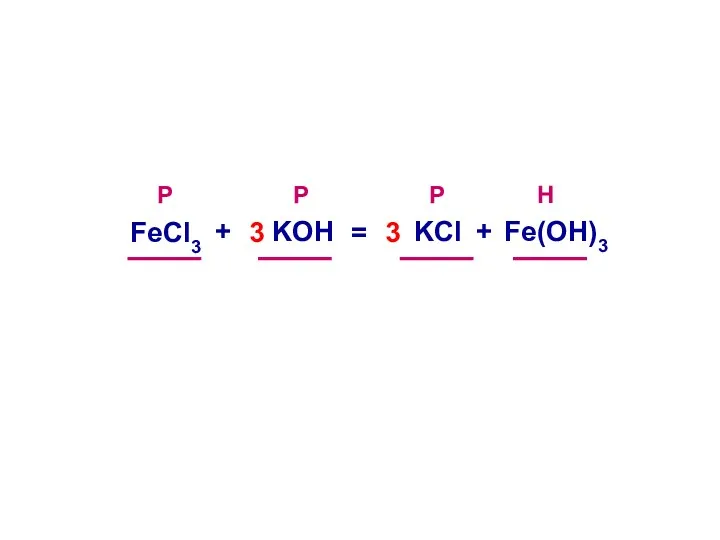
- 23. 1. Записать молекулярное уравнение реакции Даны растворы хлорида железа(III) и гидроксида калия. Написать молекулярное и ионные
- 24. 2. Подчеркнуть формулы электролитов (формулы кислот, оснований, солей) Используя таблицу растворимости определить растворимость электролитов и записать
- 25. FeCl3 KOH Fe(OH)3 KCl
- 26. Р Р Р Н
- 27. 3. Написать полное ионное уравнение реакции. ЗАПОМНИТЬ!!! В ионных уравнениях формулы электролитов 1) растворимых в воде
- 28. 4. Для составления сокращённого ионного уравнения надо найти одинаковые ионы справа и слева от знака равенства
- 30. Скачать презентацию













 Кислород
Кислород Силикатное производство
Силикатное производство Карбоновые кислоты
Карбоновые кислоты Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Диеновые углеводороды CnH2n-2
Диеновые углеводороды CnH2n-2 Кристаллическая решетка
Кристаллическая решетка Мыла: прошлое, настоящее, будущее
Мыла: прошлое, настоящее, будущее Кремний и его соединения
Кремний и его соединения Минералы. Классификация минералов
Минералы. Классификация минералов Застосування неметалів
Застосування неметалів Амины, аминокислоты; состав, получение, значение, применение
Амины, аминокислоты; состав, получение, значение, применение Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Типы химических реакций
Типы химических реакций Титан
Титан Соединения кремния
Соединения кремния Переработка угля
Переработка угля Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16)
Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16) Классы органических и неорганических веществ
Классы органических и неорганических веществ Строение атома. Лекция 2
Строение атома. Лекция 2 Углеводы. Моносахариды. Лекция 5
Углеводы. Моносахариды. Лекция 5 Теории химической кинетики. Лекция 4
Теории химической кинетики. Лекция 4 Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Основные сырьевые материалы для производства портландцемента
Основные сырьевые материалы для производства портландцемента Періодична система хімічних елементів
Періодична система хімічних елементів