Содержание
- 2. План лекции Классификация неорганических веществ Аллотропия Оксиды Основания. Химические свойства оснований Соли. Химические свойства солей Кислоты.
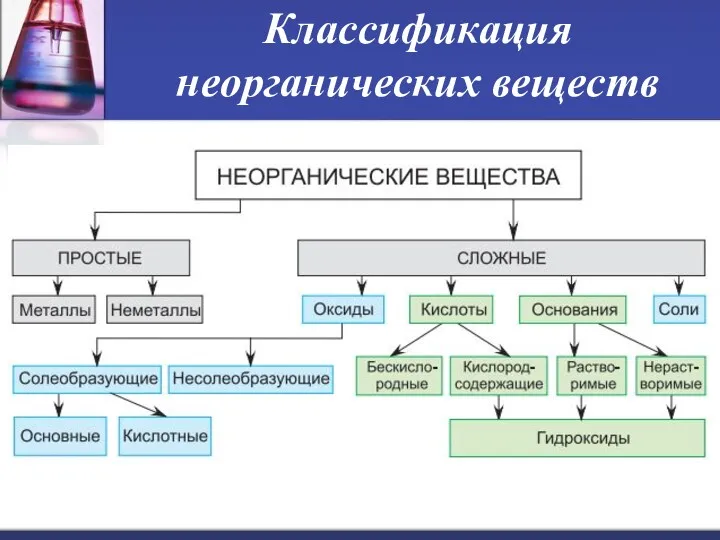
- 3. Классификация неорганических веществ
- 4. Аллотропия Аллотропия - способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
- 5. Оксиды Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
- 6. Химические свойства оксидов
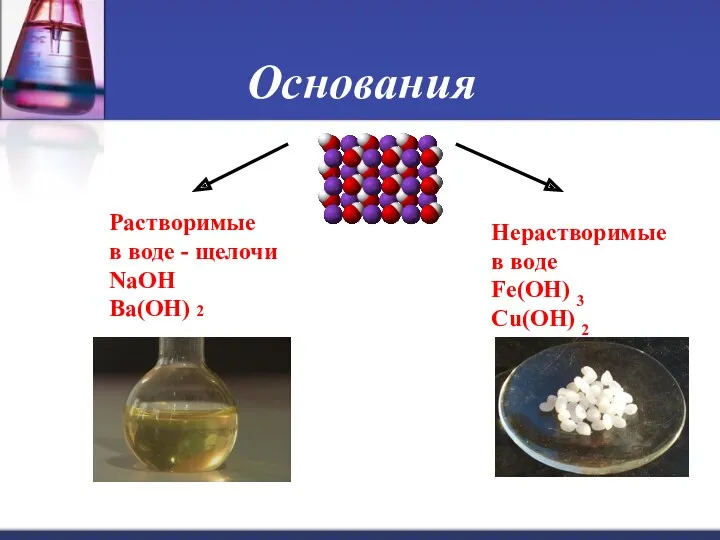
- 7. Основания Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами
- 8. Основания Основаниями называются сложные неорганические соединения состоящие из атома металла и одной или нескольких гидроксильных групп
- 9. Основания Растворимые в воде - щелочи NaOH Ba(OH) 2 Нерастворимые в воде Fe(OH) 3 Cu(OH) 2
- 10. Химические свойства оснований
- 11. Кислоты Кислоты – сложные вещества, состоящие из водорода и кислотного остатка. При этом валентность кислотного остатка
- 12. Соли, классификация Соли – вещества, состоящие из атомов металла и кислотного остатка Классификация солей: Средние (нормальные)
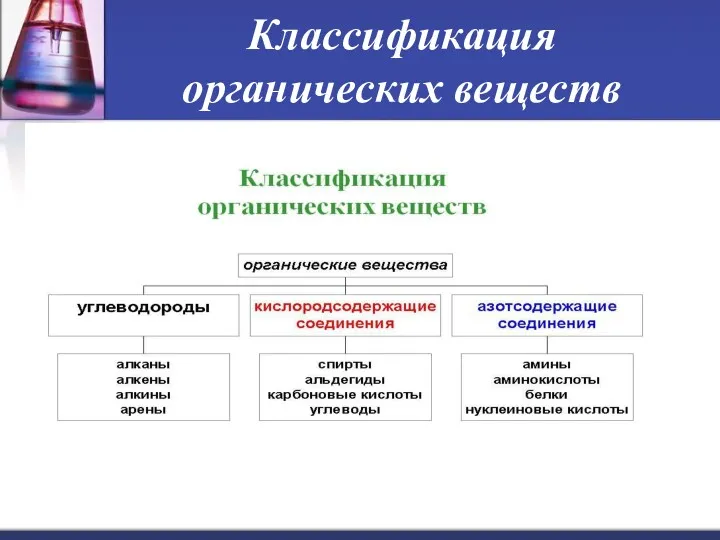
- 13. Классификация органических веществ Органические соединения — соединения, имеющие в своём составе углерод, а также водород либо
- 14. Классификация органических веществ
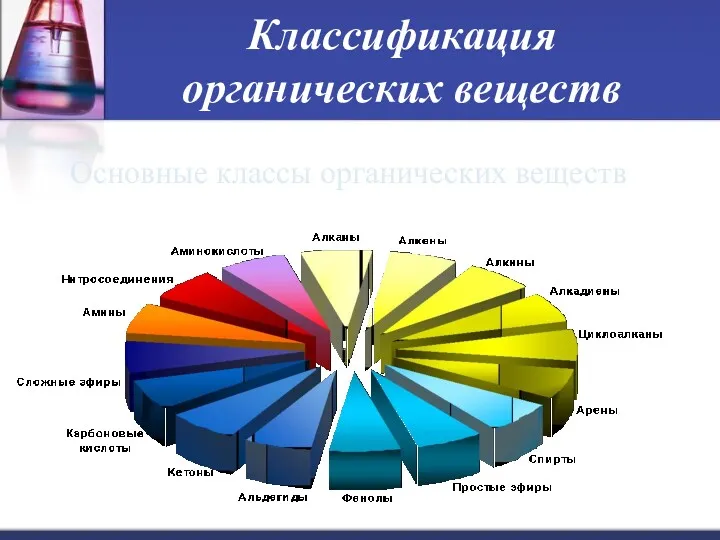
- 15. Классификация органических веществ Основные классы органических веществ
- 16. Классификация органических веществ Алканы — нет кратных связей между атомами углерода Алканы — углеводороды линейного или
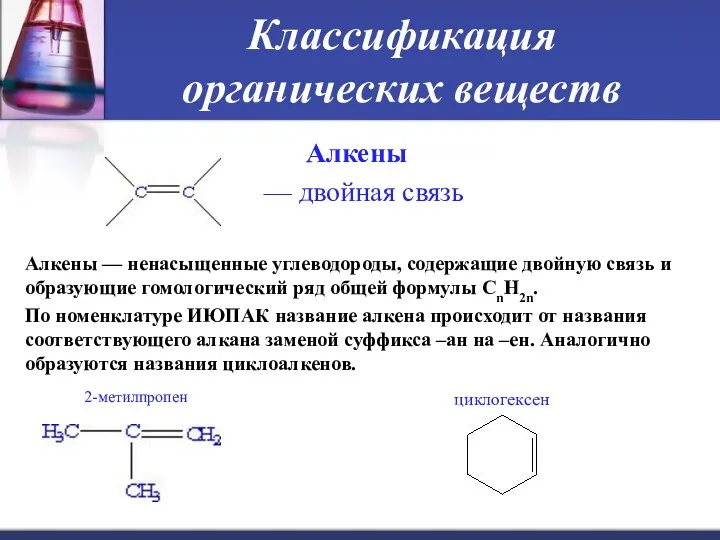
- 17. Классификация органических веществ Алкены — двойная связь Алкены — ненасыщенные углеводороды, содержащие двойную связь и образующие
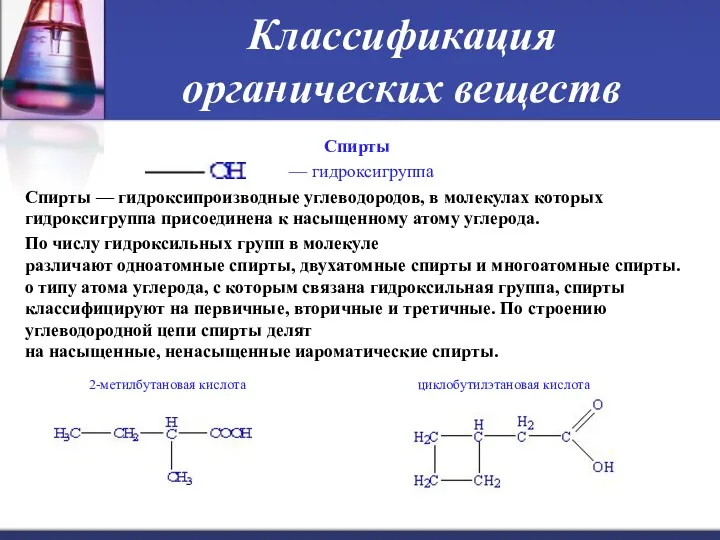
- 18. Классификация органических веществ Спирты — гидроксигруппа Спирты — гидроксипроизводные углеводородов, в молекулах которых гидроксигруппа присоединена к
- 20. Скачать презентацию











 Номенклатура органических веществ
Номенклатура органических веществ Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Целлюлоза. Строение
Целлюлоза. Строение Водородная связь
Водородная связь Автомобильные бензины
Автомобильные бензины Химиялық элемент оттегі
Химиялық элемент оттегі Химические свойства солей
Химические свойства солей Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма)
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма) Карбоновые кислоты
Карбоновые кислоты Коллоидные ПАВ
Коллоидные ПАВ Топливо. Классификация
Топливо. Классификация Минералды тыңайтқыштар
Минералды тыңайтқыштар Кремний и его соединения
Кремний и его соединения Оксиды и гидроксиды
Оксиды и гидроксиды Алюминий и его сплавы
Алюминий и его сплавы Классификация опасных грузов
Классификация опасных грузов Stirring in liquid media
Stirring in liquid media Смещение химического равновесия
Смещение химического равновесия Аминокислоты
Аминокислоты Степень окисления. Подготовка к контрольной работе
Степень окисления. Подготовка к контрольной работе La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons
La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Уход за волосами
Уход за волосами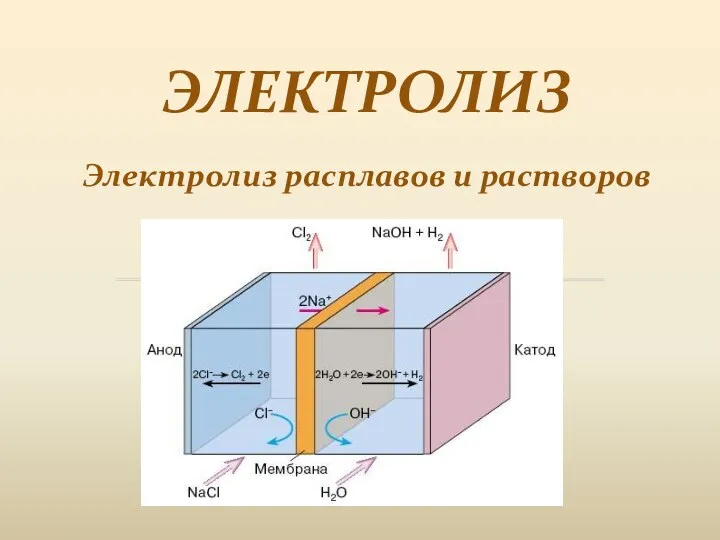 Электролиз. Электролиз расплавов и растворов
Электролиз. Электролиз расплавов и растворов