Содержание
- 2. Теория типов (40-50 гг. XIX в. Ш.Жерар, А.Кекуле и др.) Все органические вещества – производные простейших
- 3. «Органическая химия может сейчас кого угодно свести с ума. Она представляется мне дремучим лесом, полным удивительных
- 4. Основные «противоречия» органической химии Многообразие веществ – образовано небольшим числом элементов; Кажущееся несоответствие валентности в органических
- 5. Предпосылки возникновения теории Установление понятий валентности (Э. Франкланд, 1853г.); Понятие четырехвалентности углерода (А. Кекуле, 1857г.); Идеи
- 6. Основные положения теории строения органических веществ (А.М. Бутлеров, 1861 – 1864 гг.) Атомы в молекулах веществ
- 7. 3. Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов
- 8. 5. Зная строение вещества, можно предположить его свойства. И наоборот, зная свойства вещества, можно предположить его
- 9. Основное положение современной теории строения Свойства веществ зависят не только от их химического строения, но также
- 10. Проверка знаний: Составьте две структурные формулы вещества, имеющего молекулярную формулу С4Н10.
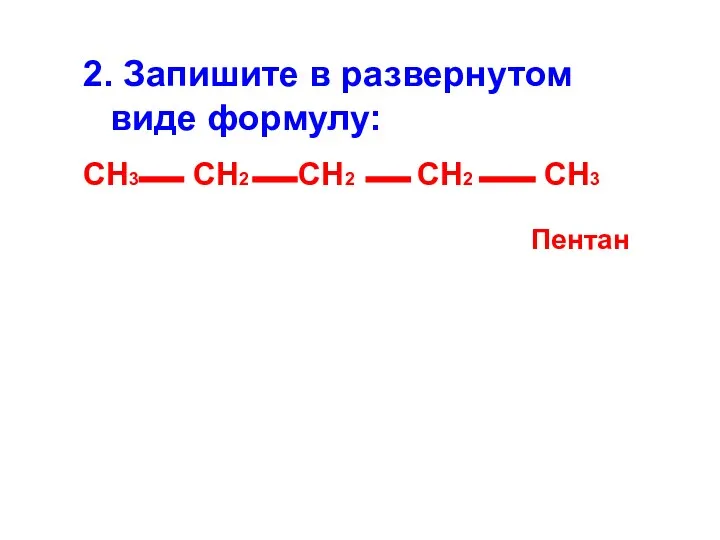
- 11. 2. Запишите в развернутом виде формулу: СН3 СН2 СН2 СН2 СН3 Пентан
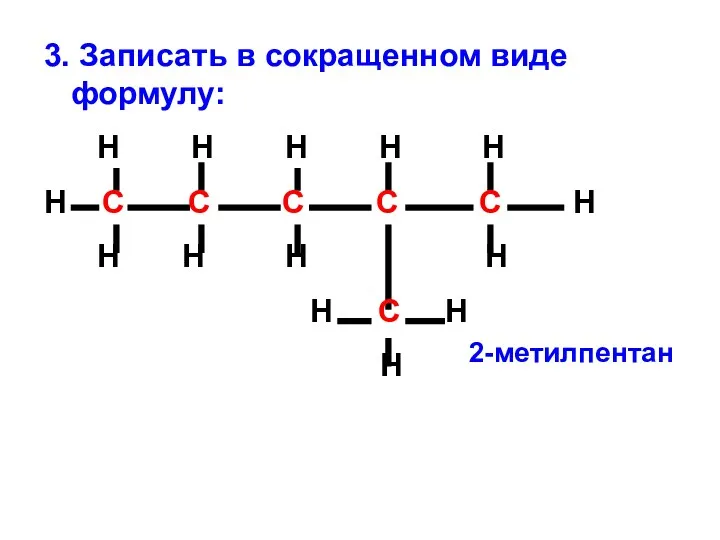
- 12. 3. Записать в сокращенном виде формулу: Н Н Н Н Н Н С С С С
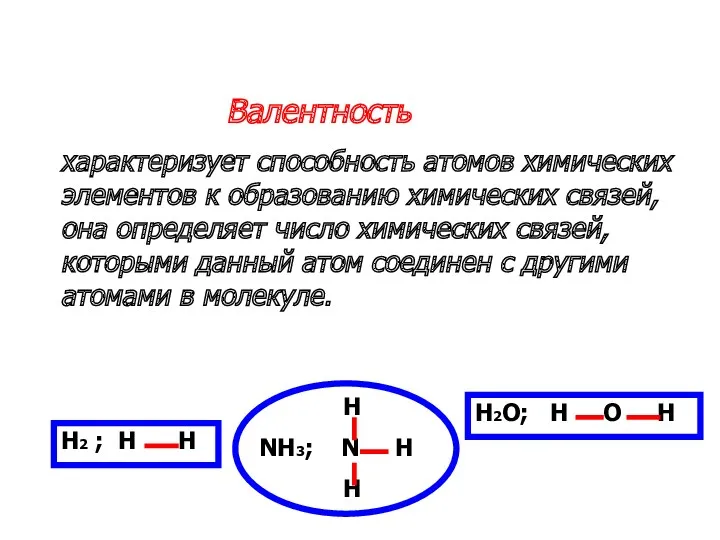
- 13. Валентность характеризует способность атомов химических элементов к образованию химических связей, она определяет число химических связей, которыми
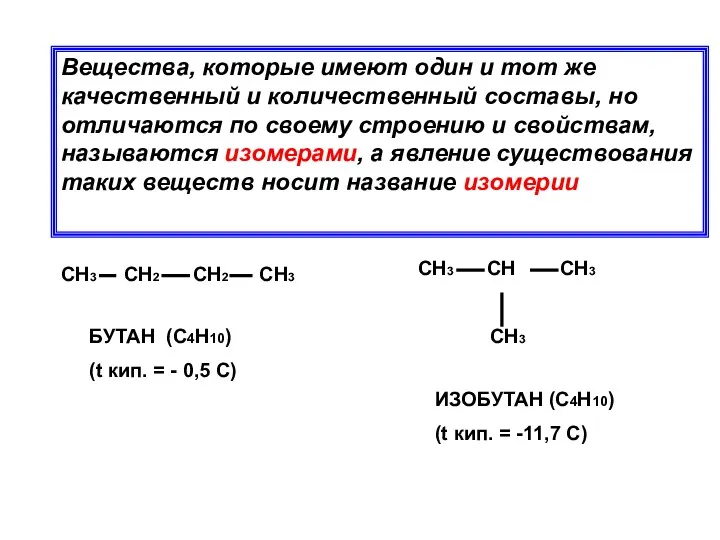
- 14. Вещества, которые имеют один и тот же качественный и количественный составы, но отличаются по своему строению
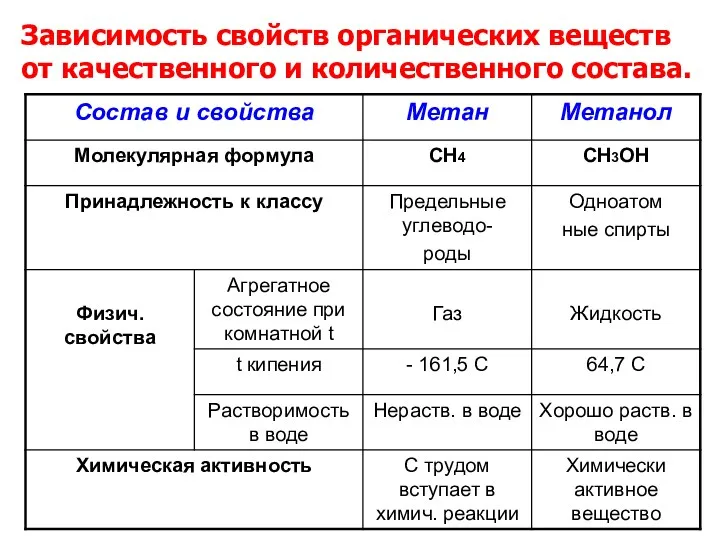
- 15. Зависимость свойств органических веществ от качественного и количественного состава.
- 16. Франкленд (Frankland) Эдуард (1825-99), английский химик-органик, иностранный член-корреспондент Петербургской АН (1876). Ввел термин «валентность» (1853).
- 17. Бутлеров Александр Михайлович (1828-86), российский химик-органик, академик Петербургской АН (1874). Создал (1861) и обосновал теорию химического
- 18. Берцелиус (Berzelius) Йенс Якоб (1779-1848), шведский химик и минералог, иностранный почетный член Петербургской АН (1820). Открыл
- 19. Кекуле (Kekule) Фридрих Август (1829-96), немецкий химик-органик, иностранный член-корреспондент Петербургской АН (1887). Труды по теории строения
- 21. Скачать презентацию













 Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах
Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах Рідкі кристали
Рідкі кристали 20230205_okislitelno-vosstanovitelnye_reaktsii
20230205_okislitelno-vosstanovitelnye_reaktsii Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості 20230306_oksidy
20230306_oksidy Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Аммиак. Физические и химические свойства аммиака
Аммиак. Физические и химические свойства аммиака Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения? Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Растворы. Концентрация растворов
Растворы. Концентрация растворов Соли как производные кислот и оснований
Соли как производные кислот и оснований Водород. Свойства водорода
Водород. Свойства водорода Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Аммиак
Аммиак Суды тазарту әдістері
Суды тазарту әдістері Основания
Основания Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Одноосновные ненасыщенные кислоты
Одноосновные ненасыщенные кислоты Периодическая таблица химических элементов
Периодическая таблица химических элементов Оксиды. Определение
Оксиды. Определение Производство чугуна и стали
Производство чугуна и стали Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Тепловой эффект химической реакции
Тепловой эффект химической реакции Значення хімічних процесів у природі
Значення хімічних процесів у природі Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі