Содержание
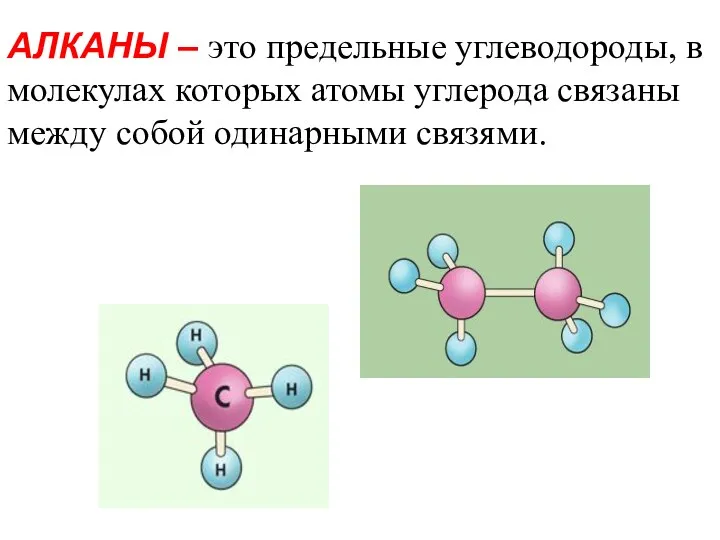
- 2. АЛКАНЫ – это предельные углеводороды, в молекулах которых атомы углерода связаны между собой одинарными связями.
- 3. Общая формула СnH2n+2 , где n=1,2,3…
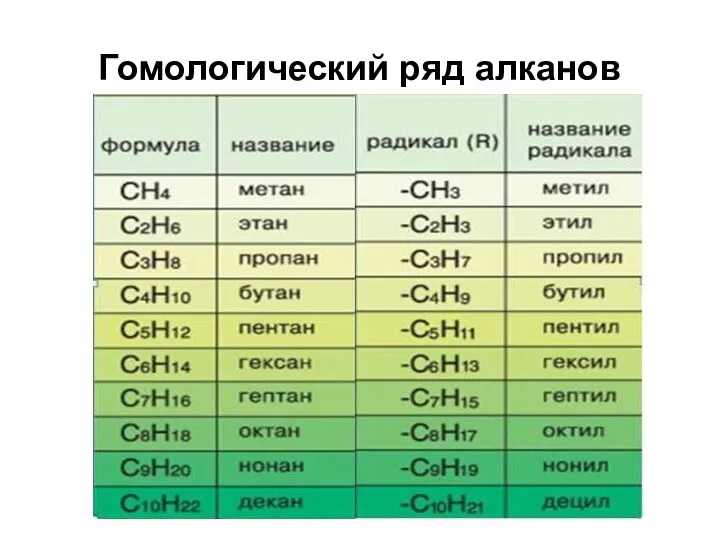
- 4. Гомологический ряд алканов
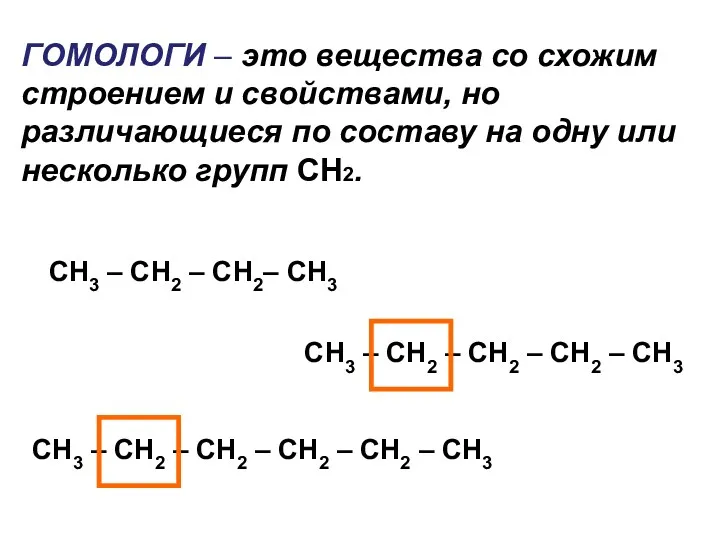
- 5. ГОМОЛОГИ – это вещества со схожим строением и свойствами, но различающиеся по составу на одну или
- 6. ИЗОМЕРЫ – вещества, имеющие одинаковый состав молекул, но различное химическое строение и обладающие поэтому разными свойствами.
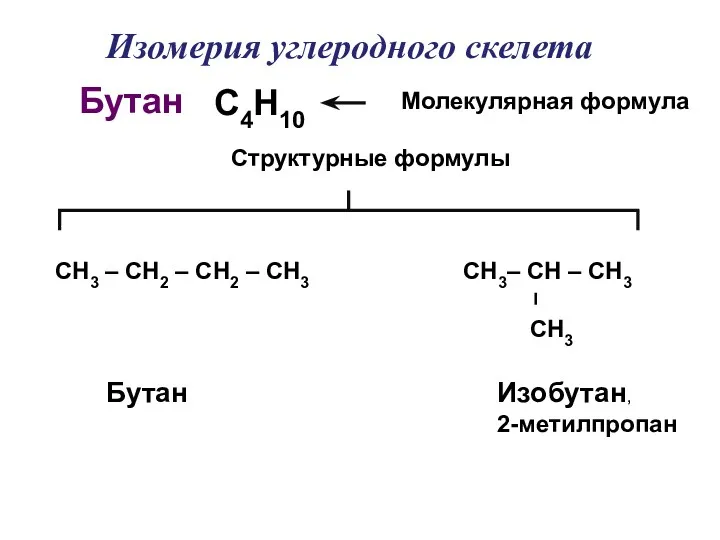
- 7. С4Н10 СН3 – СН2 – СН2 – СН3 Молекулярная формула Структурные формулы Бутан Бутан Изобутан, 2-метилпропан
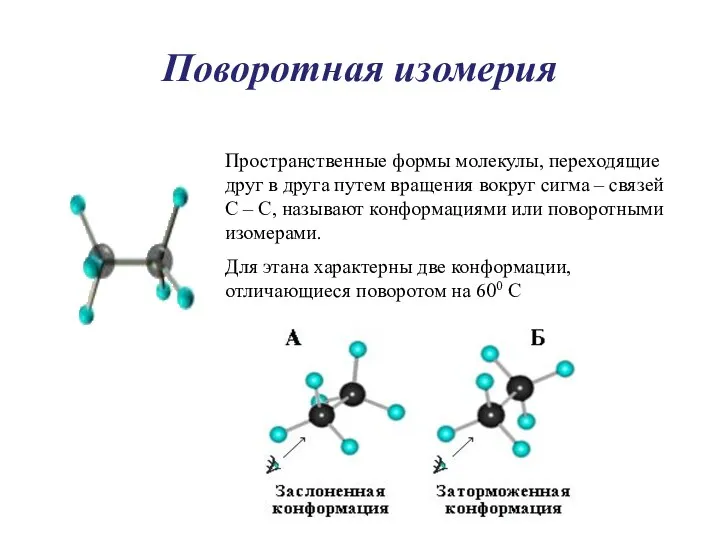
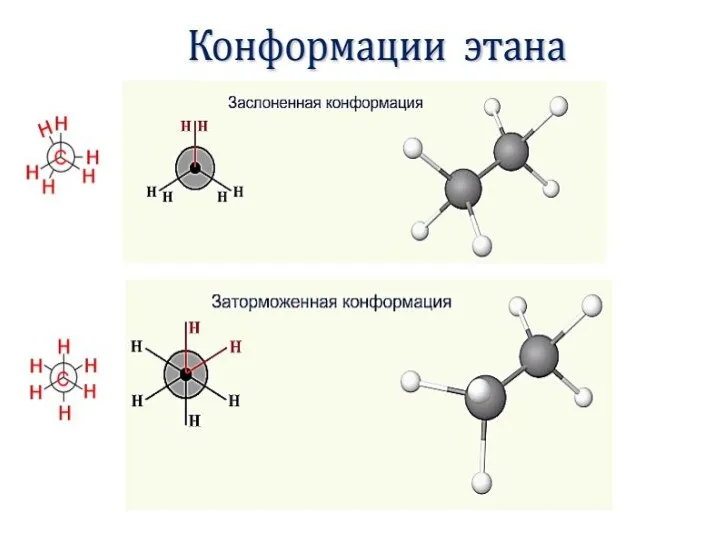
- 8. Поворотная изомерия Пространственные формы молекулы, переходящие друг в друга путем вращения вокруг сигма – связей С
- 10. Зеркальная изомерия (оптическая) Если атом углерода связан с четырьмя другими атомами, то возможно существование двух соединений
- 11. НОМЕНКЛАТУРА АЛКАНОВ Алгоритм: Выбор главной, самой длинной цепи: CH3 – CH - CH2 - CH3 │
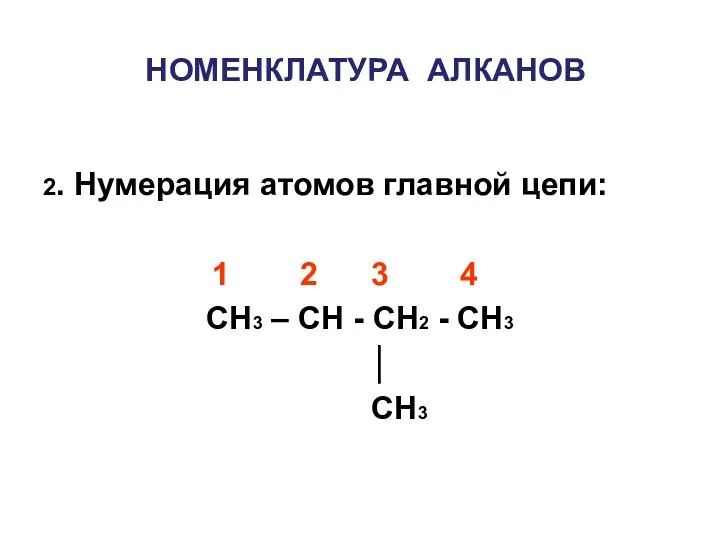
- 12. НОМЕНКЛАТУРА АЛКАНОВ 2. Нумерация атомов главной цепи: 1 2 3 4 CH3 – CH - CH2
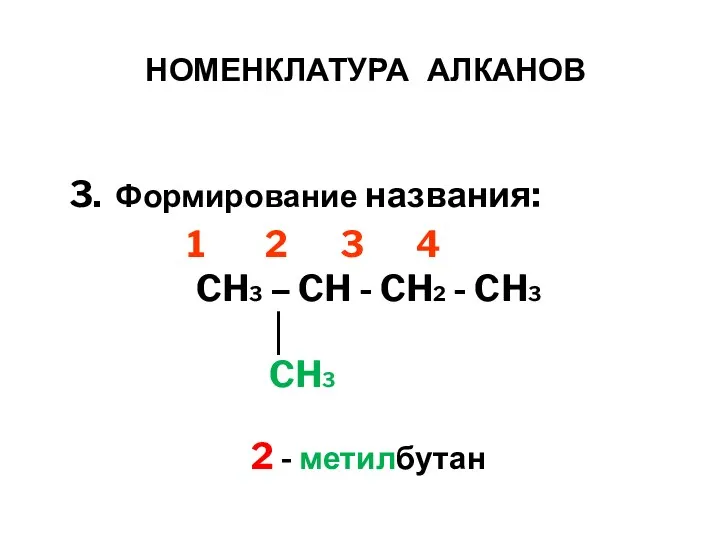
- 13. НОМЕНКЛАТУРА АЛКАНОВ 3. Формирование названия: 1 2 3 4 CH3 – CH - CH2 - CH3
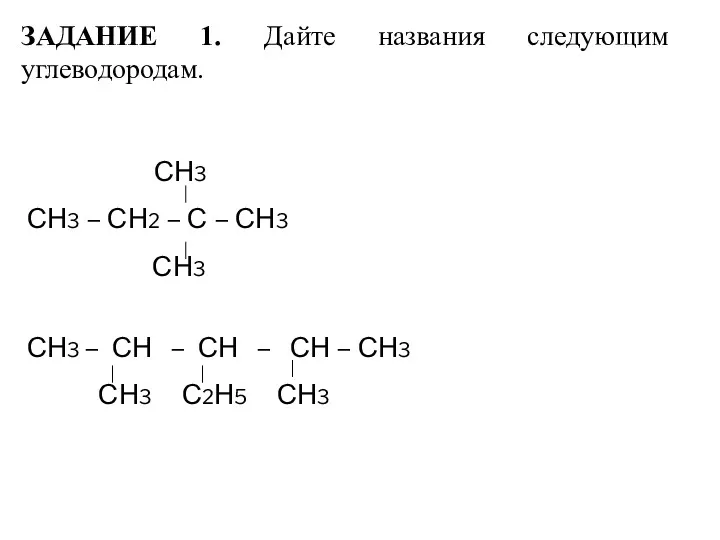
- 14. ЗАДАНИЕ 1. Дайте названия следующим углеводородам. СН3 СН3 – СН2 – С – СН3 СН3 СН3
- 15. СН3 І СН3 –СН2 – С – СН2 –СН3 І І СН3 СН3
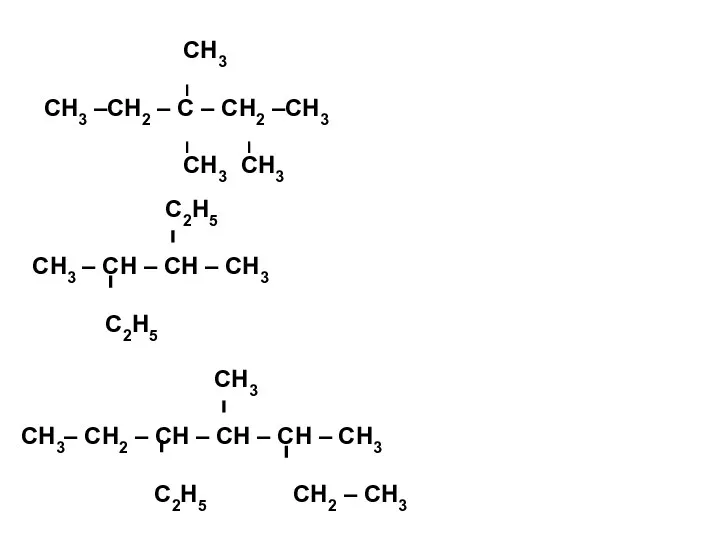
- 16. ЗАДАНИЕ 2. Составьте структурные формулы следующих веществ: 1. 2,3 – диметилпентан; 2. 3,3,4 – триметилгексан; 3.
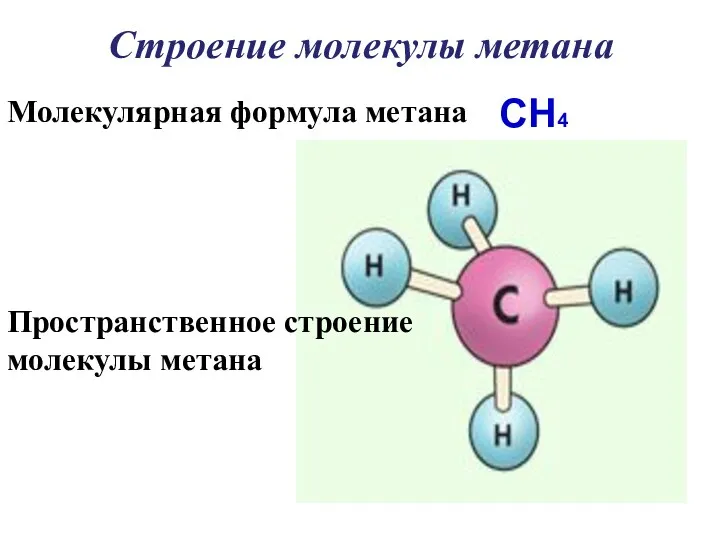
- 17. Строение молекулы метана Молекулярная формула метана CH4 Пространственное строение молекулы метана
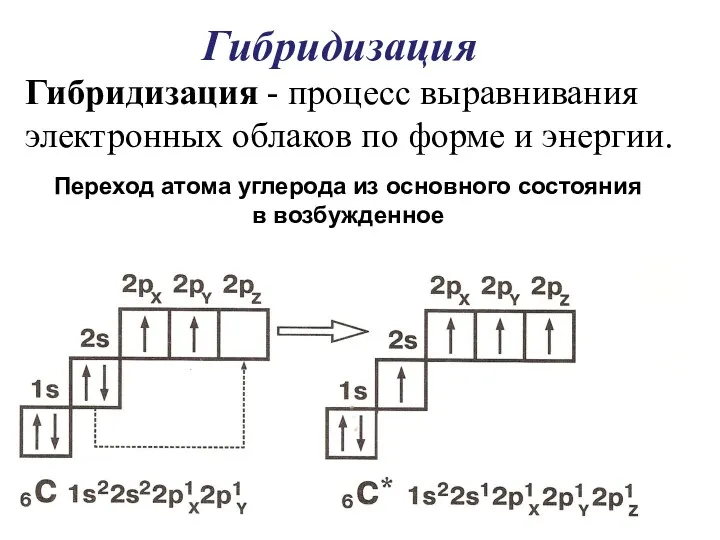
- 18. Гибридизация Переход атома углерода из основного состояния в возбужденное Гибридизация - процесс выравнивания электронных облаков по
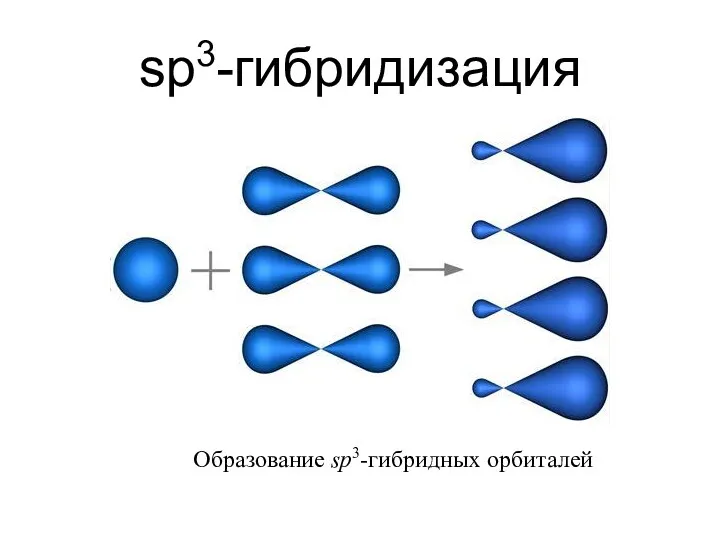
- 19. sp3-гибридизация Образование sp3-гибридных орбиталей
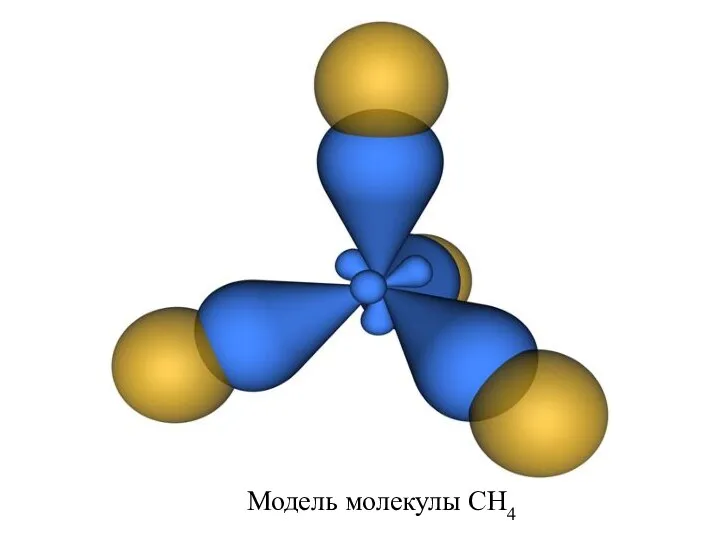
- 20. Модель молекулы CH4
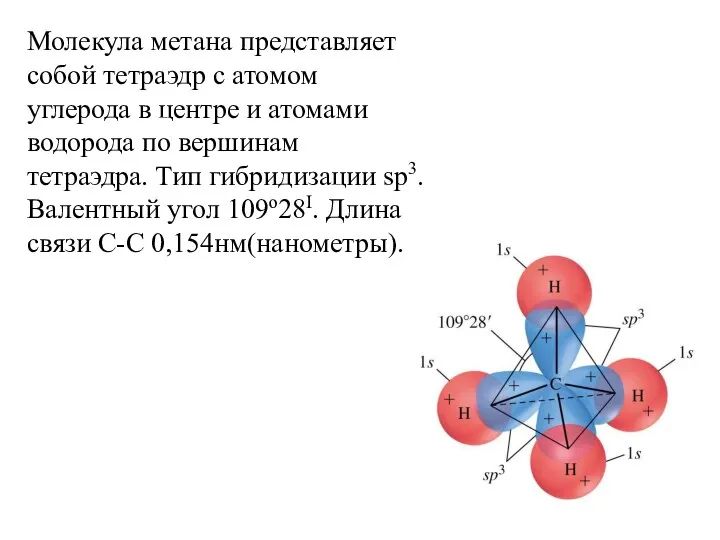
- 21. Молекула метана представляет собой тетраэдр с атомом углерода в центре и атомами водорода по вершинам тетраэдра.
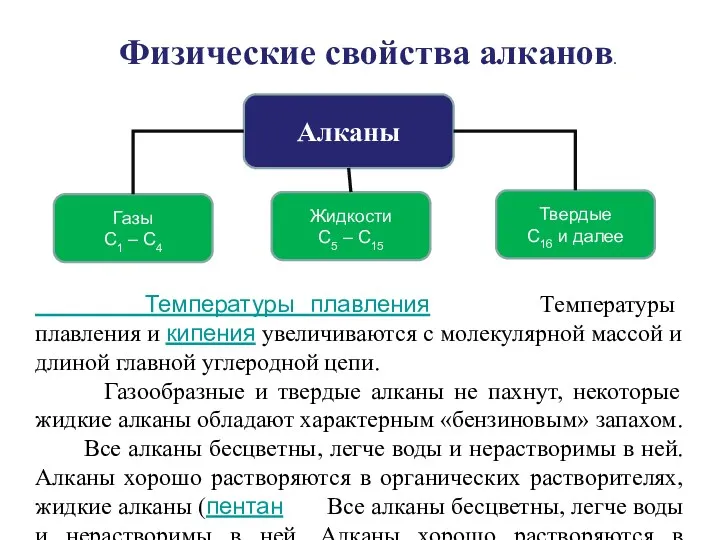
- 22. Алканы Жидкости С5 – С15 Газы С1 – С4 Твердые С16 и далее Физические свойства алканов.
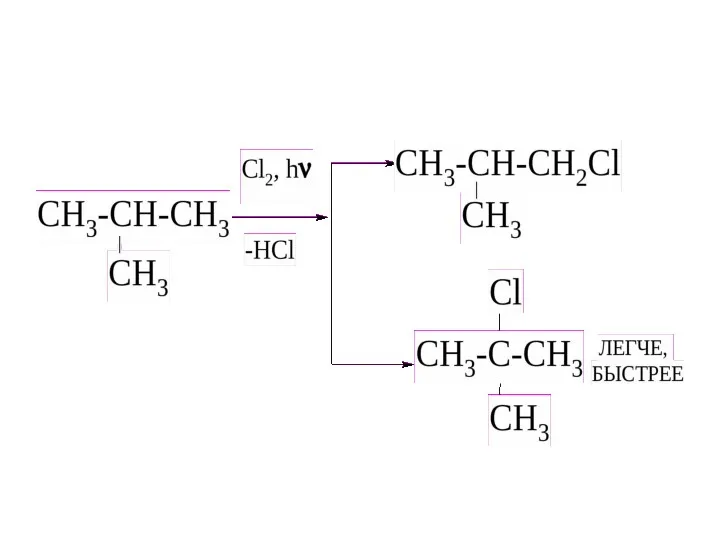
- 23. 1. Реакции замещения Протекают по механизму радикального замещения. а) с галогенами (с Cl2 – на свету,
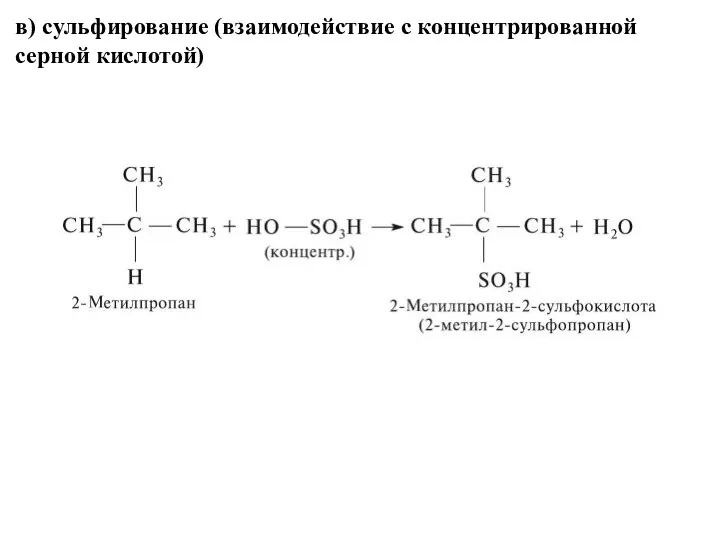
- 27. в) сульфирование (взаимодействие с концентрированной серной кислотой)
- 28. 2. Реакции окисления CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O CH4 + 2O2 → CO2 +
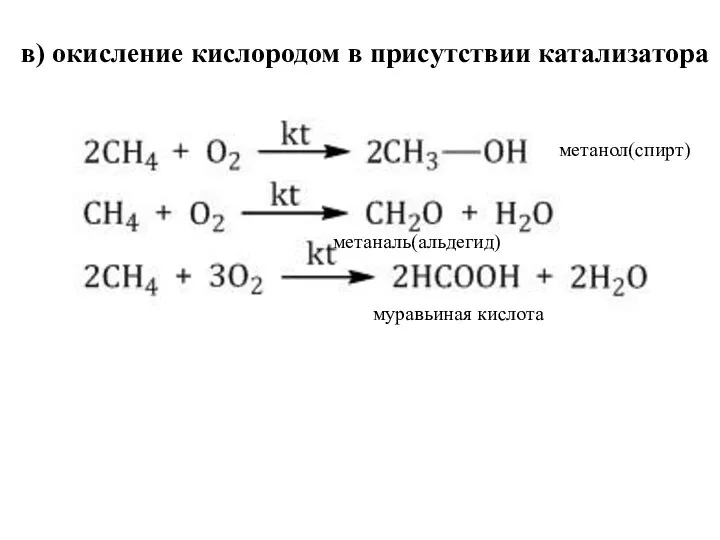
- 29. в) окисление кислородом в присутствии катализатора метанол(спирт) метаналь(альдегид) муравьиная кислота
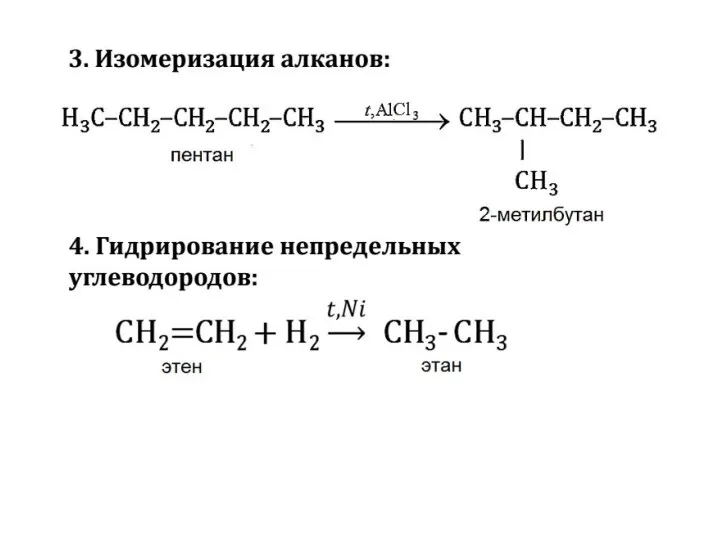
- 30. 3. Термические превращения алканов а) дегидрирование(отщепление водорода) в присутствии катализатора при высоких температурах : CH3 –
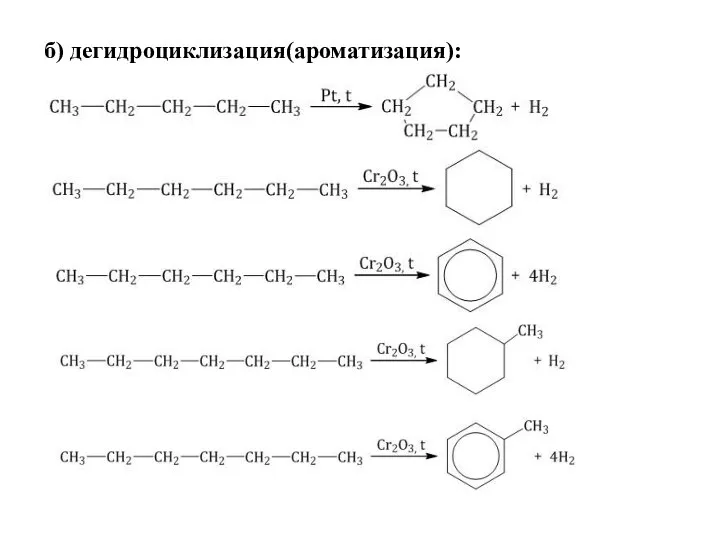
- 31. б) дегидроциклизация(ароматизация):
- 32. в) крекинг - это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с
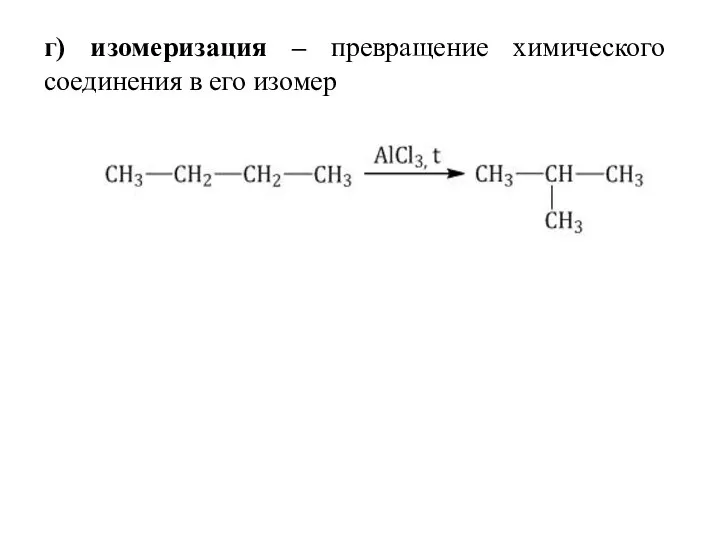
- 33. г) изомеризация – превращение химического соединения в его изомер
- 34. Способы получения
- 36. 1926г. Фишер-Тропш
- 40. Задания для самостоятельной работы: Задание 1. Назовите вещества
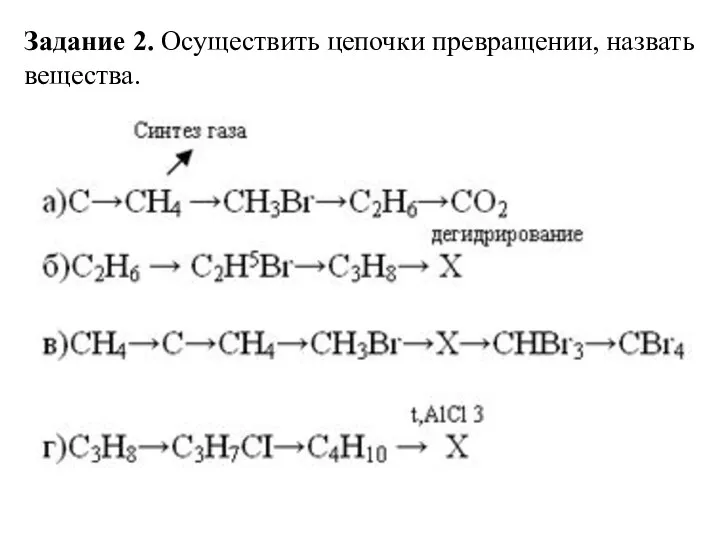
- 41. Задание 2. Осуществить цепочки превращении, назвать вещества.
- 42. Домашние задание
- 44. Скачать презентацию


















 Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6)
Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6) Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Общая химия.(Лекция№1). Основные законы и понятия химии
Общая химия.(Лекция№1). Основные законы и понятия химии Воздух, которым мы дышим
Воздух, которым мы дышим Щелочноземельные металлы
Щелочноземельные металлы Пиролиз углеводородов
Пиролиз углеводородов Соединения галогенов
Соединения галогенов Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Происхождение химичесих элементов
Происхождение химичесих элементов Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Теория электролитической диссоциации
Теория электролитической диссоциации Комплексні сполуки. Комплексоутворення в біологічних системах
Комплексні сполуки. Комплексоутворення в біологічних системах Природные источники углеводородов
Природные источники углеводородов Кислород и его применение
Кислород и его применение Chemical kinetics
Chemical kinetics Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Классификация химических элементов
Классификация химических элементов Protecting-Group-Free Enantioselective Synthesis of (-)-Pallavicinin and (+)-Neopallavicinin
Protecting-Group-Free Enantioselective Synthesis of (-)-Pallavicinin and (+)-Neopallavicinin Углеводы. Олигосахариды. Полисахариды. Биоорганическая химия
Углеводы. Олигосахариды. Полисахариды. Биоорганическая химия Химическая связь
Химическая связь Классификация химических реакций
Классификация химических реакций Лабораторные исследования состава и физико-химических свойств нефти
Лабораторные исследования состава и физико-химических свойств нефти Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів
Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів Частицы вещества: молекула, атом, ион
Частицы вещества: молекула, атом, ион Конструкционные материалы на основе легких металлов: сплавы алюминия
Конструкционные материалы на основе легких металлов: сплавы алюминия Валентность химических элементов
Валентность химических элементов Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory