Слайд 2

План
8.1 Методы оксидиметрии и их классификация
8.1.1 Теоретические основы перманганатометрии
8.1.2 Метод
иодометрии
Слайд 3

8.2 Комплексонометрическое титрование, его виды
8.2.1 Комплексоны и их особенности
8.2.2 Индикаторы комплексонометрии
8.3
Применение методов оксидиметрии и комплексонометрии в медицине
Слайд 4

8.1
Окислительно-восстановительное титрование основано на использовании окислительно-восстановительных реакций:
Ох1 + Rеd2 ↔
Rеd1 + Ох2
При его проведении титруемое вещество вступает в ОВР с титрантом.
Слайд 5

Например, в кислой среде MnO4‾ присоединяет 5 ē и восстанавливается до
Mn2+;
в щелочной среде – 1 ē и восстанавливается до MnO42‾;
в нейтральной – 3 ē и восстанавливается до MnO2
Слайд 6

Поэтому, в кислой среде Мэкв(KMnO4) = 158 / 5 = 31,6
г/моль;
в щелочной Мэкв(KMnO4) = 158 г/моль;
в нейтральной – Мэкв(KMnO4) = 158 / 3 = 52,67 г/моль.
Слайд 7

Используется несколько видов ОВ титрования:
прямое, обратное, заместительное.
Слайд 8

Прямое титрование проводят при ЭДС ≥ 0,4 В, что обеспечивает необходимую
полноту и скорость протекания реакции. Прямым титрованием определяют йод, Fe(II).
Слайд 9

Обратное титрование используется при медленно протекающих ОВ реакциях. При этом к
титруемой смеси добавляют избыток титранта I и выдерживают определенное время. Затем избыток титранта I оттитровывают другим титрантом II.
Слайд 10
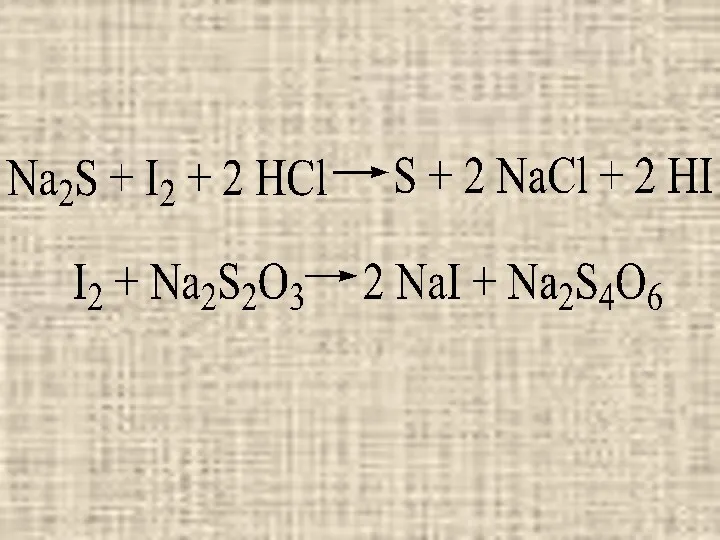
Слайд 11

Заместительное титрование проводят, определяя заместитель – выделяющийся в эквивалентном количестве продукт
реакции определяемого вещества с реагентом. Так анализируются вещества, не вступающие в ОВР.
Слайд 12
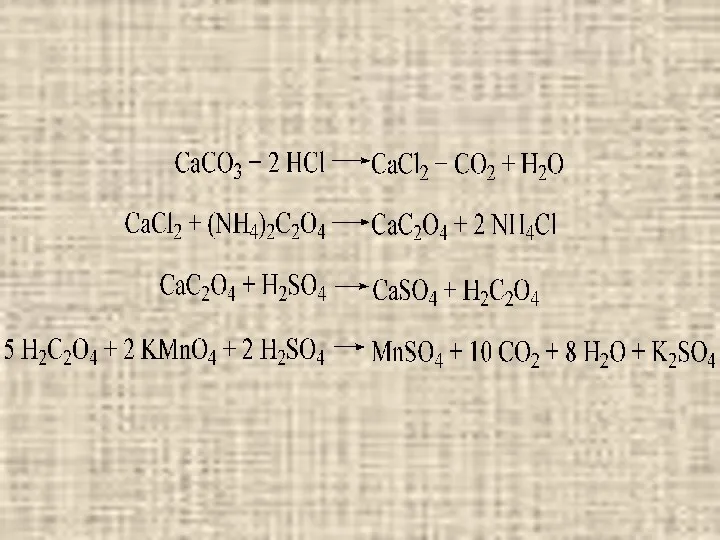
Слайд 13

8.1.1
Метод перманганатометрии основан на реакциях окисления различных веществ калия перманганатом.
Процесс осуществляют в сильно кислой среде, т.к. MnO4‾ проявляет в этом случае наиболее сильные окислительные свойства.
Слайд 14
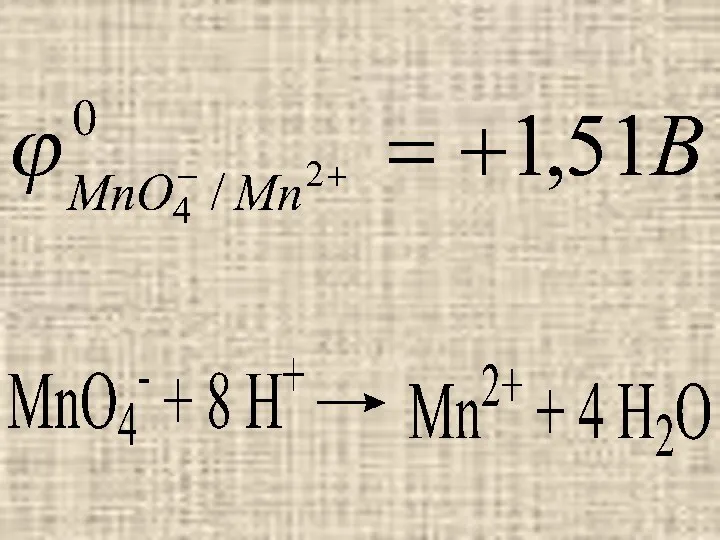
Слайд 15
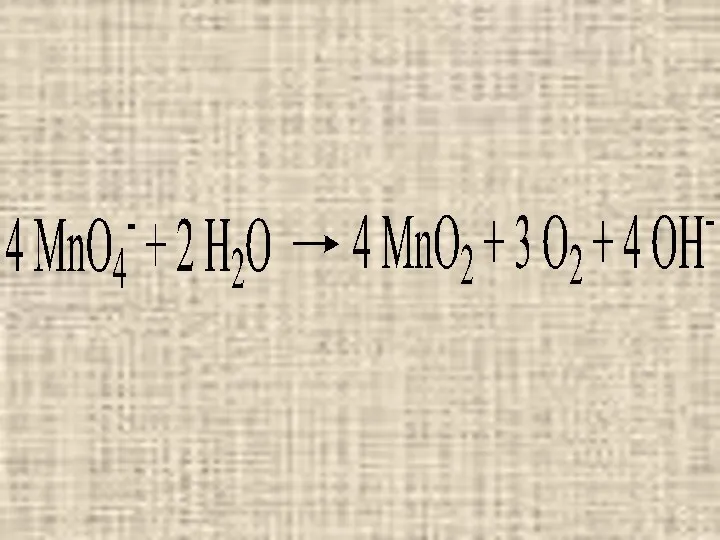
Слайд 16
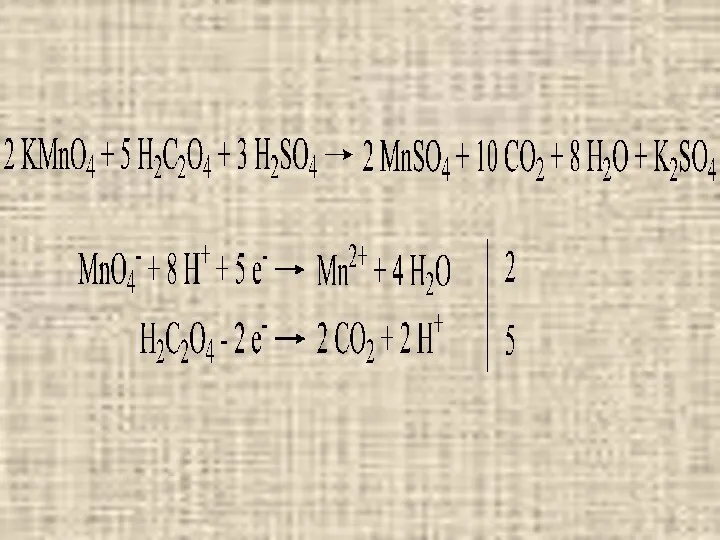
Слайд 17

Реакция KMnO4 с Н2С2O4 – автокаталитическая, т.е. вначале протекает медленно, поэтому
раствор Н2С2O4 нагревают до 70-80оС, а после появления в смеси катализатора Mn2+ реакция ускоряется.
Слайд 18

Для определения восстановителей используют прямое титрование:
Слайд 19
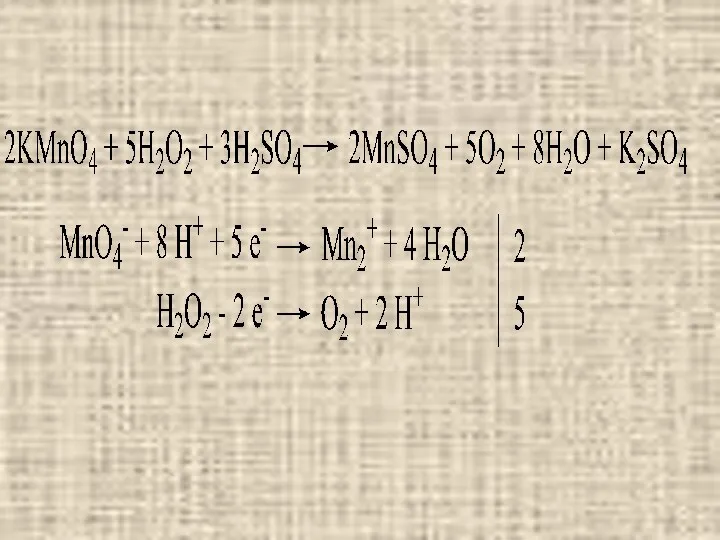
Слайд 20

Для определения окислителей используют обратное титрование
Слайд 21

При использовании косвенного титрования анализируемый раствор, содержащий Са2+, обрабатывают растворимым
оксалатом, чтобы полностью осадить Са2+ в виде твердого CaC2O4. Осадок отфильтровывают и растворяют в серной кислоте
Слайд 22
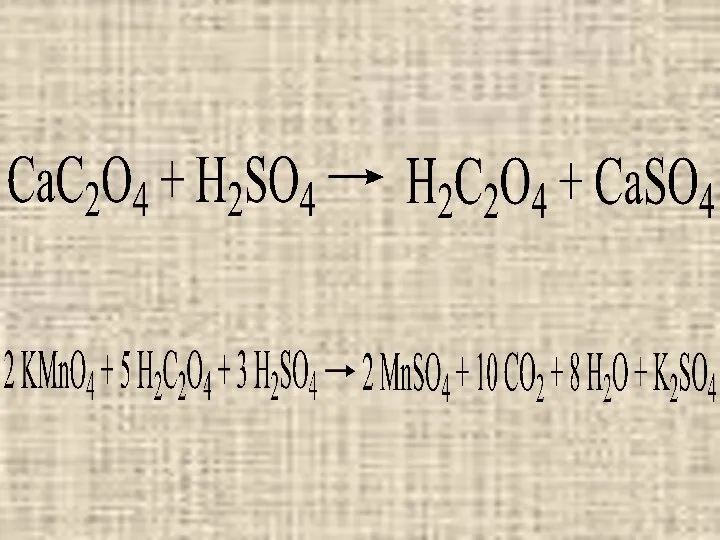
Слайд 23

8.1.2
Метод иодометрии основан на ОВ реакциях, связанных с превращением I2
в I‾ и обратно:
I2 + 2ē ↔ 2 I‾
Ох Red
Слайд 24
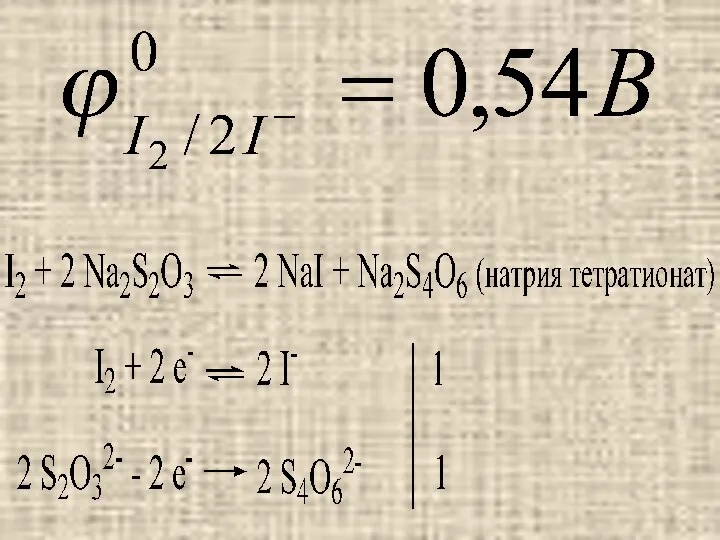
Слайд 25

Йодометрию необходимо проводить:
1) на холоде (т.к. I2 – летучее соединение, и
при нагревании чувствительность крахмала к йоду уменьшается);
2) рН не должен превышать 9, т.к. в щелочной среде возможна реакция:
Слайд 26

Прямое титрование рабочим раствором I2 – определение соединений As(III), Sb(III), Sn(II),
сульфидов, сульфитов, аскорбиновой кислоты:
Слайд 27

Слайд 28

Этим методом определяют Cl2, Br2, KMnO4, KClO3, CaOCl2, нитриты, Н2О2, Fe(III),
Cu(II), As(V).
Слайд 29
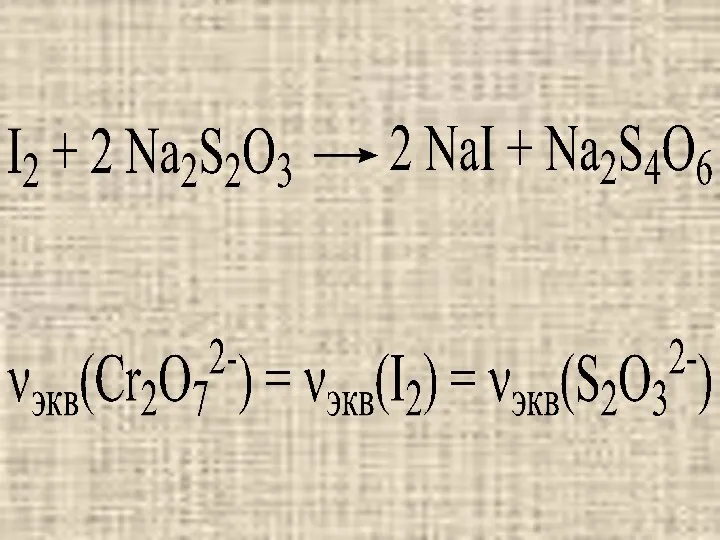
Слайд 30

8.2.1
Широкое применение получили аналитические органические реагенты, предложенные в 1944 г.
Г. Шварценбахом. Он отнес к ним группу аминополиуксусных кислот, содержащих иминодиацетатные фрагменты – N(CH2COOH)2, связанные с определенными алифатическими и ароматическими радикалами.
Слайд 31
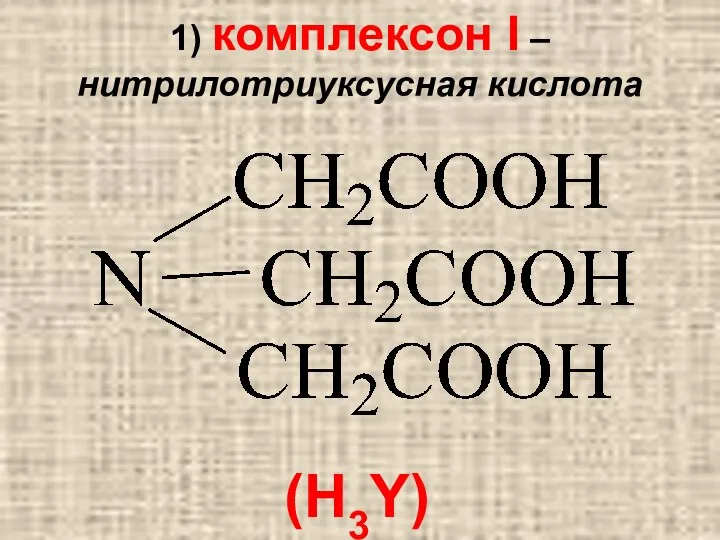
(H3Y)
1) комплексон I – нитрилотриуксусная кислота
Слайд 32
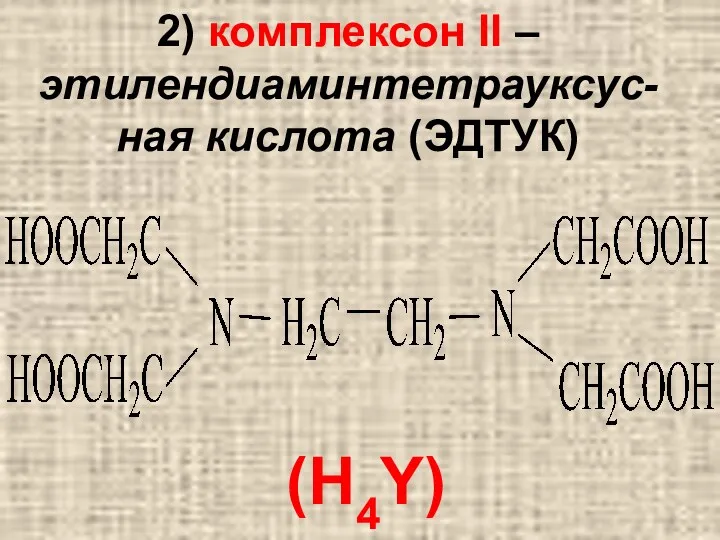
(H4Y)
2) комплексон II – этилендиаминтетрауксус-ная кислота (ЭДТУК)
Слайд 33

(Na2H2Y)
3) комплексон III – динатриевая соль ЭДТУК – ЭДТА
(Трилон Б)
Слайд 34
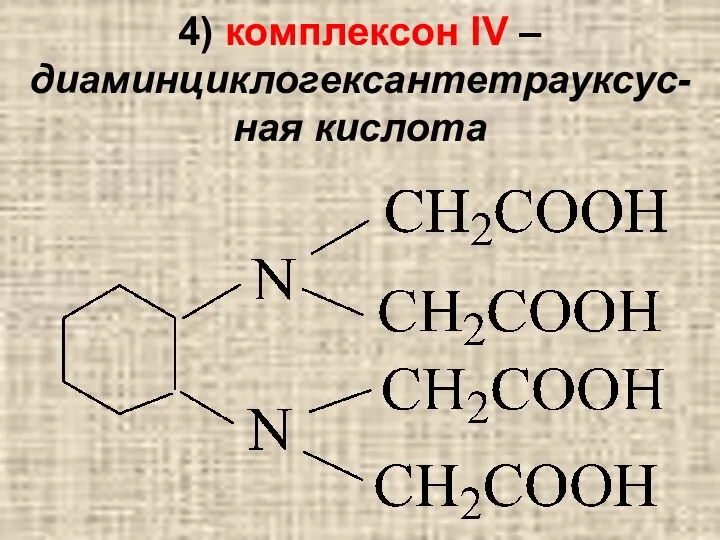
4) комплексон IV – диаминциклогексантетрауксус-ная кислота
Слайд 35
![Ме2+ + [Y]4‾ ↔ [MeY]2‾ С катионами Ме ЭДТА образует комплексные соединения в соотношении 1:1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361227/slide-34.jpg)
Ме2+ + [Y]4‾ ↔ [MeY]2‾
С катионами Ме ЭДТА образует
комплексные соединения в соотношении 1:1
Слайд 36
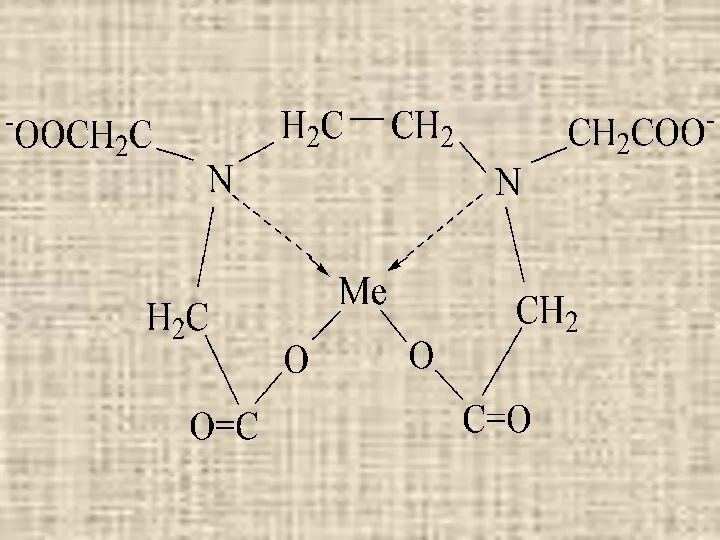
Слайд 37

ЭДТУК (H4Y) – белое кристаллическое вещество мало растворимое в воде. Растворимость
H4Y минимальна при рН 1,6-1,8. При повышении и понижении концентрации ионов водорода растворимость растет.
Слайд 38

Высокая растворимость в минеральных кислотах объясняется образованием протонированных форм H5Y+ и
H6Y2+
Слайд 39

ЭДТУК – четырехпротонная кислота, которая ионизирует по 4-м ступеням, причем по
первым двум в значительной степени (рК1= =2,07; рК2= 2,75), по третьей и четвертой – гораздо меньше (рК3=6,24; рК4=10,34)
Слайд 40

Поэтому ЭДТА в кислой среде (рН = 4,5) частично протонируется и
находится в виде [H2Y]2‾, в слабо щелочной (рН = 8-9) под действием ОН‾ частично депротонируется и переходит в [HY]3‾, в сильно щелочной (рН > 12) полностью депротонируется и находится в виде Y4‾
Слайд 41

Реакция комплексообразования проходит между полностью ионизированной формой Y4‾ и ионами Ме
и характеризуется общей константой образования (или устойчивости):
Слайд 42
![Ме2+ + Y4‾ ↔ [MeY]2‾](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361227/slide-41.jpg)
Слайд 43

Устойчивость комплексов Ме с ЭДТА зависит от заряда иона Ме, электронной
конфигурации, и меняется в зависимости от рН среды. Наиболее устойчивые комплексы ЭДТА с многозарядными ионами р- и d-элементов могут образовываться в кислой среде.
Слайд 44

К ним относятся комплексы с Bi3+, Fe3+,Cr3+. Менее устойчивые комплексы с
ЭДТА образуют ионы s-элементов: Ba2+, Mg2+, Ca2+. Их определение комплексонометрическим титрованием проводят в щелочной среде.
Слайд 45

8.2.2
При визуальном способе установлении конечной точки применяют металлоиндикаторы, изменяющие окраску в
зависимости от концентрации иона металла. Обычно это органические соединения, которые с ионами титруемого металла образуют окрашенные комплексы.
Слайд 46

индикаторы, которые сами не имеют окраски, но образуют с ионами Ме
окрашенные комплексы
Комплексы Fe(III) с салициловой кислотой (с молярным соотношением 1:1) окрашены в красный цвет, с тайроном – в зеленый. Тиомочевинные комплексы с Bi (III) окрашены в желтый цвет.
Слайд 47

2) органические соединения, содержащие в своих молекулах хромофорные группы и образующие
с ионами Ме внутрикомплексные соединения, по цвету отличающиеся от самих индикаторов.
Эти индикаторы называются металлохромные.
Слайд 48

Рингбом предложил делить индикаторы на 3 группы:
а) индикаторы, содержащие азогруппу –N=N–
Hапример, эриохромовый черный Т (при рН 9-10 используется для определения Mg2+, Ba2+, Cd2+, Pb2+, Zn2+, Mn2+, Sr2+) и кислотный хромовый темно-синий (Mn2+, Mg2+, Zn2+, Pb2+, Ca2+)
Слайд 49

б) индикаторы, относящиеся к классу трифенилметановых красителей. Например, ксиленоловый оранжевый (при
рН 1,5-3: Bi3+, Fe3+; при рН 5-7: Cd2+, Co2+, Cu2+, Hg2+, Zn2+); пирокатехиновый фиолетовый ( при рН 2-4: Bi3+, Ti4+;
рН 5-6: Cu2+, Fe3+, Pb2+)
Слайд 50

в) прочие индикаторы – мурексид
(при рН 8-9: Co2+, Ca2+, Zn2+,
Ni2+), дитизон, ализарин
Слайд 51

К металлоиндикаторам предъявляется ряд требований:
1) должны в выбранной области рН образовывать
с ионами Ме достаточно устойчивые комплексы с соотношением Ме:Ind = 1:1
Слайд 52

Условные константы устойчивости комплексов MeInd должны быть меньше условных констант устойчивости
комплексов Ме с ЭДТА, т.е.
Слайд 53

Достаточно большие значения констант устойчивости комплексов MeInd позволяют использовать небольшие соотношения
концентраций индикатора и Ме
Слайд 54

2) комплекс иона Ме с Ind должен быть кинетически лабильным и
быстро разрушаться при добавлении ЭДТА. Считается, что в комплексонометрии можно применять металлоиндикаторы, для которых период полуобмена лигандами в комплексе MeInd
Слайд 55

3) изменение окраски раствора в конечной точке титровании должно быть контрастным
Согласно
учению о цвете, предельные цвета, т.е. исходные (окраска чистого МеInd) и конечные (окраска чистого Ind) должны быть по возможности дополнительными
Слайд 56

Чтобы достичь максимального цветового эффекта, используют смешанные индикаторы, т.е. к металлоиндикатору
добавляют индифферентный краситель, создающий цветовой фон, вследствие чего предельные окраски до и после конечной точки титрования становятся дополнительными.
Слайд 57

Для титрования ионов Ca2+ предложена смесь мурексида и нафтолового зеленого В:
переход окраски от оливково-зеленой через красновато-серую к чисто синей.
Слайд 58

Молярную долю любой формы индикатора вычисляют по уравнению:
Слайд 59

где С'Y – общая концентрация незакомплексованной ЭДТА, которая равна сумме
равновесных концентраций всех форм ЭДТА
Слайд 60

В большинстве случаев ионы металла и индикатора образуют лишь один комплекс
в соотношении 1:1, тогда
Слайд 61
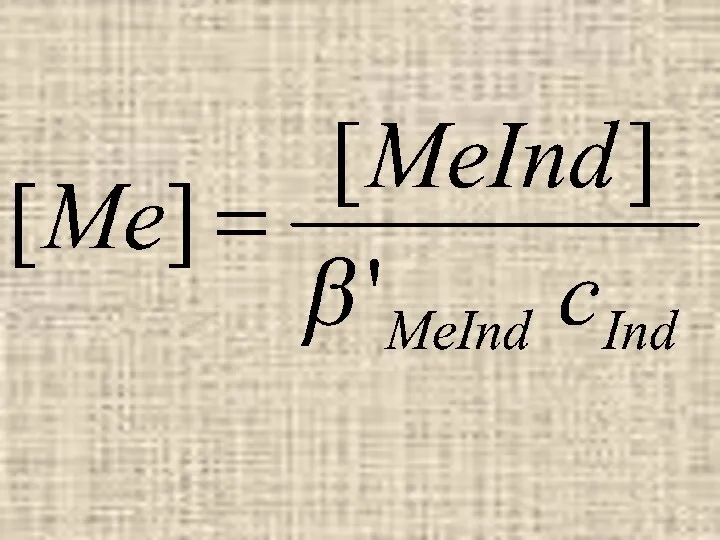
Слайд 62

Считают, что человеческий глаз ощущает переходный цвет в следующем интервале отношений
концентраций:
Слайд 63

8.3
В фармации комплексонометрическое титрование используют для определения препаратов Са: хлорида,
глюконата, лактата; препаратов Zn: оксида и сульфата;
сульфата магния, основного нитрата висмута и др.
Слайд 64

Применяют комплексонометрию при анализе воды для определения жесткости, а также при
анализе различных сплавов и минералов. Методами окислительно-восстановительного титрования в клинических и биохимических исследованиях определяют содержание ферментов каталазы, пероксидазы, аскорбиновой кислоты, сахара в крови, мочевой кислоты в моче, ионов Са2+ в сыворотке крови.
Слайд 65

Перманганатометрию и иодометрию используют для анализа ряда химических и лекарственных препаратов.
Перманганатометрия – один из лучших способов определения железа в различных объектах. Этим методом пользуются для определения общей окисляемости воды или почвы.








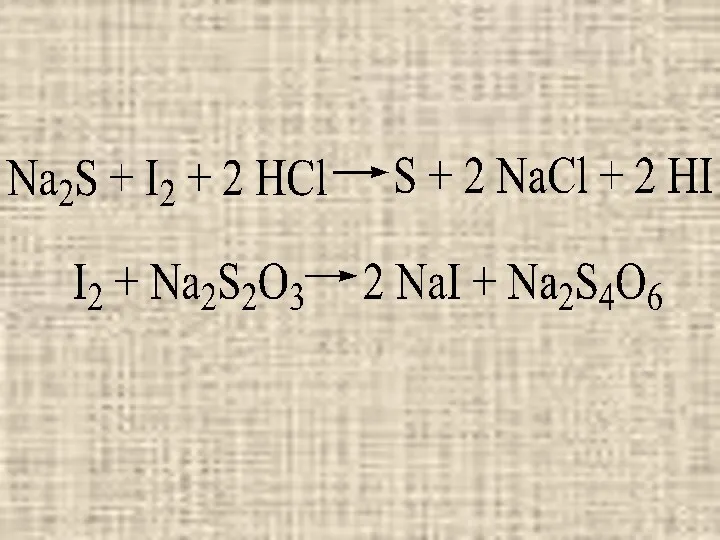

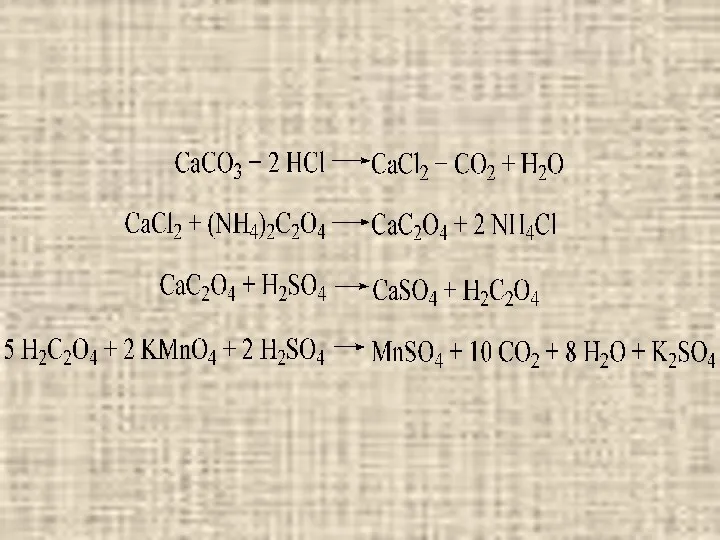

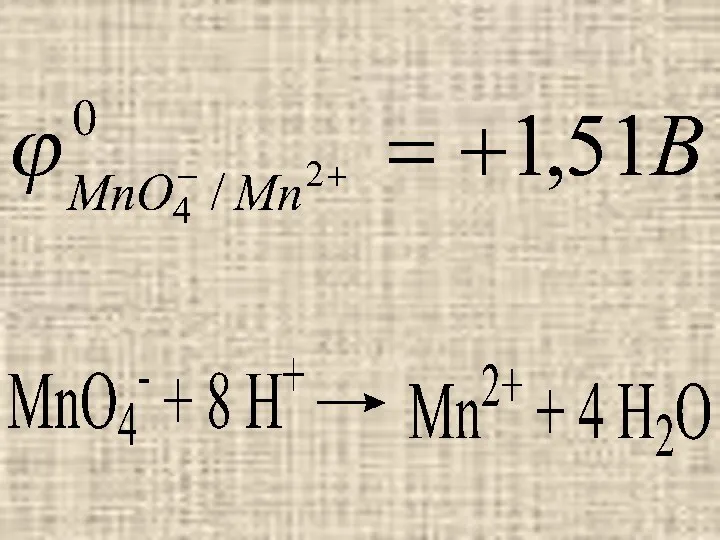
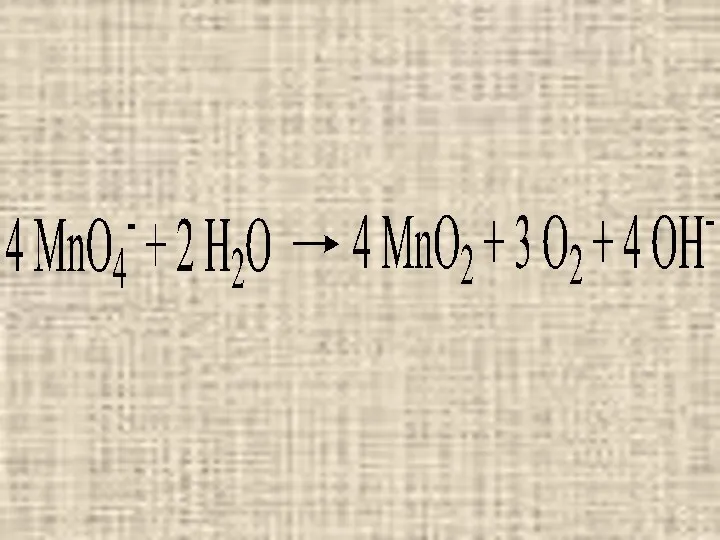
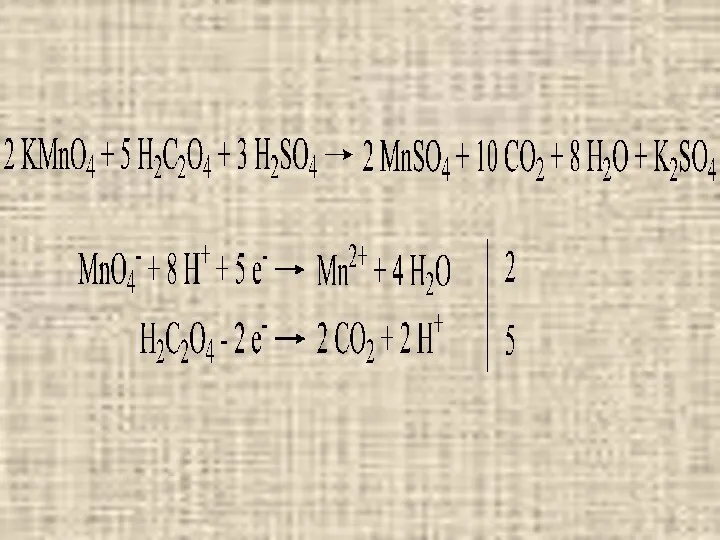


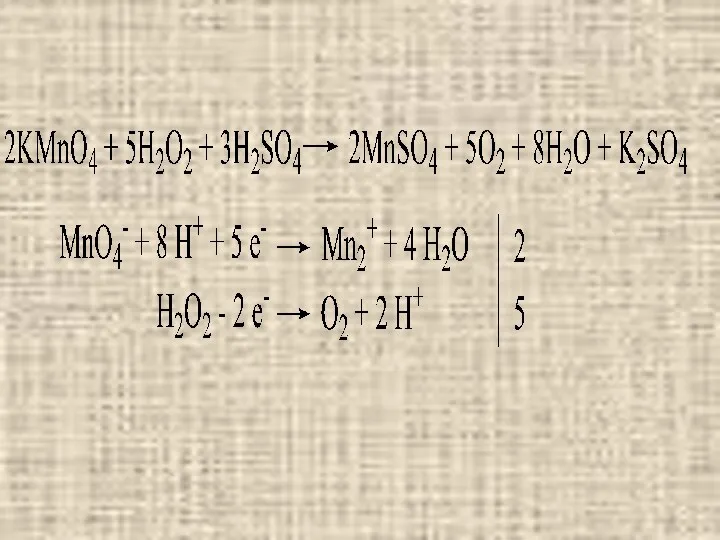


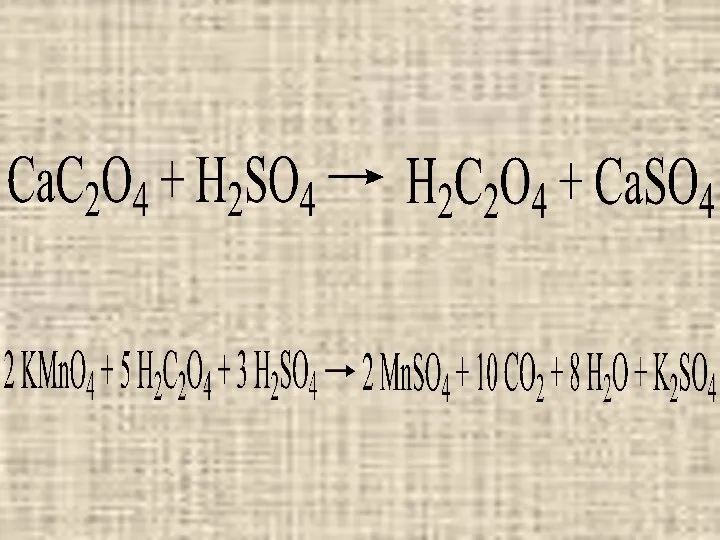

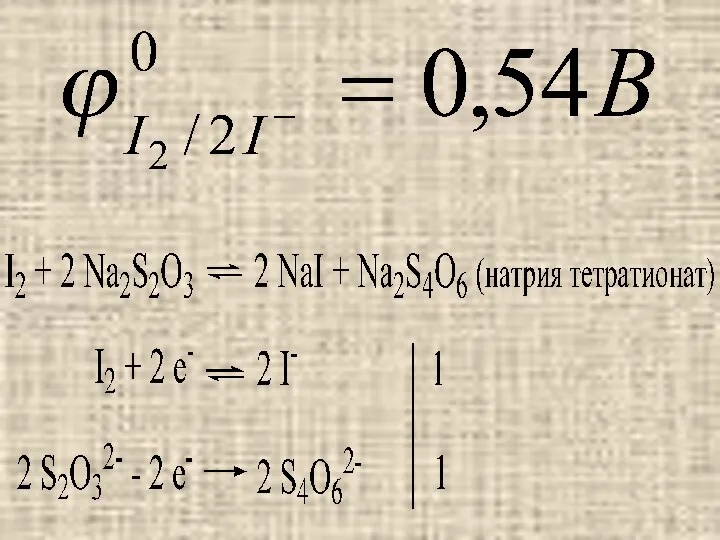




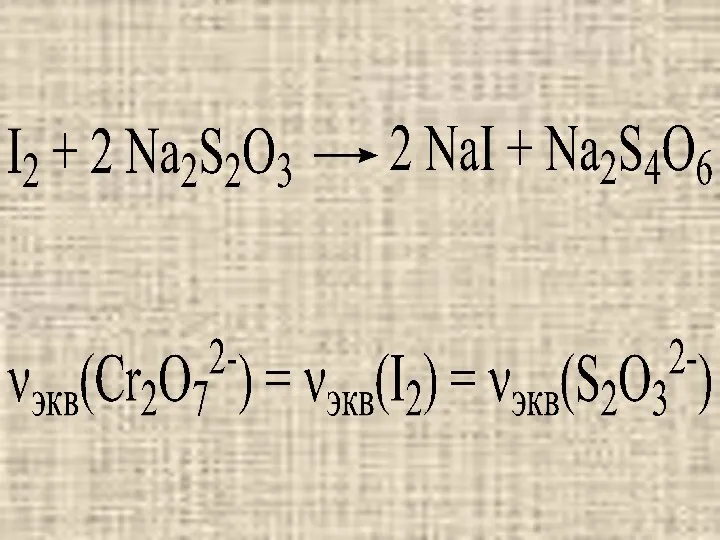





![Ме2+ + [Y]4‾ ↔ [MeY]2‾ С катионами Ме ЭДТА образует комплексные соединения в соотношении 1:1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361227/slide-34.jpg)






![Ме2+ + Y4‾ ↔ [MeY]2‾](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361227/slide-41.jpg)


















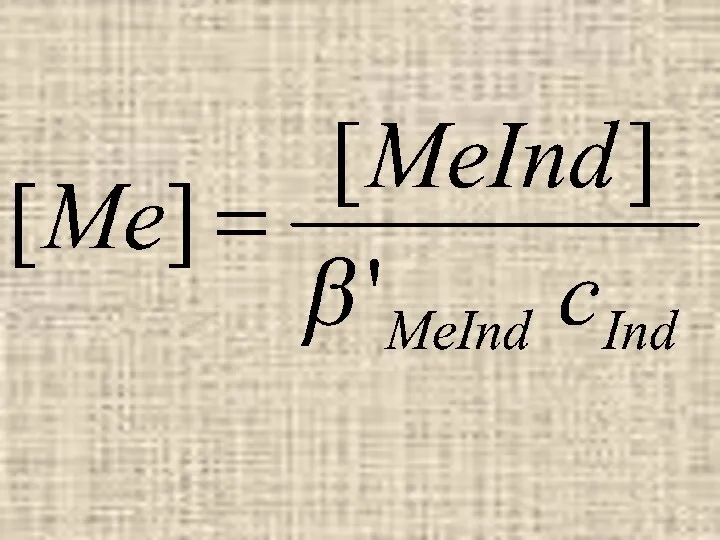




 Биофизические основы патологии клетки. Свободные радикалы и болезни человека
Биофизические основы патологии клетки. Свободные радикалы и болезни человека Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Простые вещества
Простые вещества Приборы радиационной и химической разведки
Приборы радиационной и химической разведки Carbohydrates (sugars)
Carbohydrates (sugars) Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Номенклатура органических соединений
Номенклатура органических соединений Основы химической термодинамики (лекция 6)
Основы химической термодинамики (лекция 6) алканы 170
алканы 170 Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины Ароматические углеводороды, строение, изомерия, номенклатура
Ароматические углеводороды, строение, изомерия, номенклатура Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Полисахаридтер – жоғары молекулалық көмірсулар
Полисахаридтер – жоғары молекулалық көмірсулар Массовая доля компонента вещества в смеси
Массовая доля компонента вещества в смеси Стекловолокно. Что такое стекловолокно?
Стекловолокно. Что такое стекловолокно? Геохимия ландшафтов
Геохимия ландшафтов Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Соли серной кислоты
Соли серной кислоты Летучие яды. Токсичные газы
Летучие яды. Токсичные газы Глицерин. Свойства и применение
Глицерин. Свойства и применение Свойства смесей ПАВ
Свойства смесей ПАВ Хлор (лат. Chlorum, Cl)
Хлор (лат. Chlorum, Cl) Коррозия и защита полимерных строительных материалов
Коррозия и защита полимерных строительных материалов Химия нефти и газа. Свойства нефти и нефтепродуктов. Свойства газов
Химия нефти и газа. Свойства нефти и нефтепродуктов. Свойства газов Жидкие кристаллы
Жидкие кристаллы Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Век пластмасс
Век пластмасс