Содержание
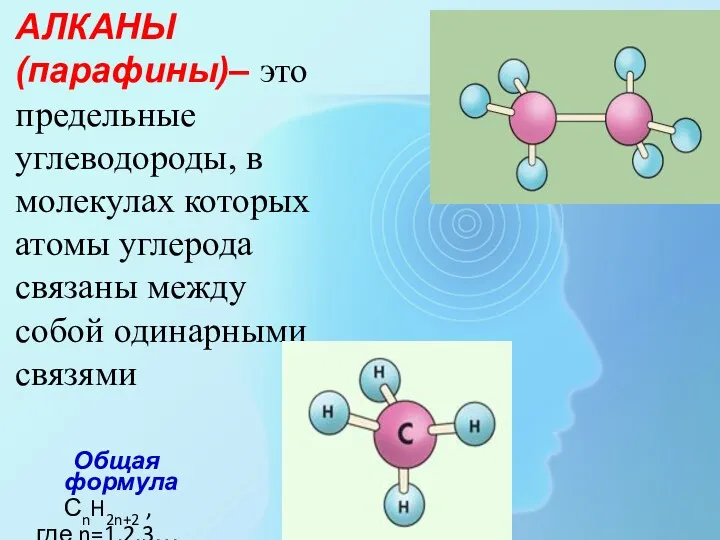
- 2. АЛКАНЫ (парафины)– это предельные углеводороды, в молекулах которых атомы углерода связаны между собой одинарными связями Общая
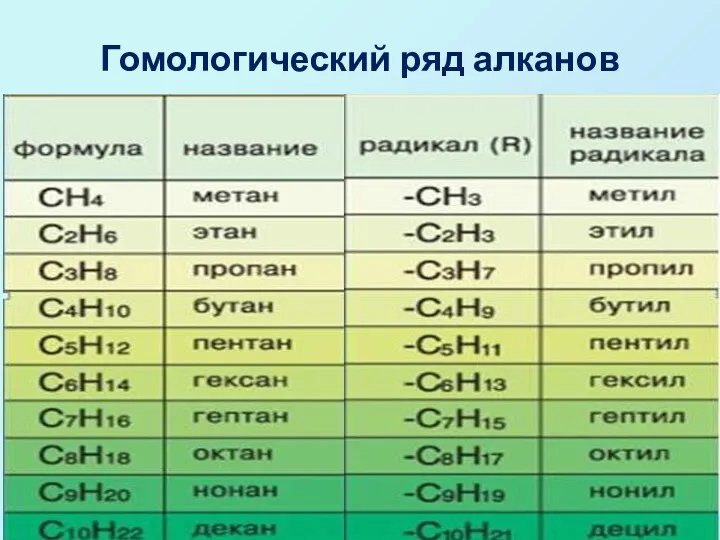
- 3. Гомологический ряд алканов
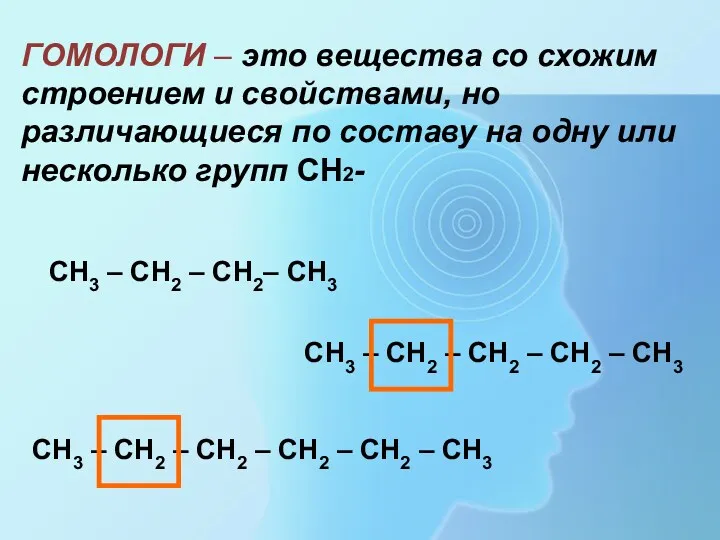
- 4. ГОМОЛОГИ – это вещества со схожим строением и свойствами, но различающиеся по составу на одну или
- 5. ИЗОМЕРЫ – вещества, имеющие одинаковый состав молекул, но различное химическое строение и обладающие поэтому разными свойствами
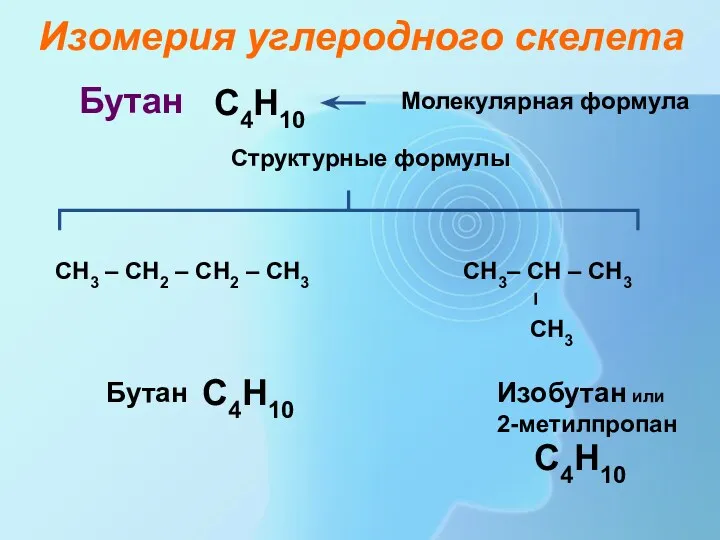
- 6. С4Н10 СН3 – СН2 – СН2 – СН3 Молекулярная формула Структурные формулы Бутан Бутан Изобутан или
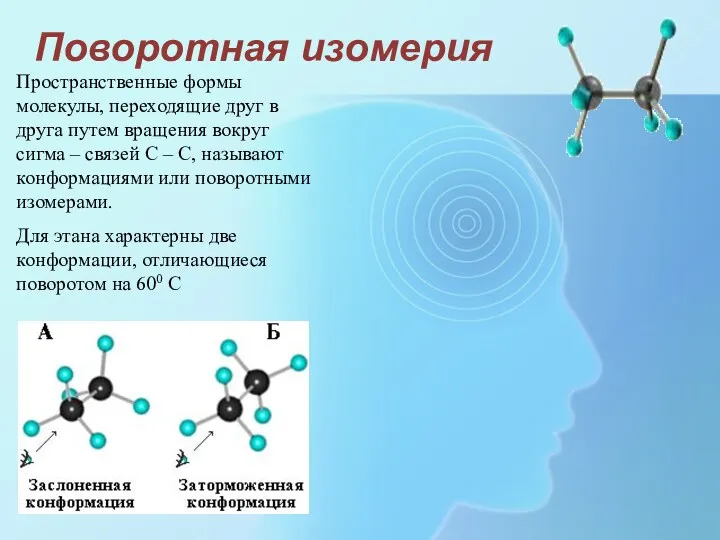
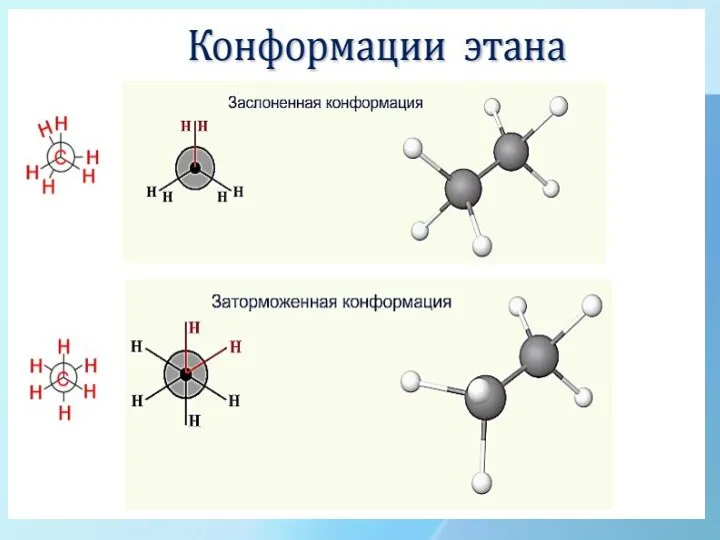
- 7. Поворотная изомерия Пространственные формы молекулы, переходящие друг в друга путем вращения вокруг сигма – связей С
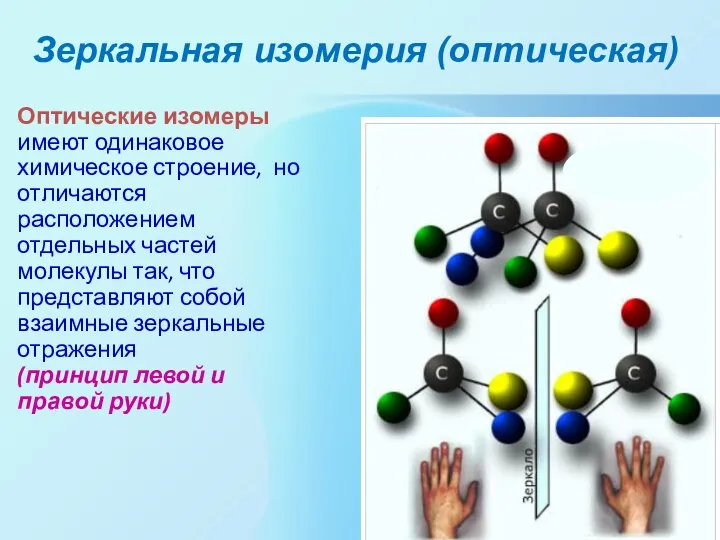
- 9. Зеркальная изомерия (оптическая) Оптические изомеры имеют одинаковое химическое строение, но отличаются расположением отдельных частей молекулы так,
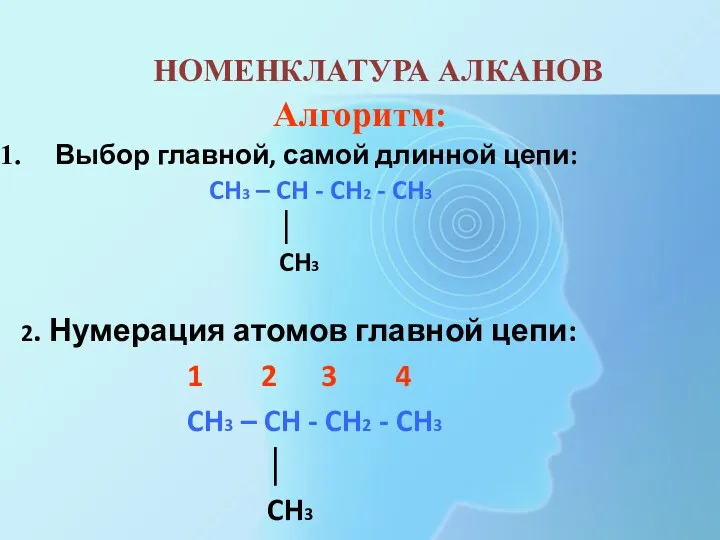
- 10. НОМЕНКЛАТУРА АЛКАНОВ Алгоритм: Выбор главной, самой длинной цепи: CH3 – CH - CH2 - CH3 │
- 11. 3. Формирование названия: 1 2 3 4 CH3 – CH - CH2 - CH3 │ CH3
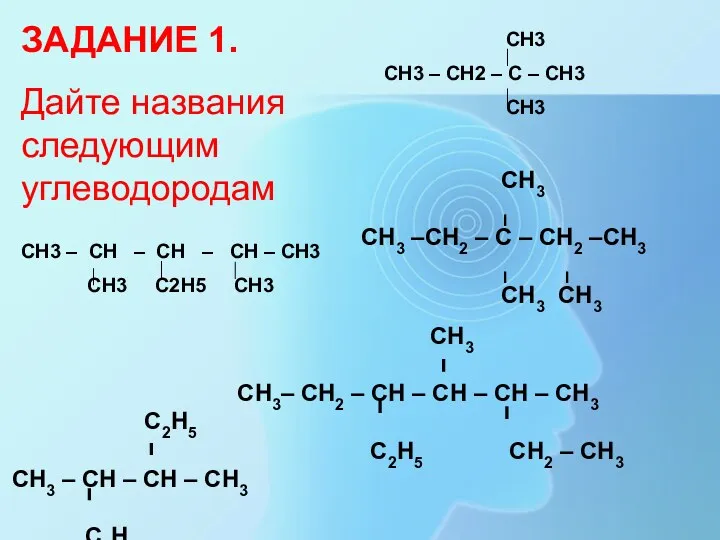
- 12. ЗАДАНИЕ 1. Дайте названия следующим углеводородам СН3 СН3 – СН2 – С – СН3 СН3 СН3
- 13. ЗАДАНИЕ 2. Составьте структурные формулы следующих веществ: 2,3 – диметилпентан; 3,3,4 – триметилгексан; 2,5-диметилгексан; 3,3,5,5-тетраметилоктан; 2,2-диметил-4-хлорпентан
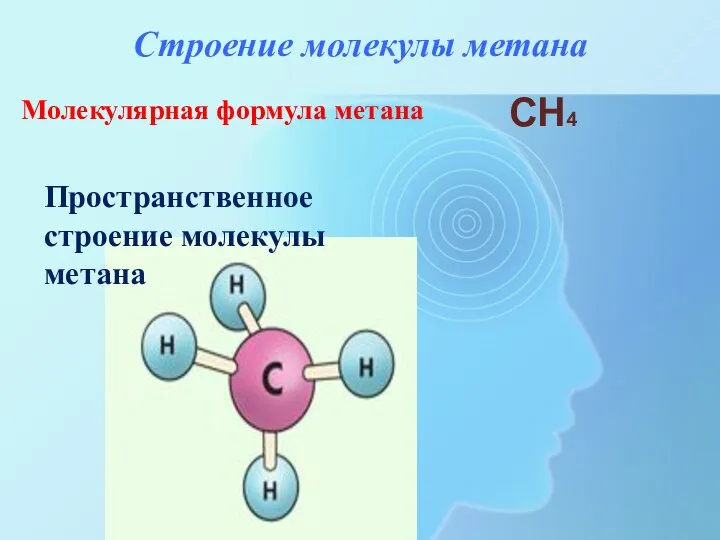
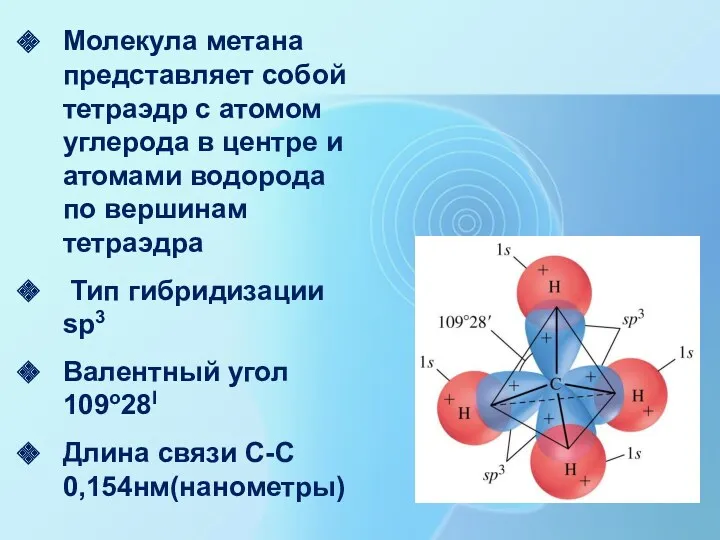
- 14. Строение молекулы метана Молекулярная формула метана CH4 Пространственное строение молекулы метана
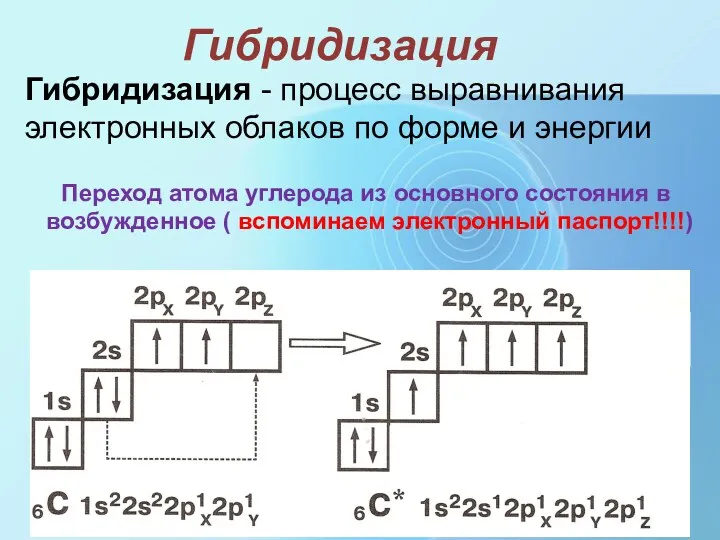
- 15. Гибридизация Переход атома углерода из основного состояния в возбужденное ( вспоминаем электронный паспорт!!!!) Гибридизация - процесс
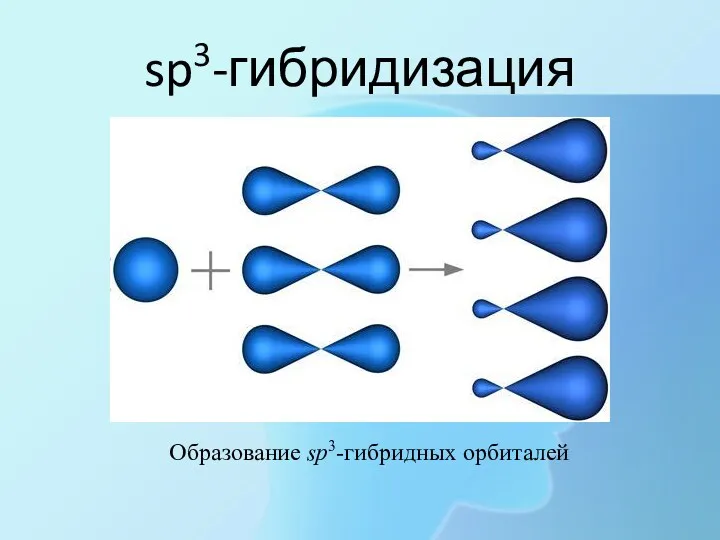
- 16. sp3-гибридизация Образование sp3-гибридных орбиталей
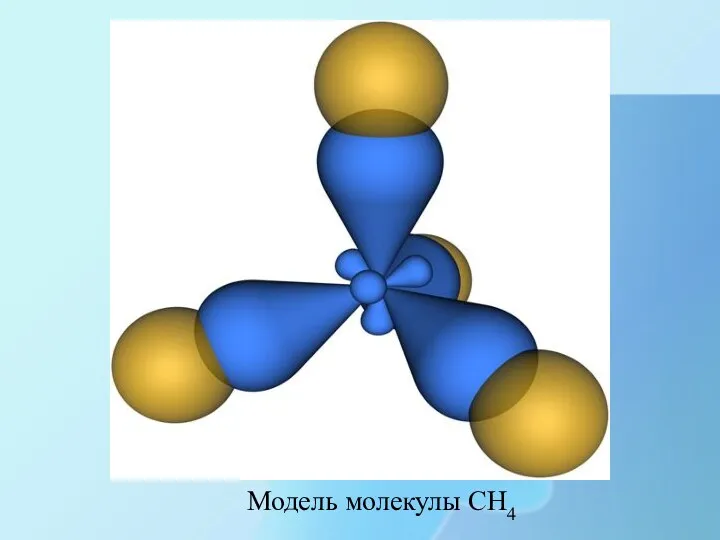
- 17. Модель молекулы CH4
- 18. Молекула метана представляет собой тетраэдр с атомом углерода в центре и атомами водорода по вершинам тетраэдра
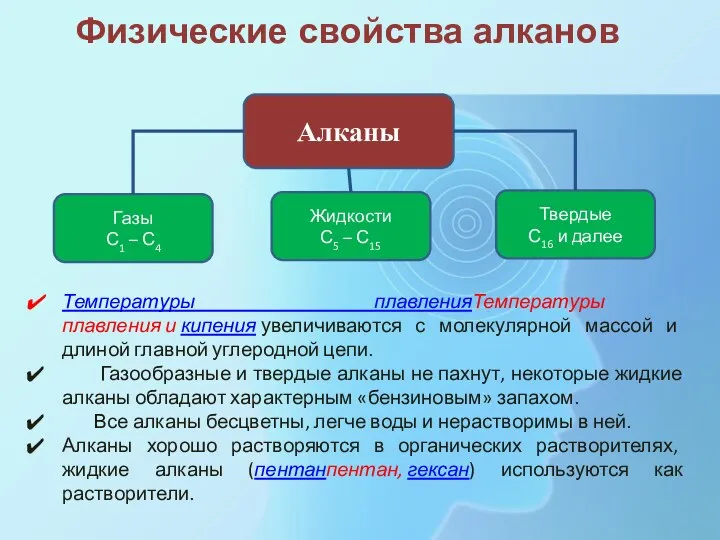
- 19. Алканы Жидкости С5 – С15 Газы С1 – С4 Твердые С16 и далее Физические свойства алканов
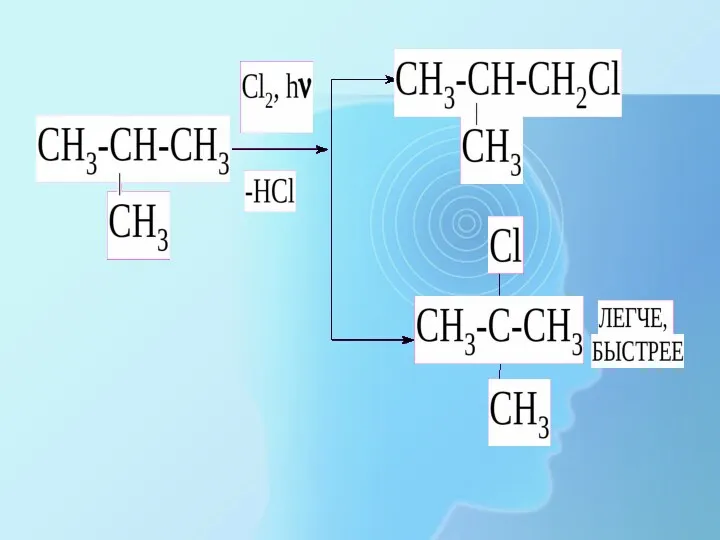
- 20. 1. Реакции замещения Протекают по механизму радикального замещения. а) с галогенами (с Cl2 – на свету
- 24. в) сульфирование (взаимодействие с концентрированной серной кислотой) 2. Реакции окисления Горение (полное окисление): CH4 + 2O2
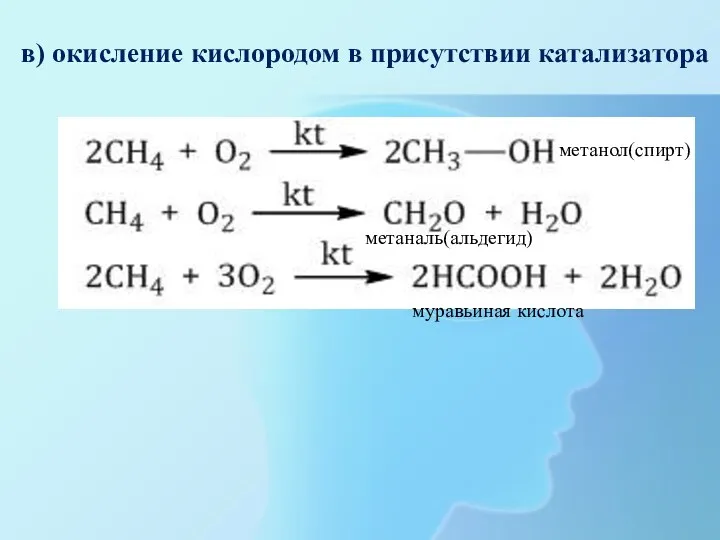
- 25. в) окисление кислородом в присутствии катализатора метанол(спирт) метаналь(альдегид) муравьиная кислота
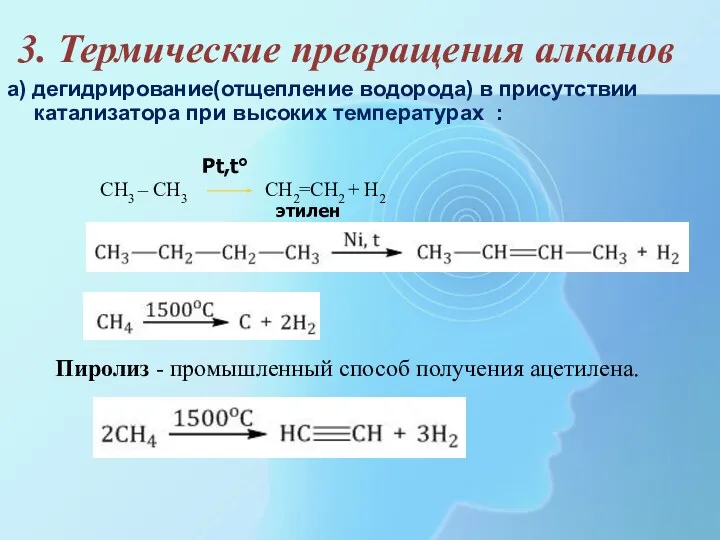
- 26. 3. Термические превращения алканов а) дегидрирование(отщепление водорода) в присутствии катализатора при высоких температурах : CH3 –
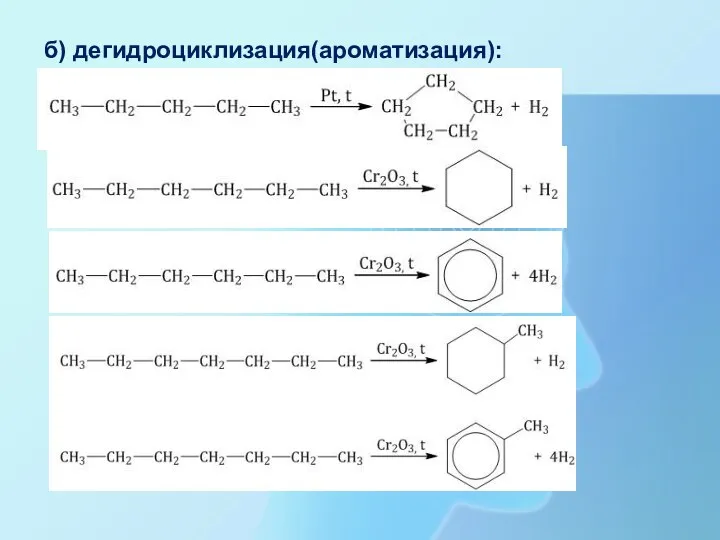
- 27. б) дегидроциклизация(ароматизация):
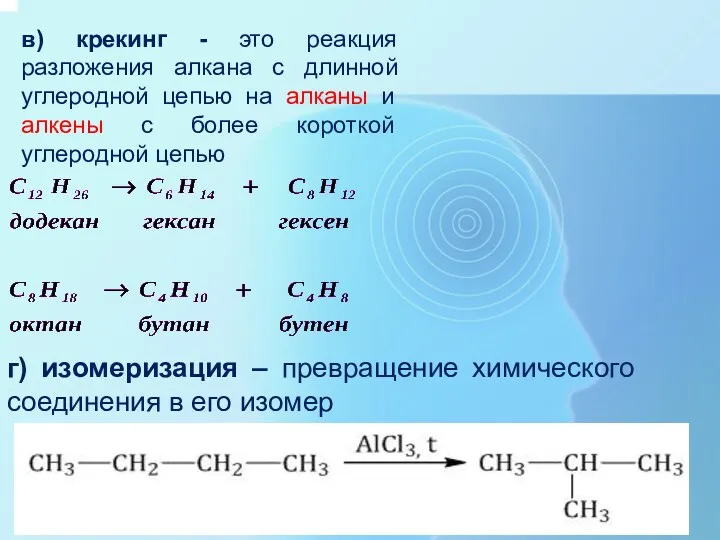
- 28. в) крекинг - это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с
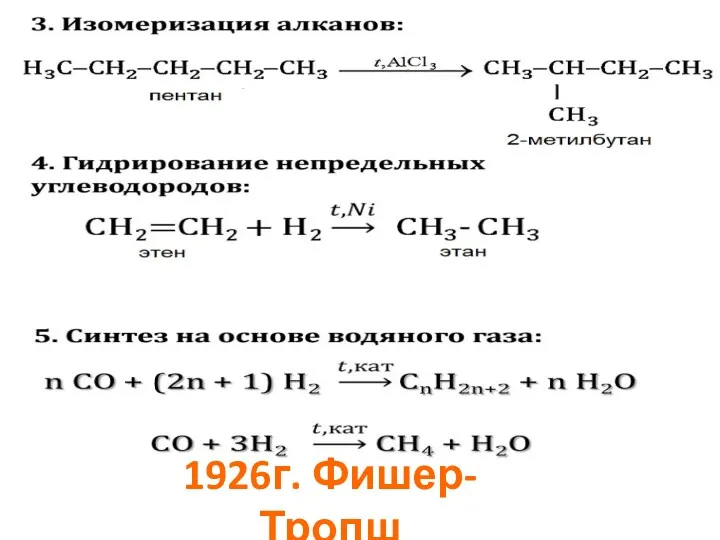
- 29. Способы получения
- 30. 1926г. Фишер-Тропш
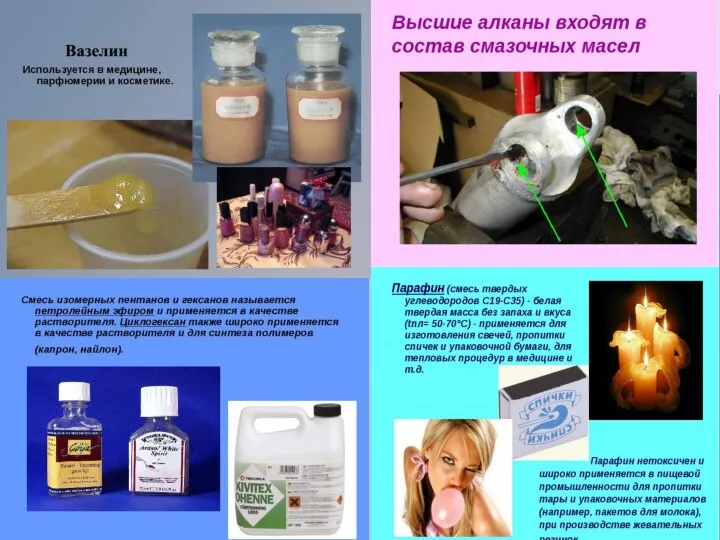
- 34. Применение алканов
- 39. Домашняя работа Задание 1. Назовите вещества
- 41. Скачать презентацию
















 Химические свойства алканов
Химические свойства алканов Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Галогены
Галогены Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Стратегия химической промышленности
Стратегия химической промышленности Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Степень окисления
Степень окисления Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Альдегиды и кетоны
Альдегиды и кетоны Кислород и озон
Кислород и озон Типы химических реакций. Опыты
Типы химических реакций. Опыты Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы Реакции нейтрализации
Реакции нейтрализации Камень чароит
Камень чароит Теория строения органических веществ А.М. Бутлерова
Теория строения органических веществ А.М. Бутлерова Азотсодержащие органические соединения
Азотсодержащие органические соединения Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Газовые смеси
Газовые смеси Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Теория электролитической диссоциации
Теория электролитической диссоциации Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Высокомолекулярные вещества полимеры
Высокомолекулярные вещества полимеры Химические свойства толуола
Химические свойства толуола Алканы. Способы получения алканов. Химические свойства алканов
Алканы. Способы получения алканов. Химические свойства алканов Химиялық элемент алюминий
Химиялық элемент алюминий