Слайд 2

Цель урока:
1.Провести опыты
2.Провести наблюдения
3.Объяснить опыты с позиции атомно – молекулярного учения
4.Дать классификацию химических реакций по составу и количеству исходных веществ и продуктов реакции
Слайд 3

Вопросы:
1.Что такое химическая реакция?
2.Что происходит с точки зрения атомно- молекулярного учения
с веществами в процессе
химической реакции?
3.Какие признаки химических реакций мы можем
наблюдать?
4.Какие могут быть условия проведения
химических реакций?
5.Какой закон должен выполняться при
проведении химических реакций?
6.При помощи каких действий мы можем записать химическую реакцию верно?
Слайд 4

Опыты
Горение серы
Дым без огня
Слайд 5

Вопросы
S+O2=SO2 А+В=АВ
NH3+HCL=NH4CL АВ+СД=АВСД
Какие по составу вещества вступили в химическую реакцию?
Какие по
составу вещества образовались в процессе реакции?
Что произошло с веществами в процессе химической реакции точки зрения атомно - молекулярного учения?
Как мы можем назвать этот тип химической реакции?
Нужны ли в этих реакциях коэффициенты?
Слайд 6

Вывод
АВ+СД=АВСД
А+В=АВ
Реакции соединения:
из двух или нескольких веществ получается одно,
более сложное вещество
Слайд 7

Опыты
Разложение малахита
Разложение перекиси водорода
Слайд 8

Вопросы
Cu2CH2O5 = CuO + H2O + CO2
Н2О2= Н2О+О2
Какие по составу вещества вступили в химическую реакцию?
Какие по составу вещества образовались в процессе реакции?
Что произошло с веществами в процессе химической реакции точки зрения атомно - молекулярного учения?
Как мы можем назвать этот тип химической реакции?
Нужны ли в этих реакциях коэффициенты?
Слайд 9

Вывод
АВ = А + В Cu2CH2O5 = CuO +
H2O + CO2 ↑ АВС=АВ+С Н2О2= Н2О+О2
Реакции разложения
- из одного сложного вещества образуются два или
несколько простых или менее сложных
веществ
Слайд 10

Опыты
Взаимодействие железа(скрепка)
с раствором хлорида меди(11)
Взаимодействие цинка с раствором
соляной кислоты
Слайд 11

Вопросы
АВ + С = СВ
CuCl2 + Fe =
FeCl2 + Cu
Zn + HCl = ZnCl2 + H2 ↑
Какие по составу вещества вступили в химическую реакцию?
Какие по составу вещества образовались в процессе реакции?
Что произошло с веществами в процессе химической реакции точки зрения атомно - молекулярного учения?
Как мы можем назвать этот тип химической реакции?
Нужны ли в этих реакциях коэффициенты?
Слайд 12

Вывод
АВ + С = СВ
CuCl2 + Fe =
FeCl2 + Cu
Zn + 2HCl = ZnCl2 + H2 ↑
Реакции замещения:
взаимодействуют одно простое и одно сложное вещества, получаются
новое простое и новое сложное вещество
Слайд 13

Опыты
Взаимодействие растворов хлорида железа(111) и гидроксида натрия
Взаимодействие растворов сульфата меди(11) и
гидроксида натрия
Слайд 14

Вопросы
CuSO4 + 2NaOH =Na2SO4 + Cu(OH)2↓
FeCl3 + 3 NaOH
= 3NaCl + Fe(OH)3↓
Какие по составу вещества вступили в химическую реакцию?
Какие по составу вещества образовались в процессе реакции?
Что произошло с веществами в процессе химической реакции точки зрения атомно - молекулярного учения?
Как мы можем назвать этот тип химической реакции?
Нужны ли в этих реакциях коэффициенты?
Слайд 15

Вывод
CuSO4 + 2NaOH =Na2SO4 + Cu(OH)2↓
FeCl3 + 3 NaOH = 3NaCl
+ Fe(OH)3↓
АВ + СД = АД + ВС
Реакции обмена:
взаимодействуют два сложных вещества
и обмениваются своими
составными частями
Слайд 16

Задание:
Определить тип химической реакции
CoSO4 + 2 NaOH = Co(OH)2 +
Na2SO4
4 P + 5 O2 = 2 P2O5
Ni(OH)2 = NiO + H2O
Zn + H2SO4 = ZnSO4 + H2
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
2 S + 3 O2 = 2 SO3
H2SO3 = SO2 + H2O
Fe + 2 HCl = FeCl2 + H2
2 Al + 3 Br2 = 2 AlBr3
Слайд 17

Проверка:
CoSO4 + 2 NaOH = Co(OH)2 + Na2SO4 реакция обмена
4
P + 5 O2 = 2 P2O5 реакция соединения
Ni(OH)2 = NiO + H2O реакция разложения
Zn + H2SO4 = ZnSO4 + H2 реакция соединения
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4 реакция обмена
2 S + 3 O2 = 2 SO3 реакция соединения
H2SO3 = SO2 + H2O реакция разложения
Fe + 2 HCl = FeCl2 + H2 реакция замещения
2 Al + 3 Br2 = 2 AlBr3 - реакция соединения
Слайд 18

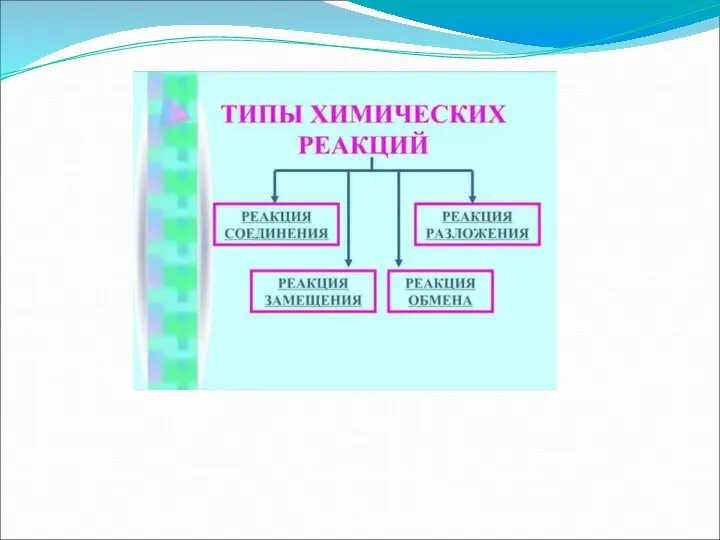
Итоги урока
В химии существует несколько классификаций реакций, за основу классификации берется
какой-либо признак. Все химические реакции можно классифицировать в зависимости от числа и состава исходных и образующихся веществ. С этой точки
зрения принято деление реакций на 4 типа:
Реакции соединения
Реакции разложения
Реакции замещения
Реакции обмена
Слайд 19


















 Реакции элиминирование галогеналканов
Реакции элиминирование галогеналканов Одноатомные и многоатомные спирты
Одноатомные и многоатомные спирты Практическая работа по разделению смесей
Практическая работа по разделению смесей Химия пәні. Заттар және олардың қасиеттері
Химия пәні. Заттар және олардың қасиеттері Жиры и масла
Жиры и масла Непредельные углеводороды: алкены, олефины
Непредельные углеводороды: алкены, олефины Одноосновные ненасыщенные кислоты
Одноосновные ненасыщенные кислоты Электрохимические методы анализа
Электрохимические методы анализа Химическая связь
Химическая связь Введение в кристаллографию
Введение в кристаллографию Фосфор и его соединения
Фосфор и его соединения Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Кислород
Кислород Растворы. Часть 2
Растворы. Часть 2 Общие способы получения металлов
Общие способы получения металлов Свойства и биологическая роль карбонильных соединений
Свойства и биологическая роль карбонильных соединений Основные сведения о строении атома
Основные сведения о строении атома Фенол қосылыстары
Фенол қосылыстары Загальні способи добування солей. Класифікація неорганічних речовин
Загальні способи добування солей. Класифікація неорганічних речовин Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно
Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно Ядерное топливо
Ядерное топливо Альдегиды и кетоны
Альдегиды и кетоны Особенности строения твердых тел
Особенности строения твердых тел Циклические углеводороды
Циклические углеводороды D-элементы VII-В группы. Марганец
D-элементы VII-В группы. Марганец Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы