Содержание
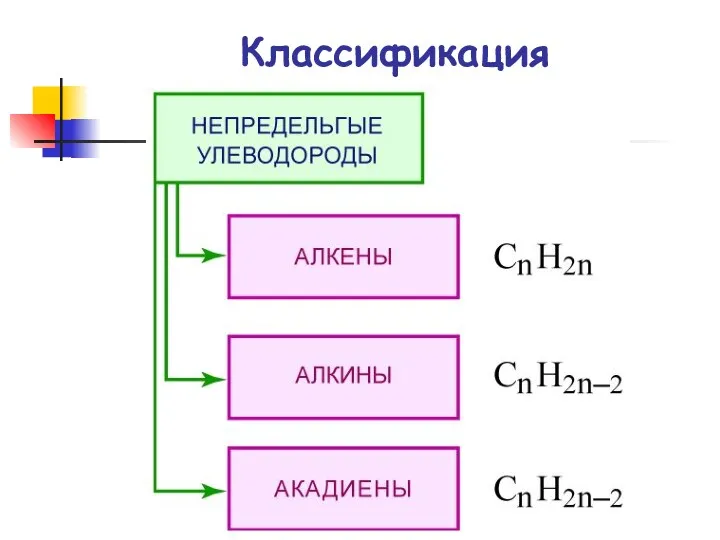
- 2. Классификация
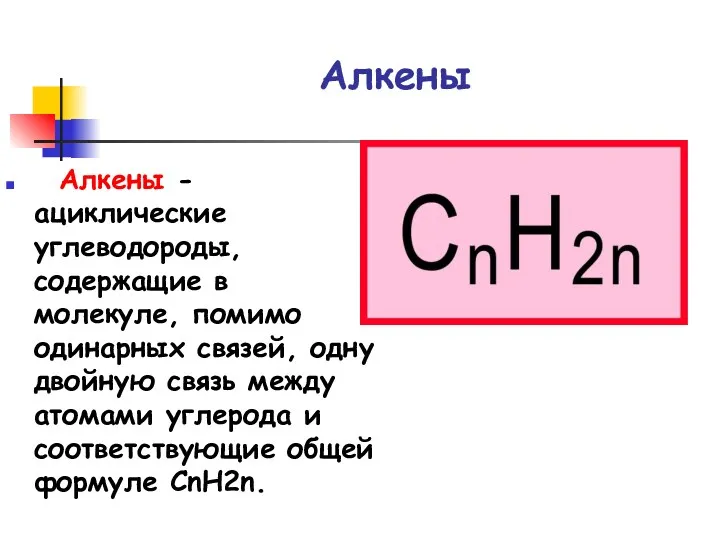
- 3. Алкены Алкены - ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами
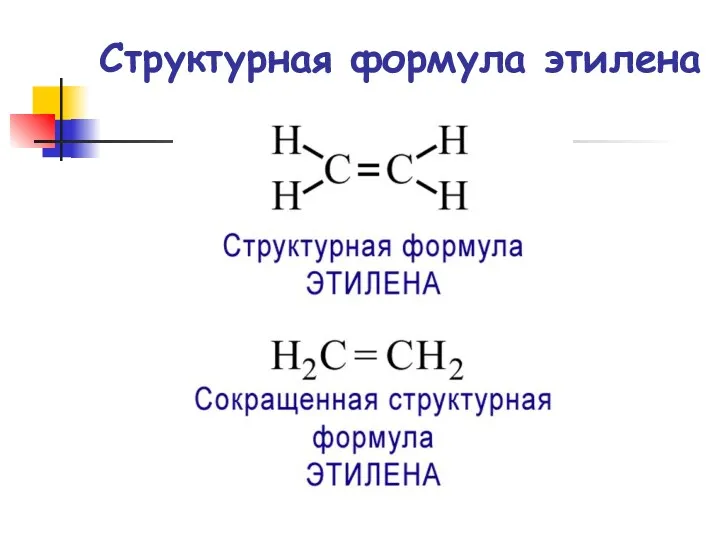
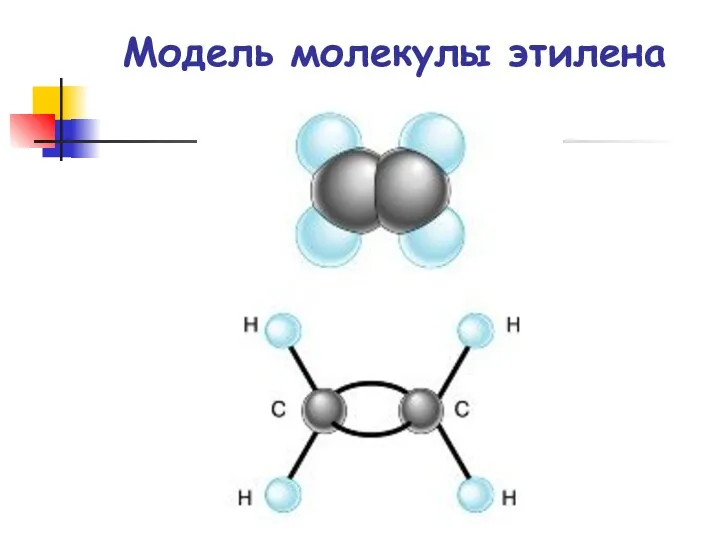
- 4. Структурная формула этилена
- 5. Изомерия и номенклатура
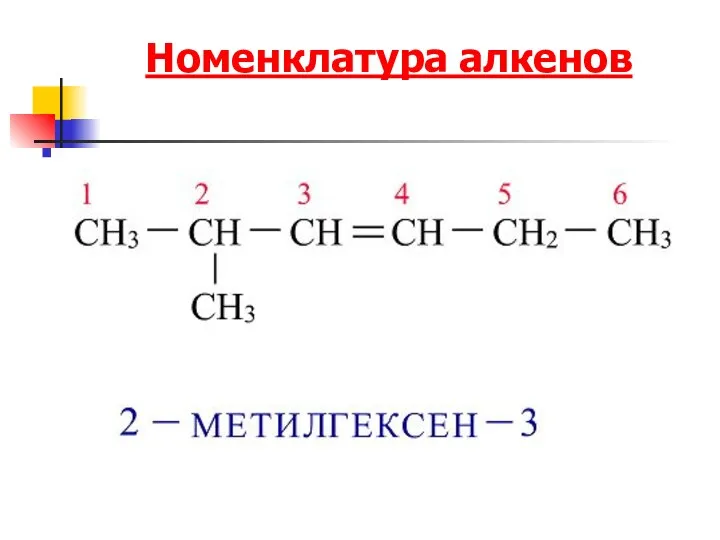
- 6. Номенклатура алкенов
- 7. Алкены. Номенклатура 1) в алкенах с неразветвленной цепью нумерацию производят с того конца, ближе к которому
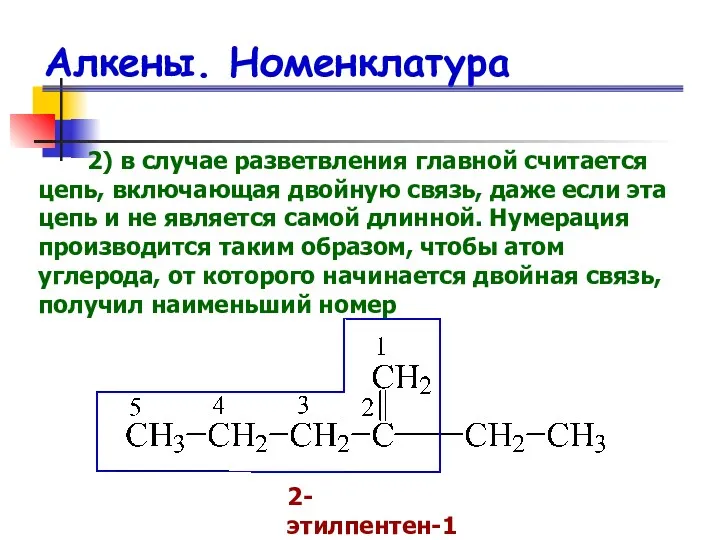
- 8. Алкены. Номенклатура 2) в случае разветвления главной считается цепь, включающая двойную связь, даже если эта цепь
- 9. Алкены. Номенклатура 3) Углеводородные заместители обозначаются префиксом. Положение их указывается цифрой, соответствующей номеру того атома углерода,
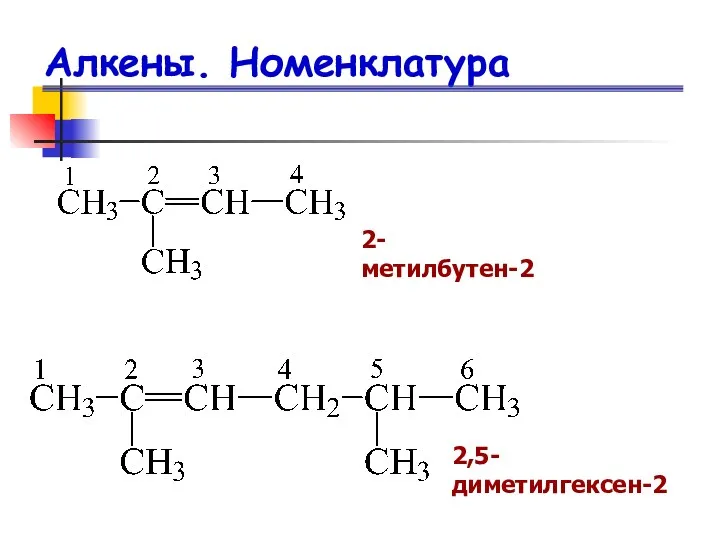
- 10. Алкены. Номенклатура 2-метилбутен-2 2,5-диметилгексен-2
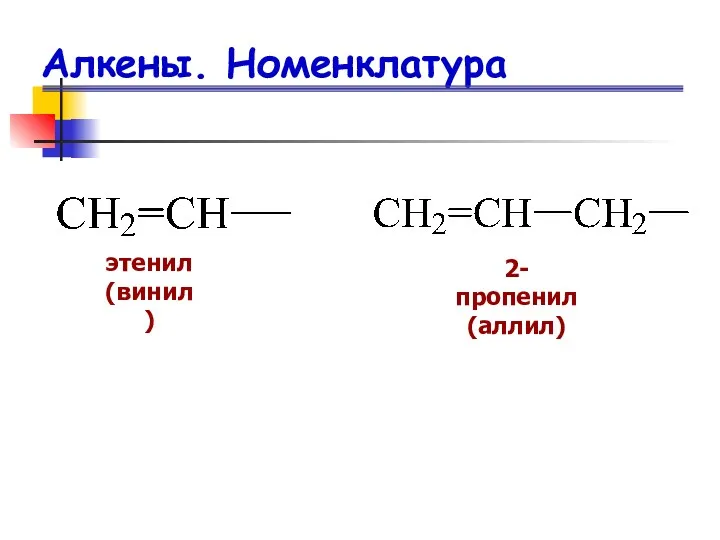
- 11. Алкены. Номенклатура этенил (винил) 2-пропенил (аллил)
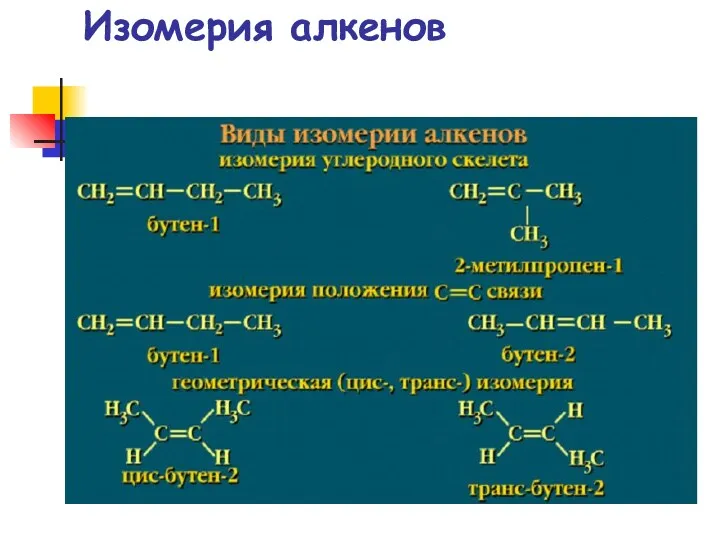
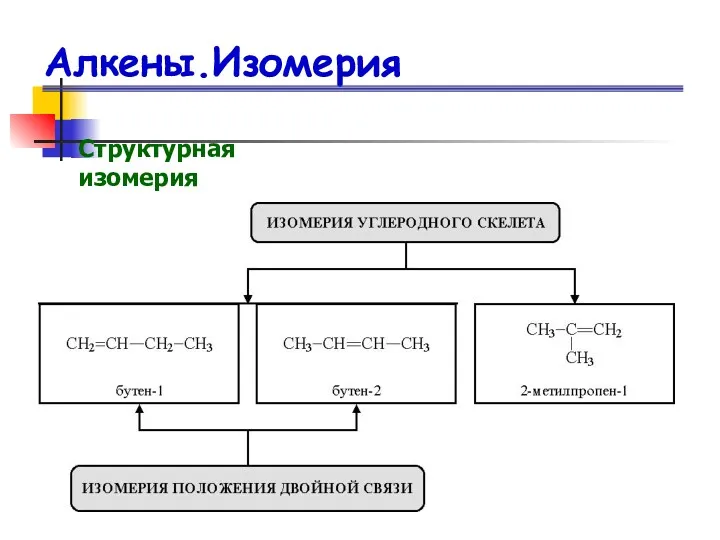
- 12. Изомерия алкенов
- 13. Алкены.Изомерия Структурная изомерия
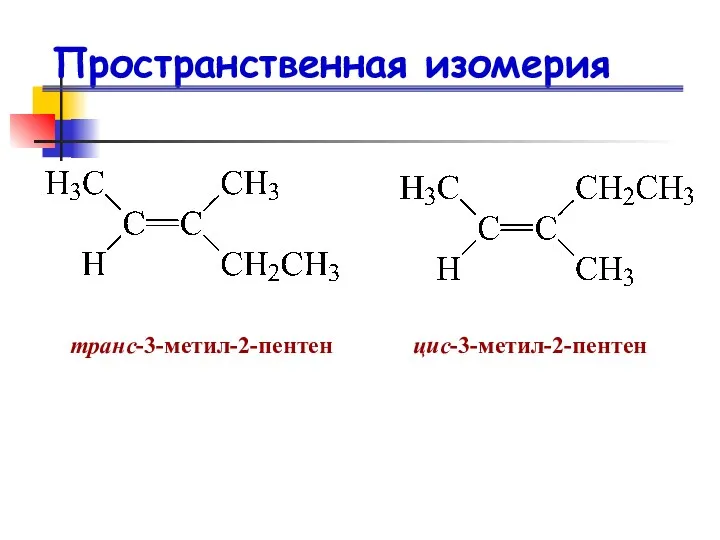
- 14. Пространственная изомерия
- 15. Пространственная изомерия
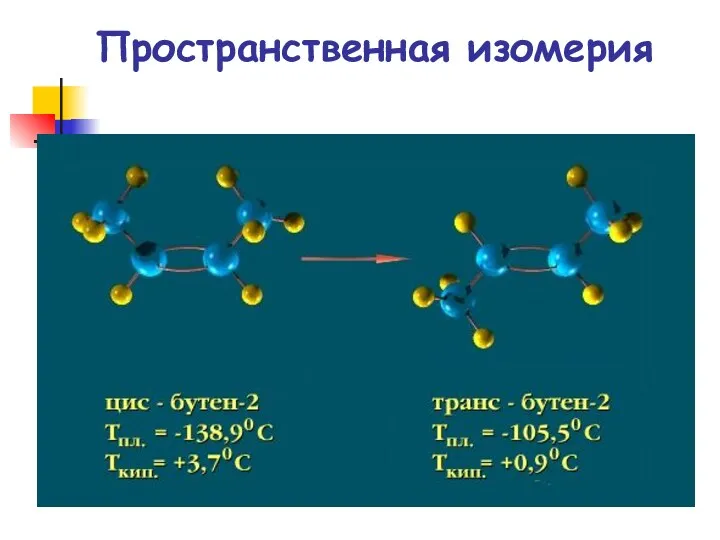
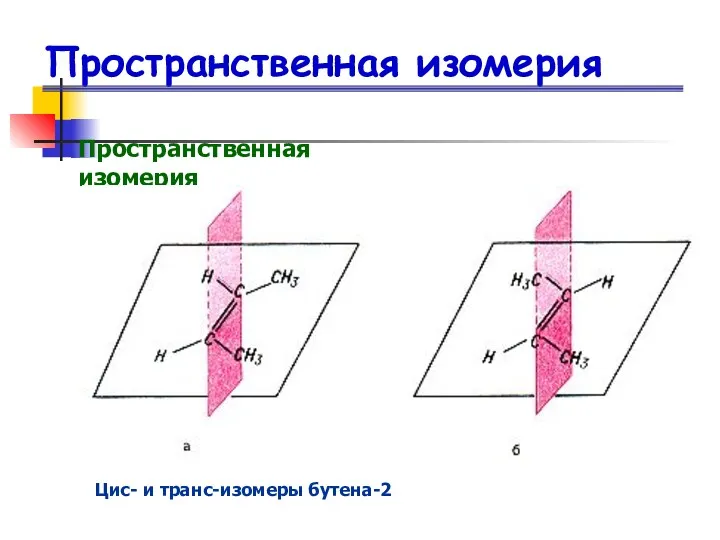
- 16. Пространственная изомерия Пространственная изомерия Цис- и транс-изомеры бутена-2
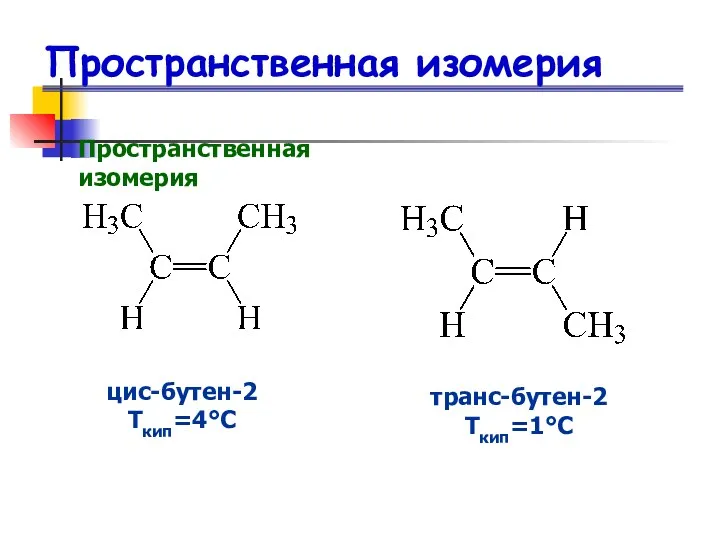
- 17. Пространственная изомерия Пространственная изомерия цис-бутен-2 Ткип=4°С транс-бутен-2 Ткип=1°С
- 18. Пространственная изомерия
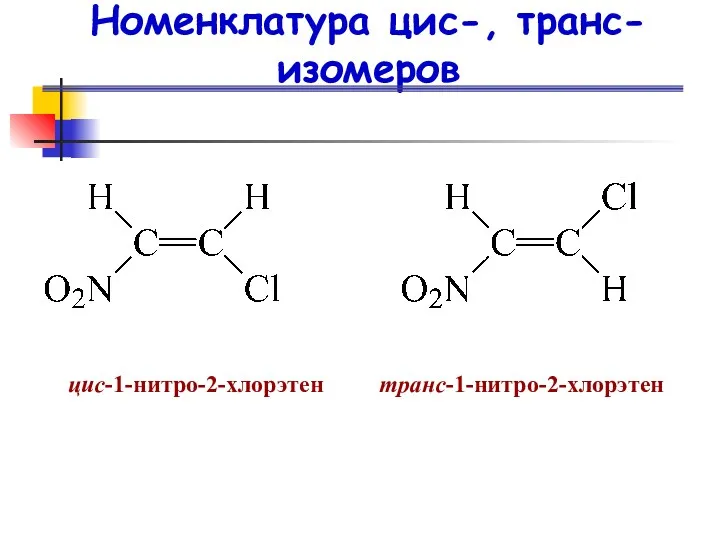
- 19. Номенклатура цис-, транс-изомеров
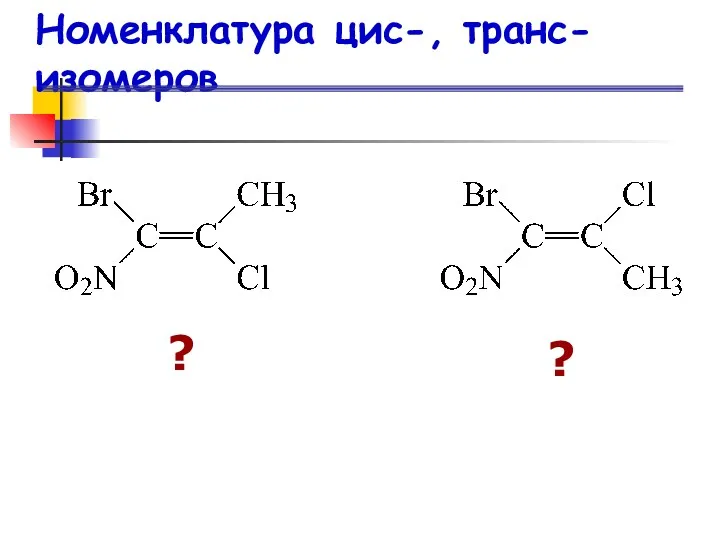
- 20. Номенклатура цис-, транс-изомеров ? ?
- 21. Номенклатура цис-, транс-изомеров Система Кана–Ингольда–Прелога Прелог Владимир (23.07.1906–07.01.1998) (Швейцария) Ингольд Кристофер (28.10.1893–8.10.1970) (Великобритания) Роберт Сидни Кан
- 22. Номенклатура цис-, транс-изомеров 1. Используя систему Кана–Ингольда–Прелога, определяют сначала относительное старшинство заместителей, связанных с двойной связью,
- 23. Номенклатура цис-, транс-изомеров (Е)-2-бутен (Z)-2-бутен
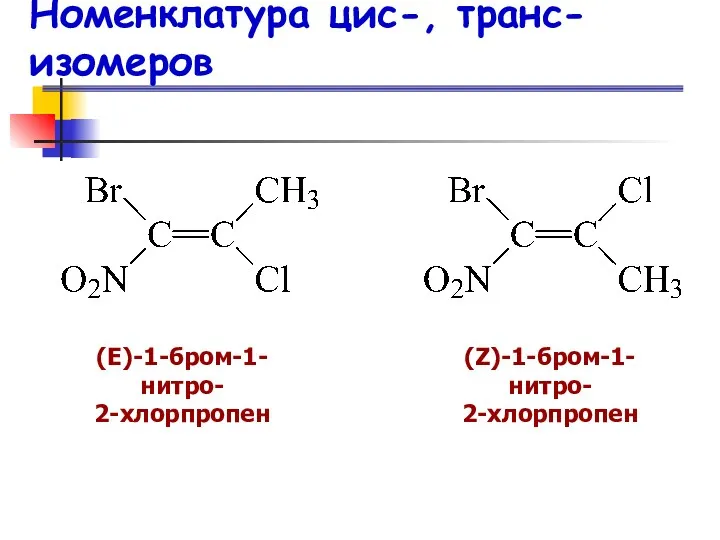
- 24. Номенклатура цис-, транс-изомеров (Е)-1-бром-1-нитро- 2-хлорпропен (Z)-1-бром-1-нитро- 2-хлорпропен
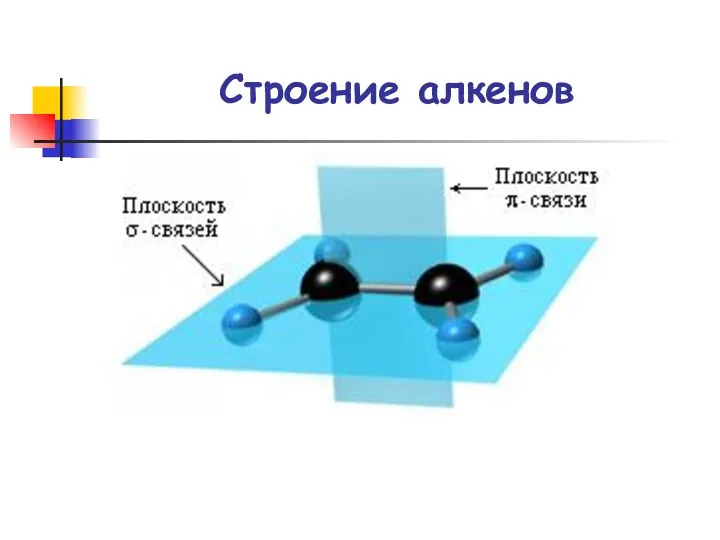
- 25. Строение алкенов
- 26. Модель молекулы этилена
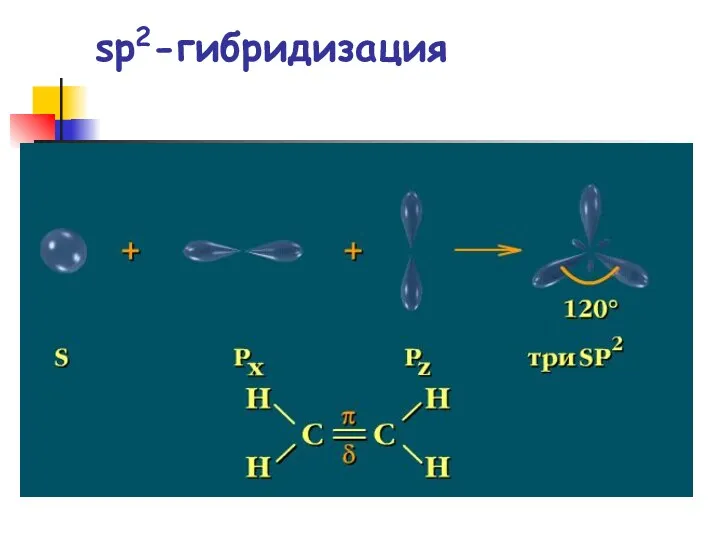
- 27. sp2-гибридизация
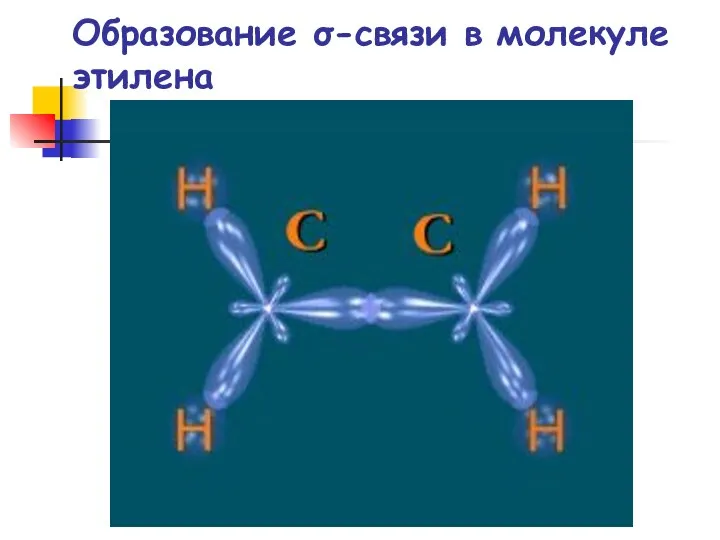
- 28. Образование σ-связи в молекуле этилена
- 29. Образование π-связи
- 30. Строение алкенов
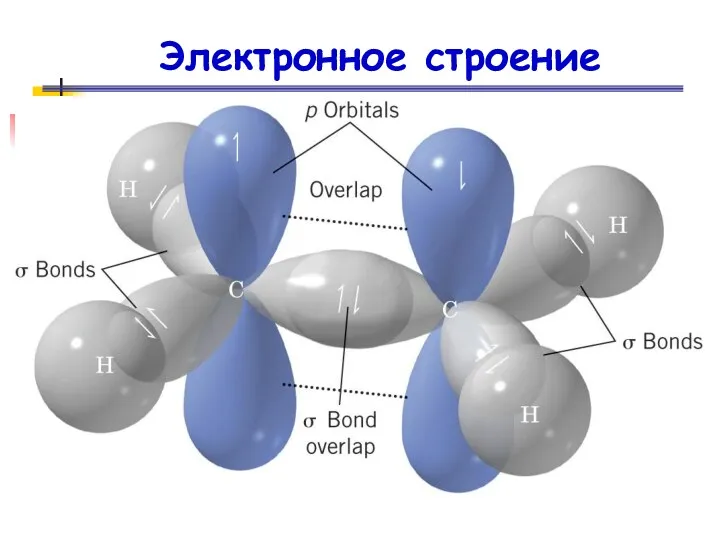
- 31. Электронное строение
- 33. Нахождение в природе Этилен и его гомологи в очень небольшом количестве встречаются в природном газе, а
- 34. Способы получения алкенов
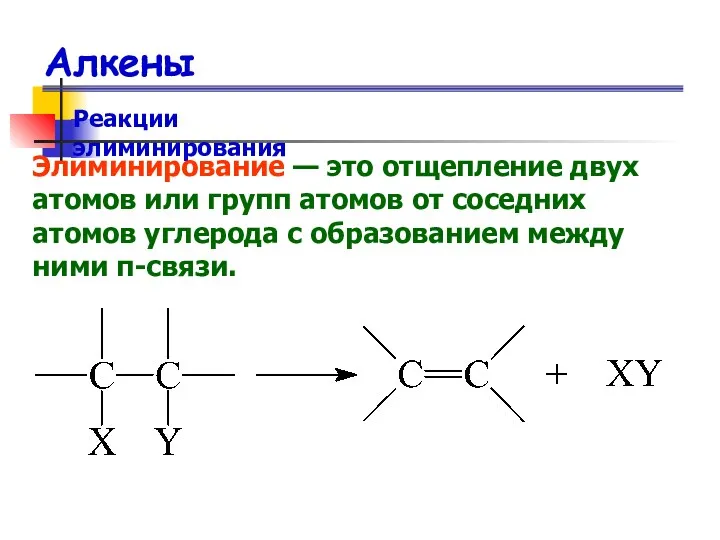
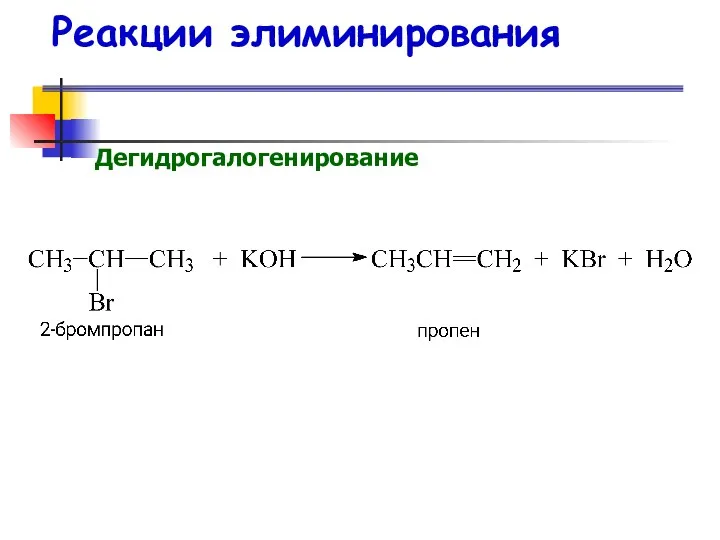
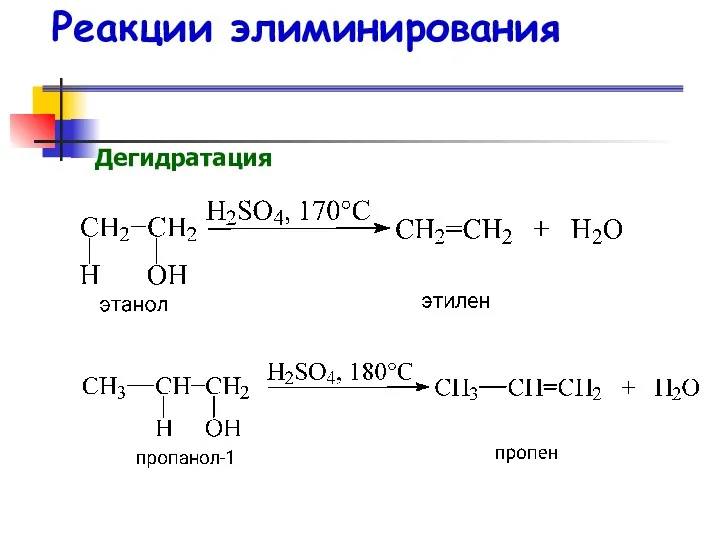
- 35. Алкены Реакции элиминирования Элиминирование — это отщепление двух атомов или групп атомов от соседних атомов углерода
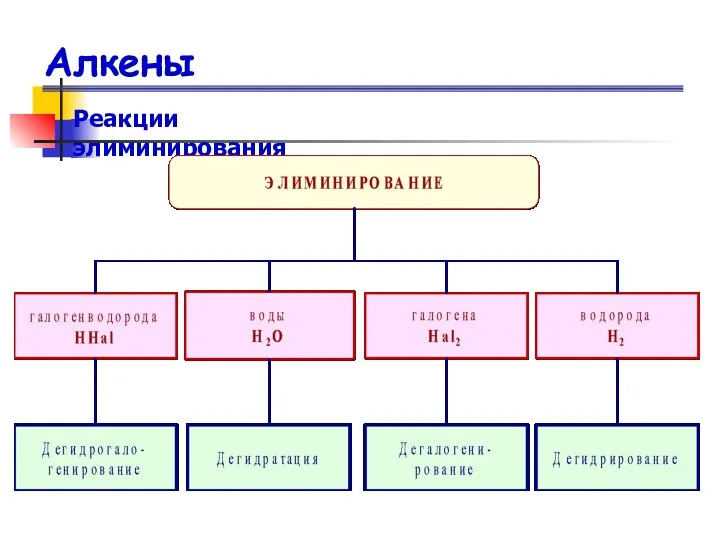
- 36. Алкены Реакции элиминирования
- 37. Дегидрирование алканов
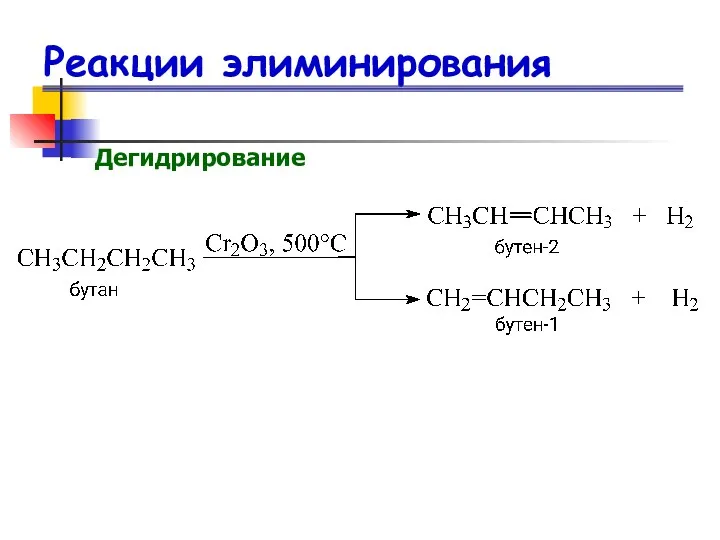
- 38. Реакции элиминирования Дегидрирование
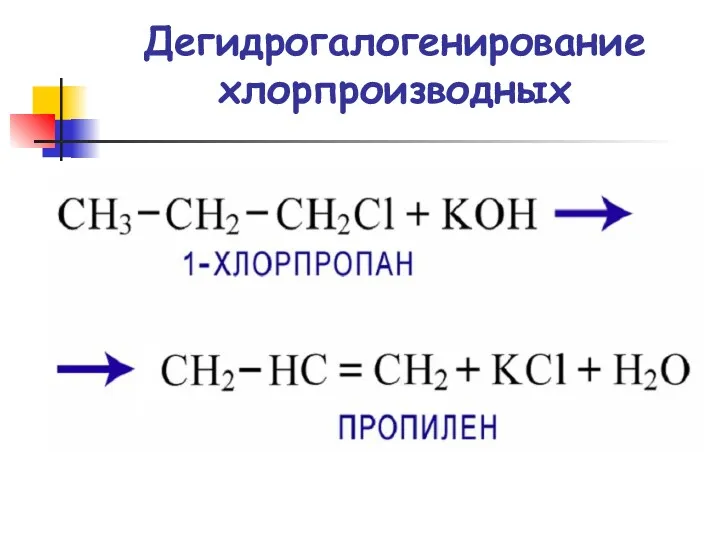
- 39. Дегидрогалогенирование хлорпроизводных
- 40. Реакции элиминирования Дегидрогалогенирование
- 41. Реакции элиминирования Дегидрогалогенирование Правило Зайцева В случае нессиметричных алкилгалогенидов отщепление атома водорода происходит от наименее гидрогенизированного
- 42. ЗАЙЦЕВ Александр Михайлович (Россия) (2.VII.1841 - 1.IX.1910)
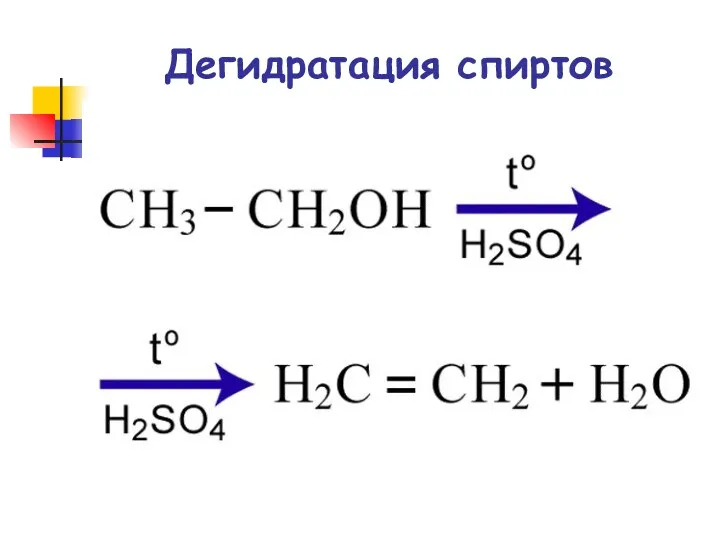
- 43. Дегидратация спиртов
- 44. Реакции элиминирования Дегидратация
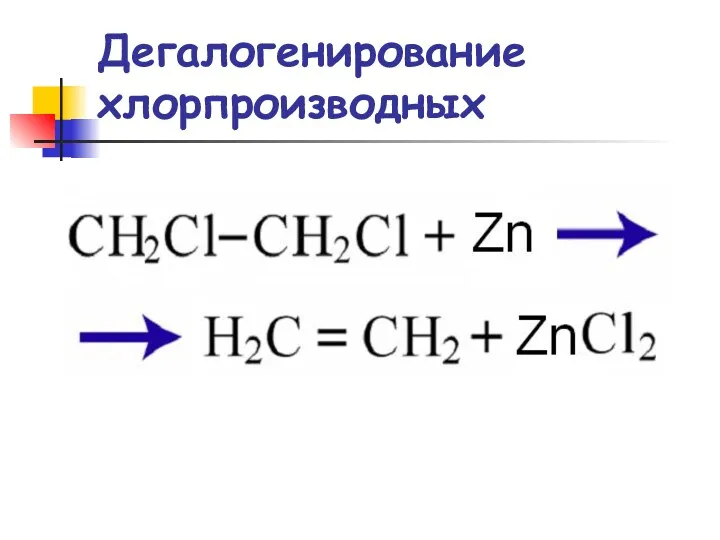
- 45. Дегалогенирование хлорпроизводных
- 46. Реакции элиминирования Дегалогенирование
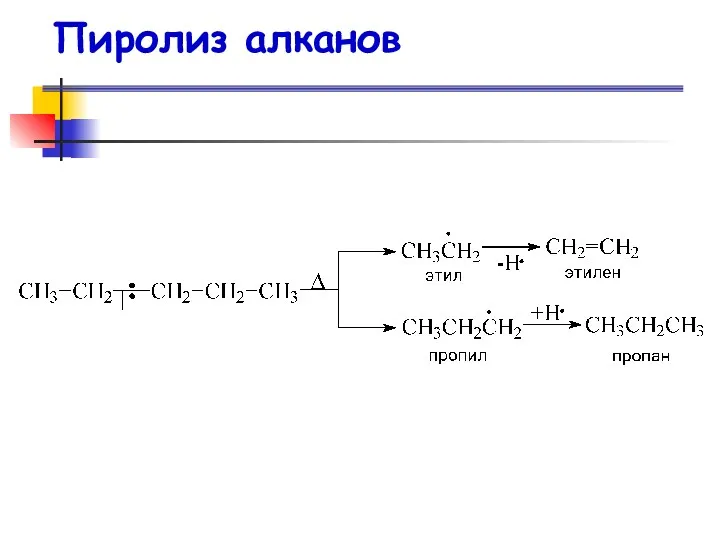
- 47. Пиролиз алканов
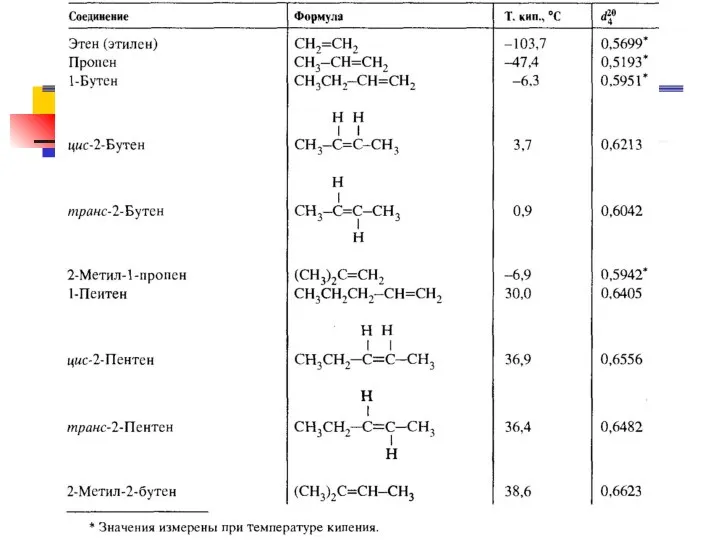
- 48. Физические свойства алкенов Алкены обладают более резким запахом. По ρ легче воды, плохо растворяются в воде.
- 50. Химические свойства
- 51. Общая характеристика реакционной способности алкенов Алкены достаточно химически активны. Причиной этого является наличие в их молекулах
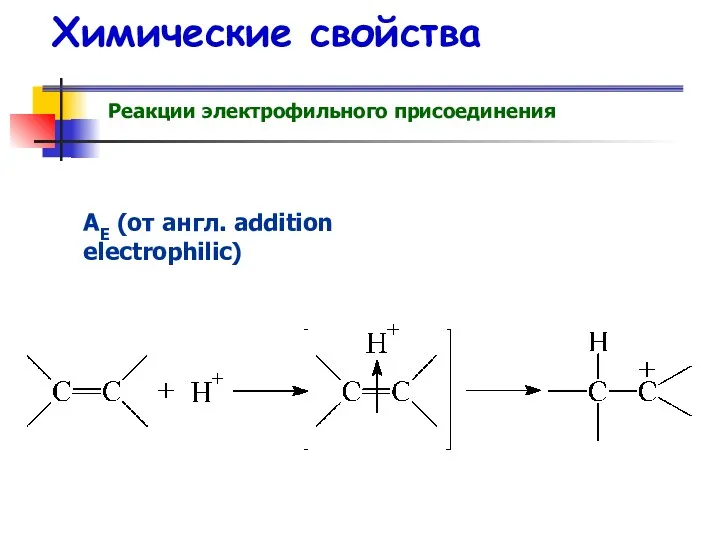
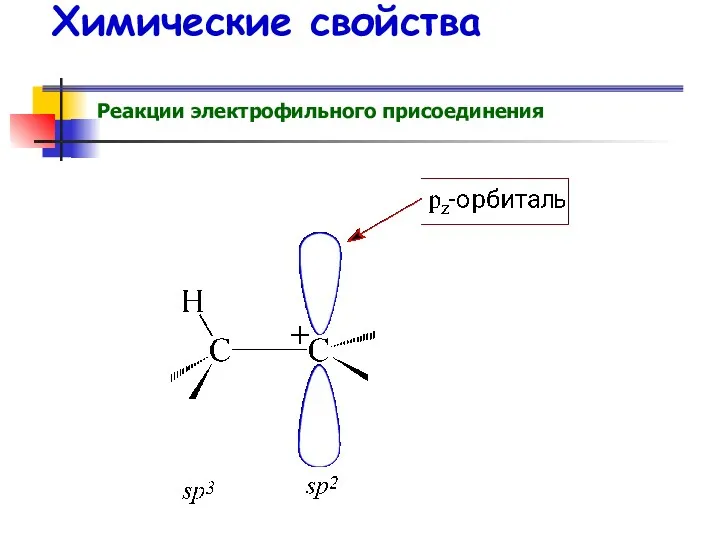
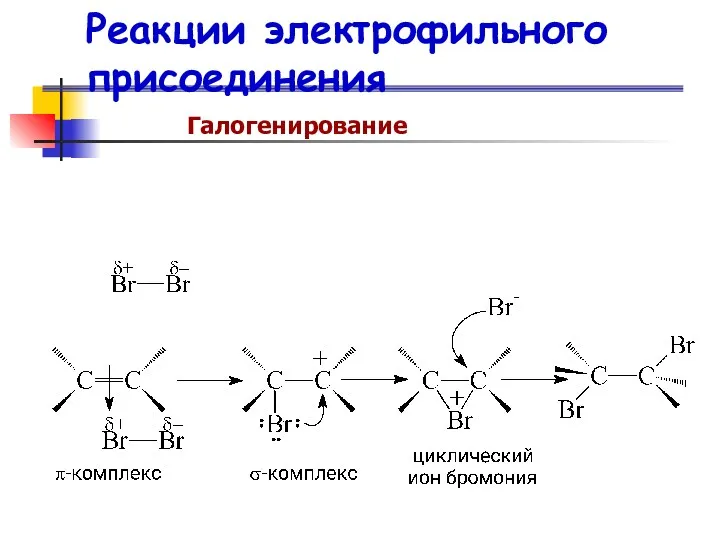
- 52. Химические свойства Реакции электрофильного присоединения АE (от англ. addition electrophilic)
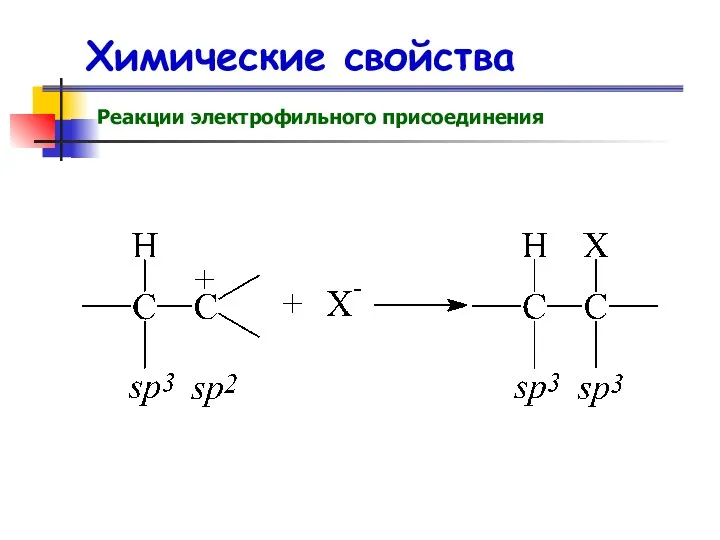
- 53. Химические свойства Реакции электрофильного присоединения
- 54. Химические свойства Реакции электрофильного присоединения
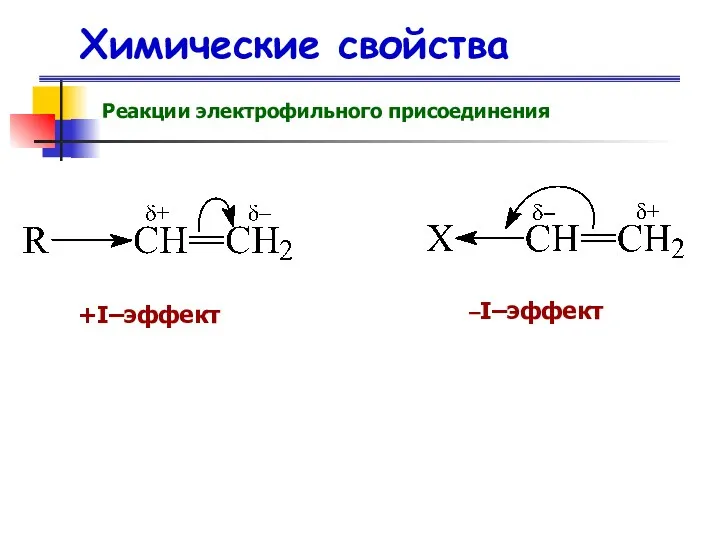
- 55. Химические свойства Реакции электрофильного присоединения +I–эффект –I–эффект
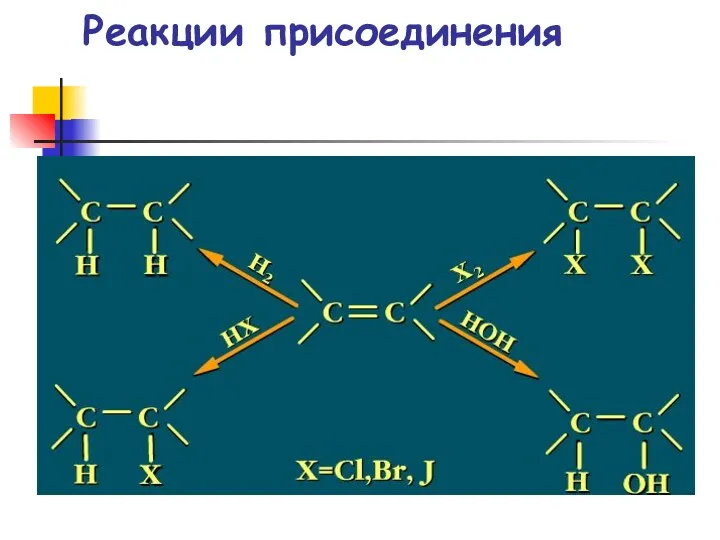
- 56. Реакции присоединения
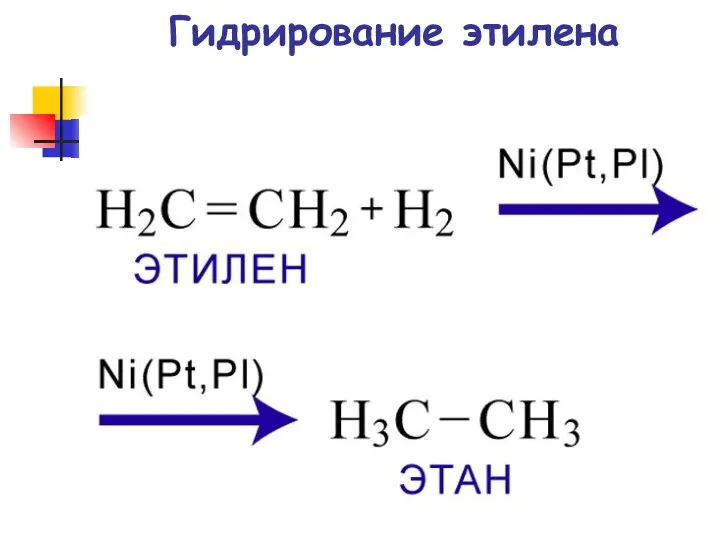
- 57. Гидрирование этилена
- 58. Гидратация алкенов
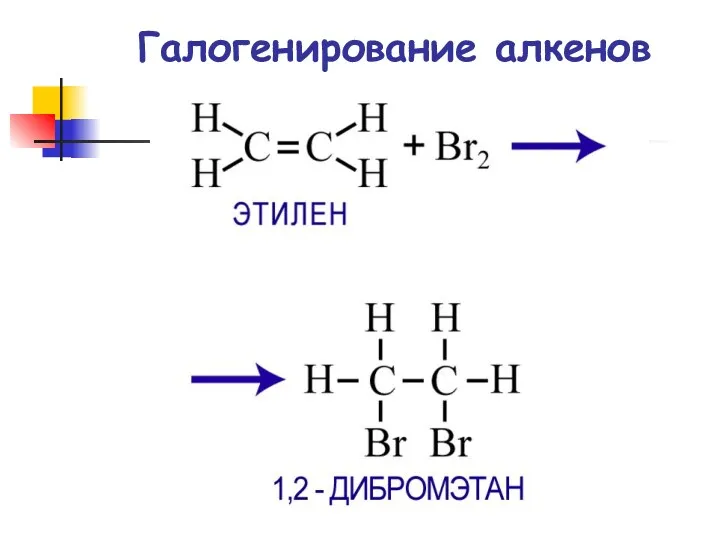
- 59. Галогенирование алкенов
- 60. Реакции электрофильного присоединения Галогенирование
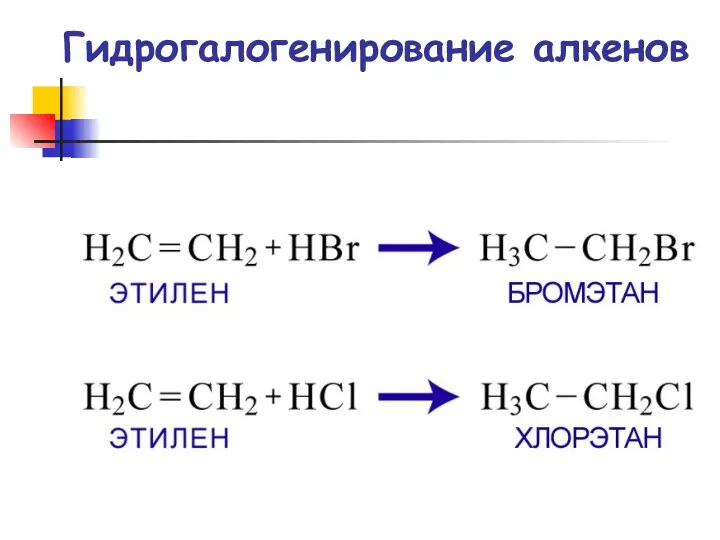
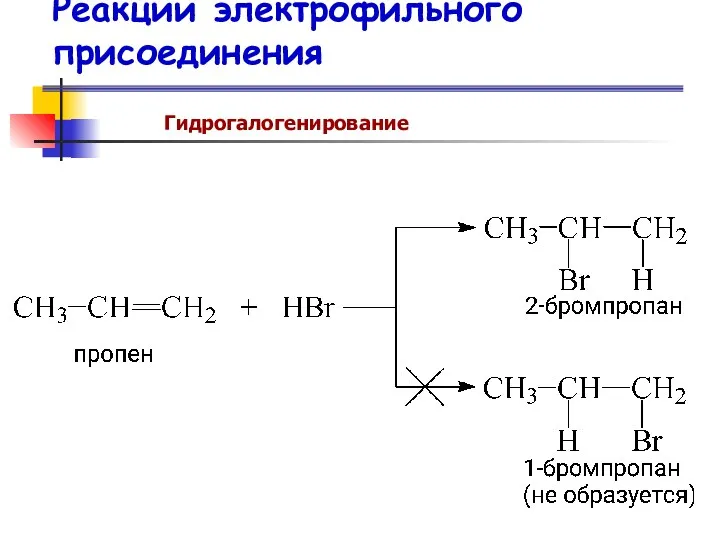
- 61. Гидрогалогенирование алкенов
- 62. Реакции электрофильного присоединения Гидрогалогенирование
- 63. Правило Марковникова
- 64. Владимир Васильевич Марковников 1837 – 1904 гг. Русский химик-органик. Исследования посвящены теоретической органической химии, органическому синтезу
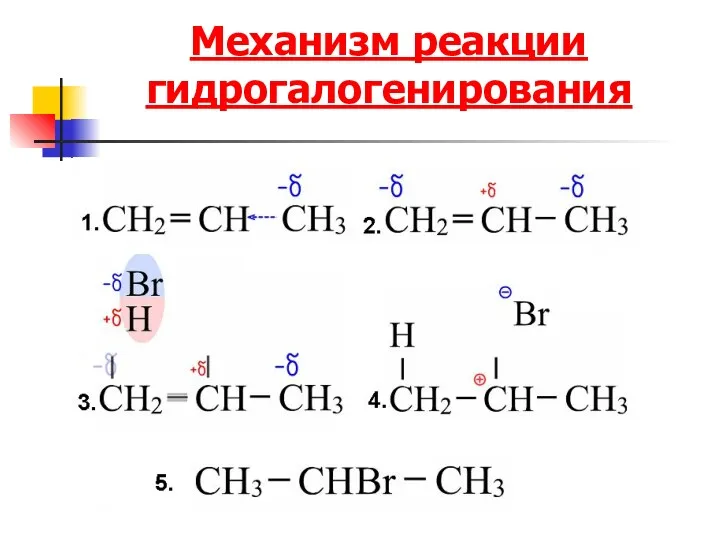
- 66. Механизм реакции гидрогалогенирования
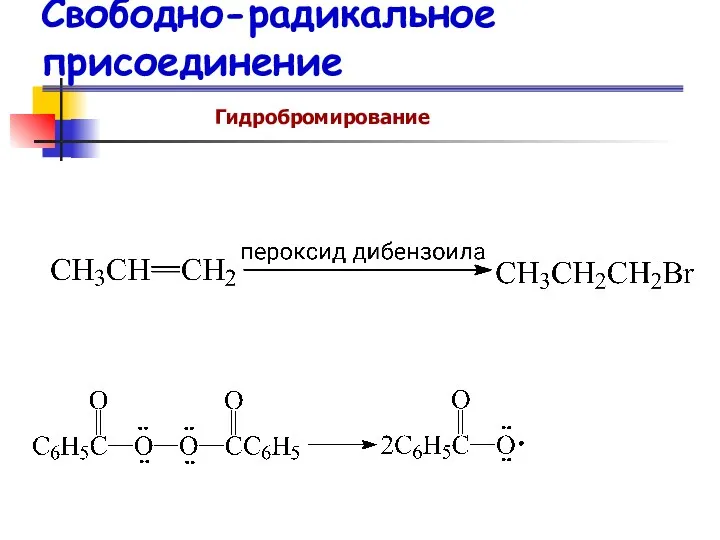
- 67. Свободно-радикальное присоединение Гидробромирование
- 68. Свободно-радикальное присоединение Гидробромирование Присоединение HBr против правила Марковникова происходит следующим образом: Br∙ (а не Н∙) реагирует
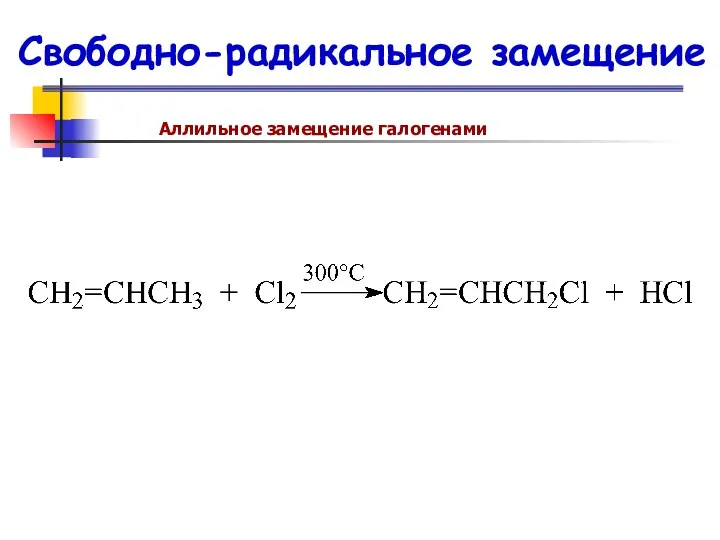
- 69. Свободно-радикальное замещение Аллильное замещение галогенами
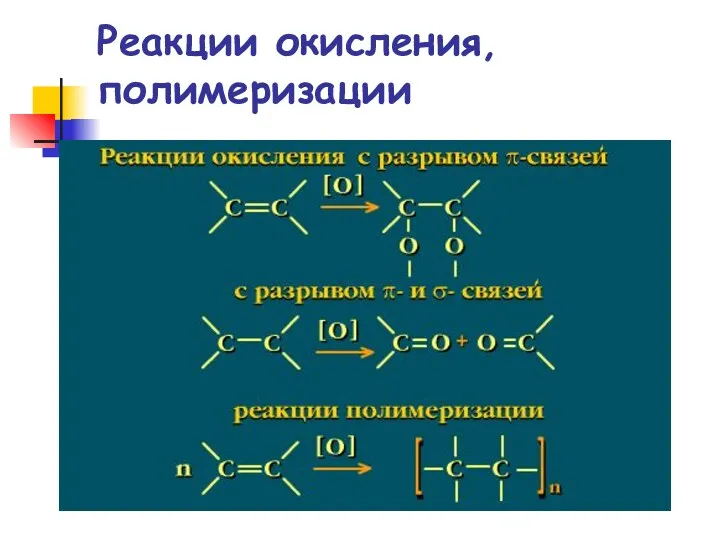
- 70. Реакции окисления, полимеризации
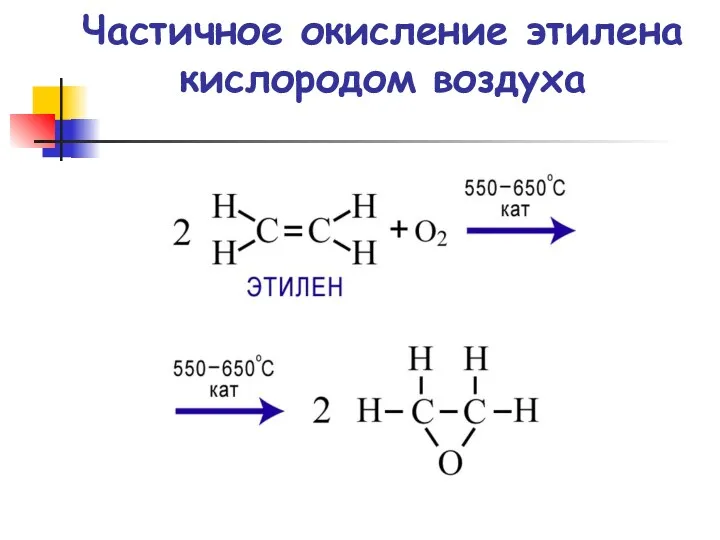
- 71. Частичное окисление этилена кислородом воздуха
- 72. Окисление Окисление
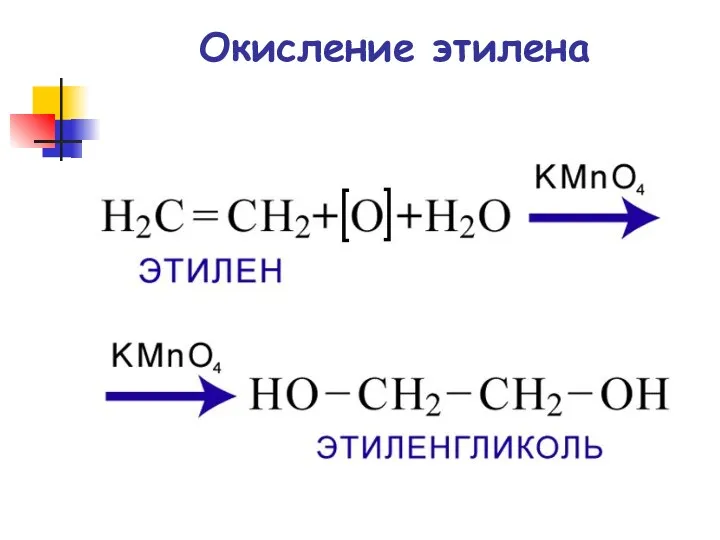
- 73. Окисление этилена
- 74. Окисление Окисление Окисление по Вагнеру ВАГНЕР Егор Егорович (9.XII.1849 – 27.XI.1903)
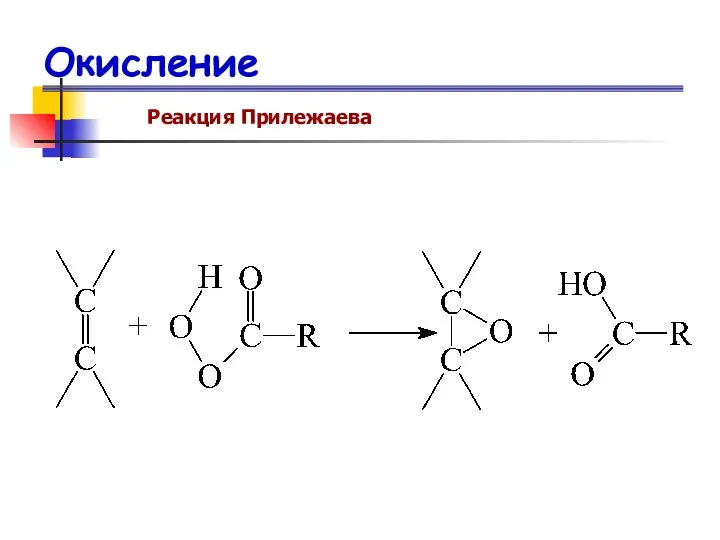
- 76. Окисление Реакция Прилежаева
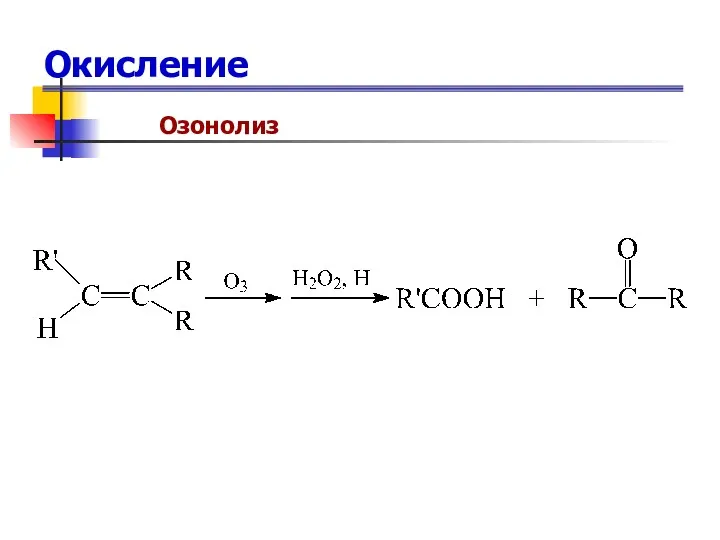
- 77. Окисление Озонолиз
- 78. Окисление Озонолиз
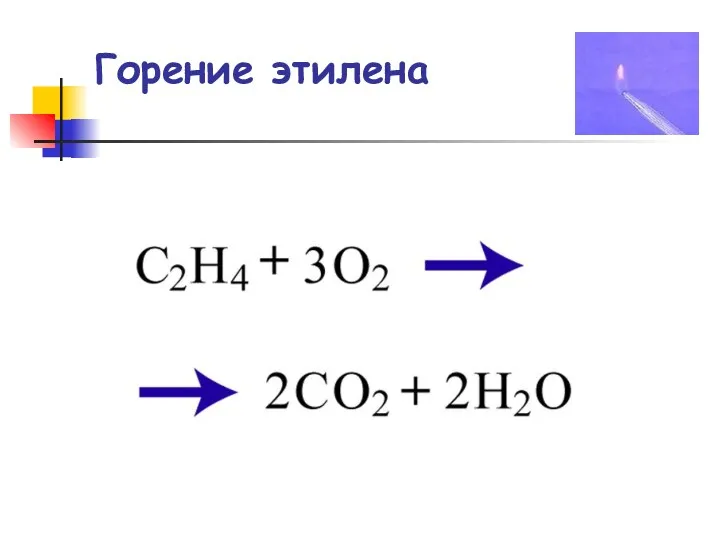
- 79. Горение этилена
- 81. Восстановление (гидрирование)
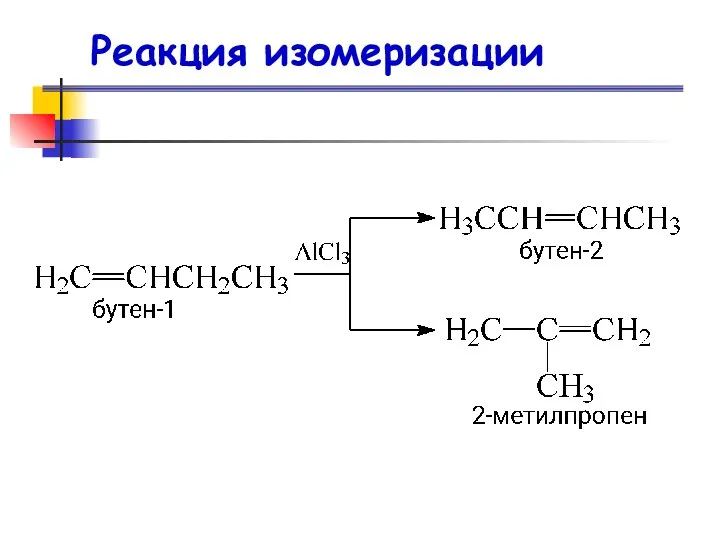
- 82. Реакция изомеризации
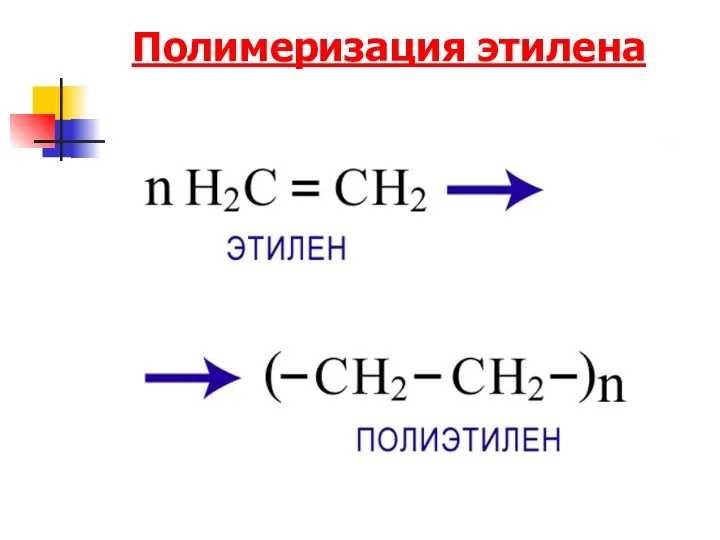
- 83. Полимеризация этилена
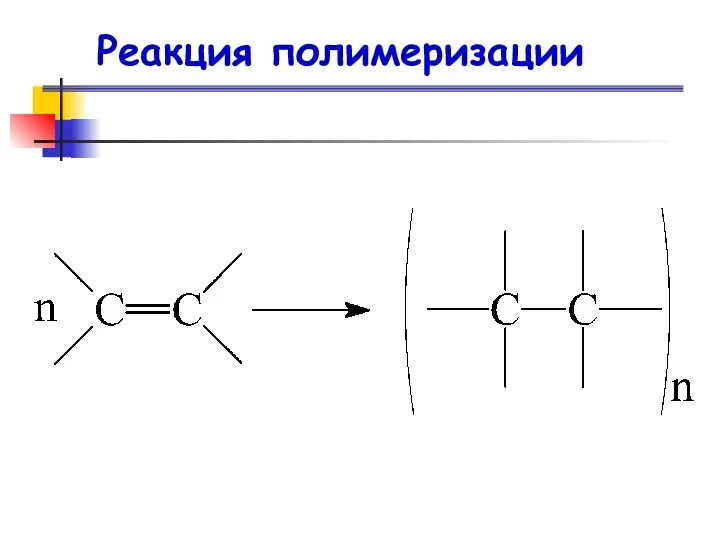
- 84. Реакция полимеризации Реакция полимеризации — это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием
- 85. Реакция полимеризации
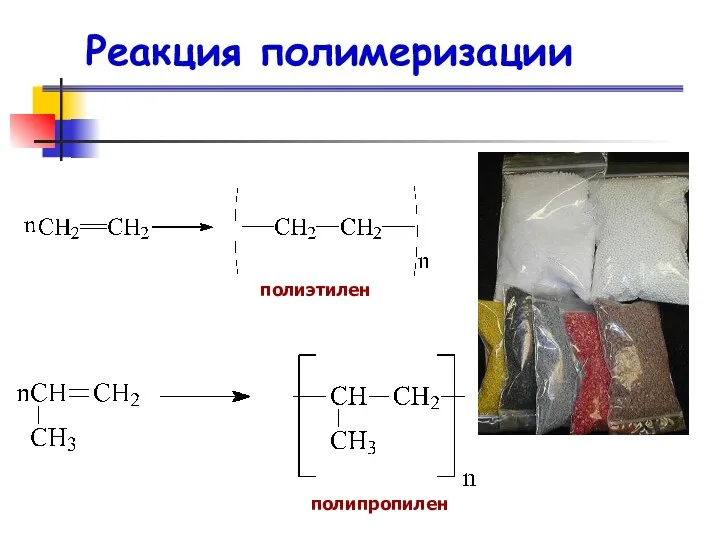
- 86. Реакция полимеризации полиэтилен полипропилен
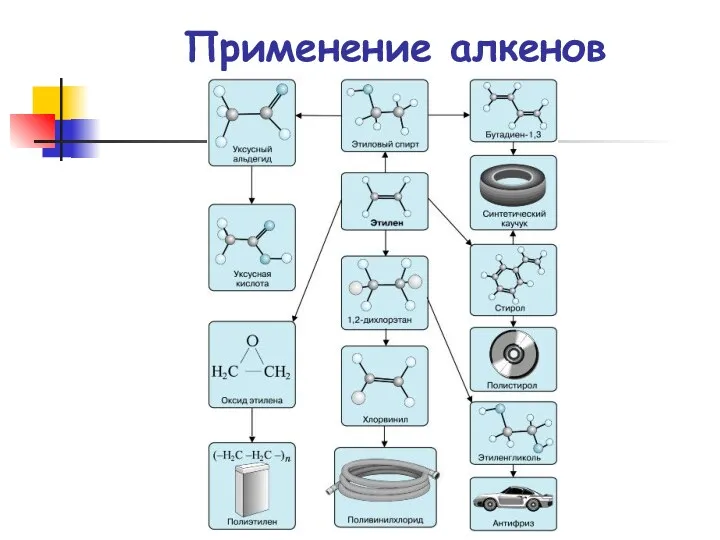
- 87. Применение алкенов
- 89. Скачать презентацию






























 Металлы – простые вещества
Металлы – простые вещества Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения Органическая химия
Органическая химия Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Коррозия и защита материалов
Коррозия и защита материалов Изучение физико-химических показателей качества макаронных изделий
Изучение физико-химических показателей качества макаронных изделий Хром. Строение атома
Хром. Строение атома Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi
Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi Виды деструкции
Виды деструкции Химиялық тепе-теңдік
Химиялық тепе-теңдік Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Количество вещества. 8 класс
Количество вещества. 8 класс Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Периодический закон и периодическая система Д.И. Менделеева
Периодический закон и периодическая система Д.И. Менделеева Общая и неорганическая химия
Общая и неорганическая химия Амины. Анилин
Амины. Анилин Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Поняття про неорганічні та органічні речовини
Поняття про неорганічні та органічні речовини Atomic mass
Atomic mass Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Зелёная химия
Зелёная химия Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс)
Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс) Химия и производство
Химия и производство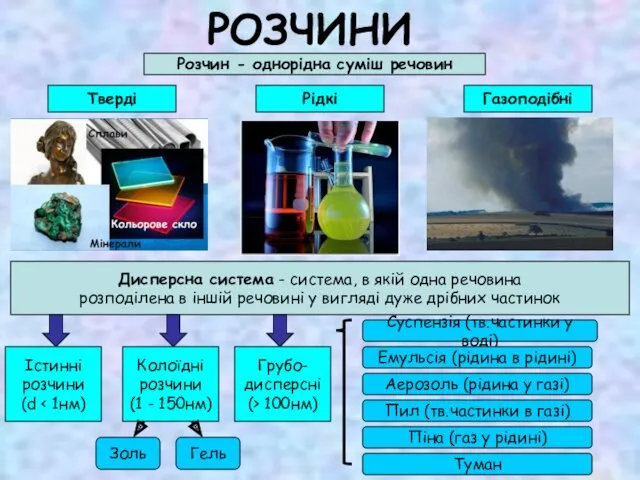 Розчини
Розчини Реакции SR в ряду алканов
Реакции SR в ряду алканов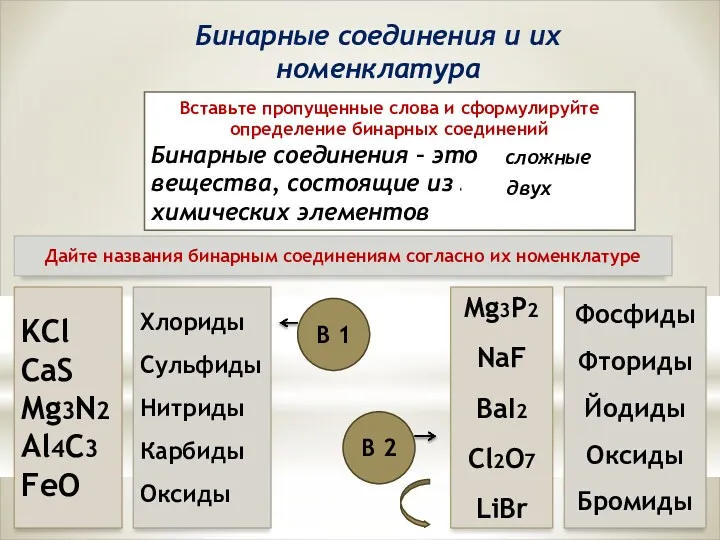 Бинарные соединения и их номенклатура
Бинарные соединения и их номенклатура