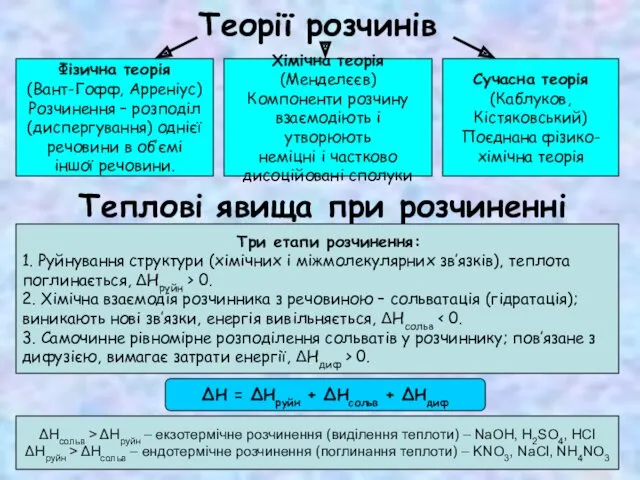
Теплові явища при розчиненні
Теорії розчинів
Фізична теорія
(Вант-Гофф, Арреніус)
Розчинення – розподіл
(диспергування) однієї
речовини в
об’ємі
іншої речовини.
Хімічна теорія
(Менделєєв)
Компоненти розчину
взаємодіють і утворюють
неміцні і частково
дисоційовані сполуки
Сучасна теорія
(Каблуков,
Кістяковський)
Поєднана фізико-
хімічна теорія
Три етапи розчинення:
1. Руйнування структури (хімічних і міжмолекулярних зв’язків), теплота
поглинається, ΔНруйн > 0.
2. Хімічна взаємодія розчинника з речовиною – сольватація (гідратація);
виникають нові зв’язки, енергія вивільняється, ΔНсольв < 0.
3. Самочинне рівномірне розподілення сольватів у розчиннику; пов’язане з
дифузією, вимагає затрати енергії, ΔНдиф > 0.
ΔН = ΔНруйн + ΔНсольв + ΔНдиф
ΔНсольв > ΔНруйн – екзотермічне розчинення (виділення теплоти) – NaOH, H2SO4, HCl
ΔНруйн > ΔНсольв – ендотермічне розчинення (поглинання теплоти) – KNO3, NaCl, NH4NO3



 Супутній нафтовий газ
Супутній нафтовий газ Химия в строительстве
Химия в строительстве Масс-Спектроскопия
Масс-Спектроскопия Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Периодический закон Д.И. Менделеева. Историческая формулировка периодического закона
Периодический закон Д.И. Менделеева. Историческая формулировка периодического закона Комплексные соединения. Определения
Комплексные соединения. Определения Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Сорбционные процессы
Сорбционные процессы Изотопная геохимия. U-Pb метод
Изотопная геохимия. U-Pb метод Классы неорганических соединений
Классы неорганических соединений Химические тест-методы анализа экологических проб. Лекция 6
Химические тест-методы анализа экологических проб. Лекция 6 P-элементы IV группы Ge, Sn, Pb
P-элементы IV группы Ge, Sn, Pb Нуклеиновые кислоты, их структурные компоненты
Нуклеиновые кислоты, их структурные компоненты Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Карбоновые кислоты. Строение, гомологический ряд, изомерия и номенклатура
Карбоновые кислоты. Строение, гомологический ряд, изомерия и номенклатура Значение периодического закона и периодической системы Д.И. Менделеева
Значение периодического закона и периодической системы Д.И. Менделеева Окислительно-восстановительные реакции. Лекция 8
Окислительно-восстановительные реакции. Лекция 8 Растворы. Концентрация растворов
Растворы. Концентрация растворов Спирты одноатомные и многоатомные
Спирты одноатомные и многоатомные Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева
Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева Строение атома
Строение атома Железо
Железо Алюминий AL- химический элемент
Алюминий AL- химический элемент Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Композиционные материалы: углепластик, стеклопластик
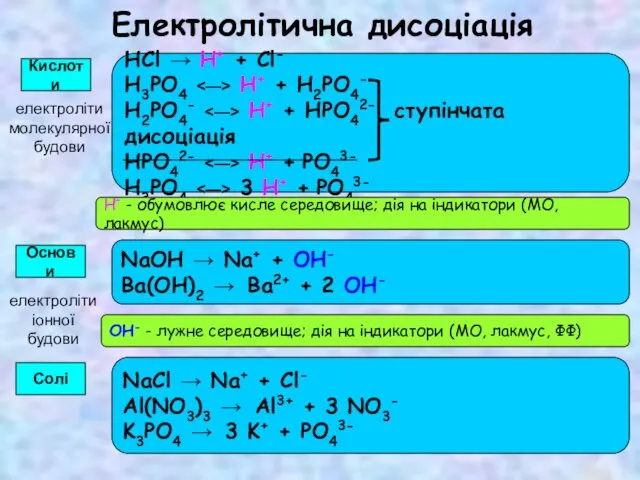
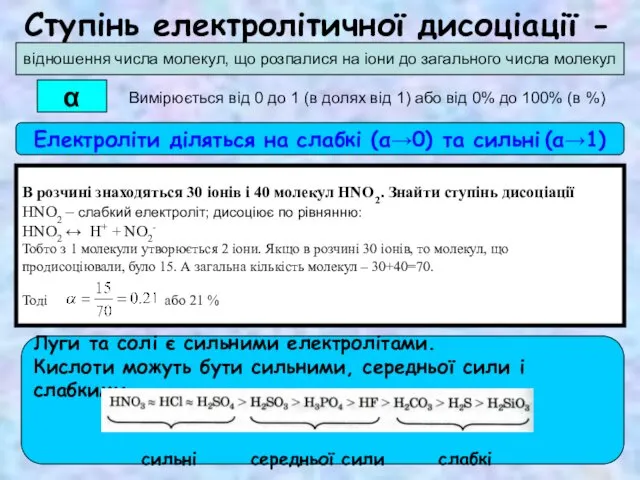
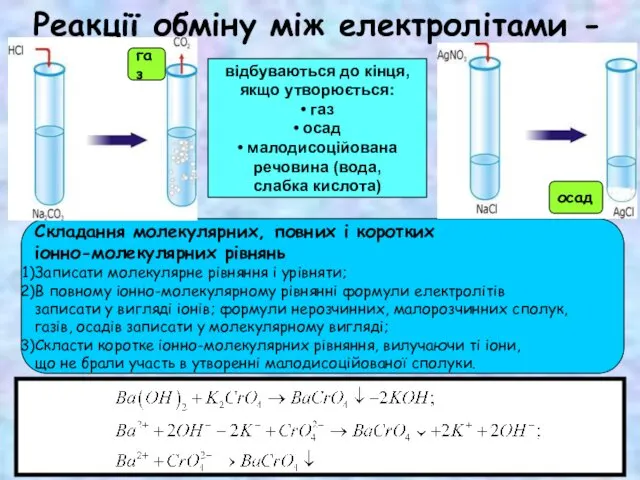
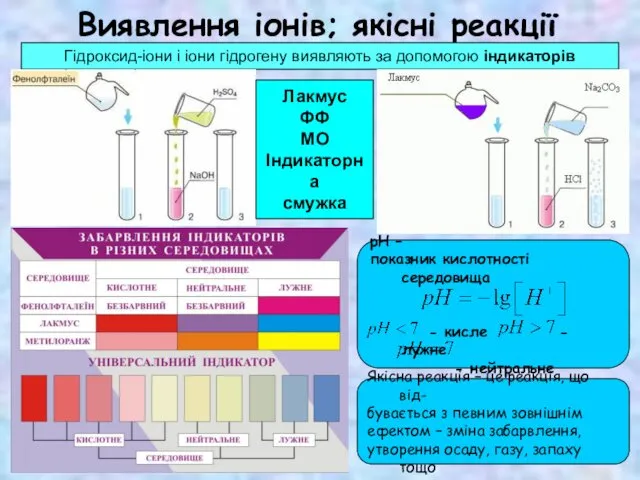
Композиционные материалы: углепластик, стеклопластик Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій
Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій