Содержание
- 2. р – элементы IV группы Ge Sn Pb
- 3. Немного истории 1869 г – опубликована Периодическая система 1871 г – Менделеев предсказал существование 3 -
- 4. Немного истории 1875 г – открыт Ga ( Лекок де Буабодран, Франция ) 1879 г -
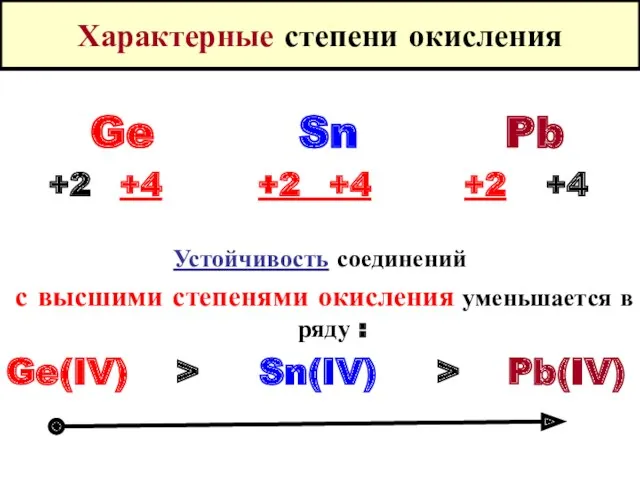
- 5. Характерные степени окисления Ge Sn Pb +2 +4 +2 +4 +2 +4 Устойчивость соединений с высшими
- 6. Активность металлов Ge Sn Pb Е0 , v Ge2+ + 2e = Ge0 0.0 Sn2+ +
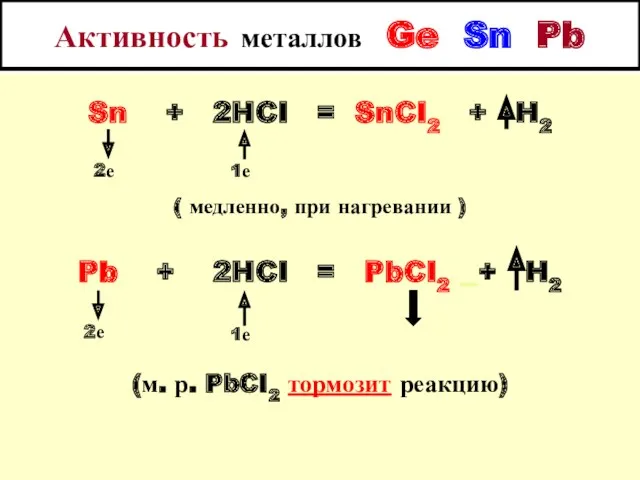
- 7. Активность металлов Ge Sn Pb Sn + 2HCI = SnCI2 + H2 ( медленно, при нагревании
- 8. Растворение осадков PbCI2 + 2HCI конц. = H2 [ PbCI4 ] раствор PbSO4 + H2SO4 конц.
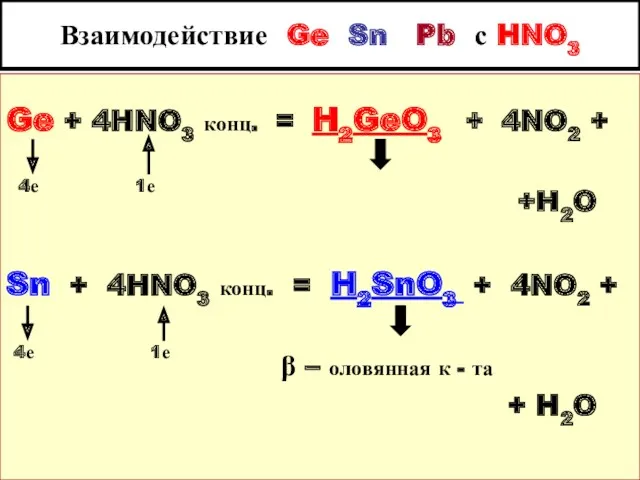
- 9. Взаимодействие Ge Sn Pb с HNO3 Ge + 4HNO3 конц. = H2GeO3 + 4NO2 + +H2O
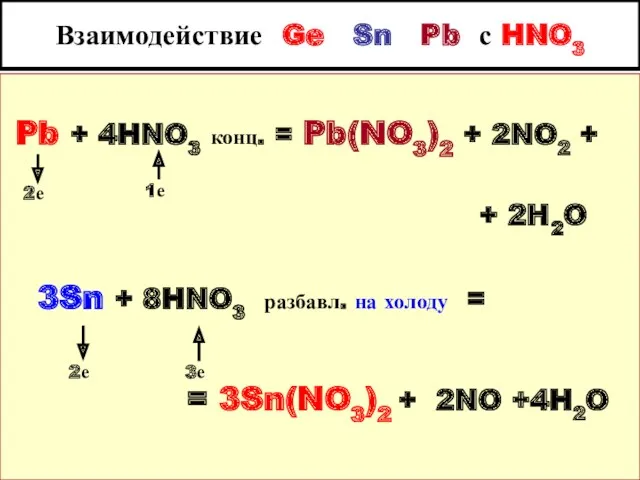
- 10. Взаимодействие Ge Sn Pb с HNO3 Pb + 4HNO3 конц. = Pb(NO3)2 + 2NO2 + +
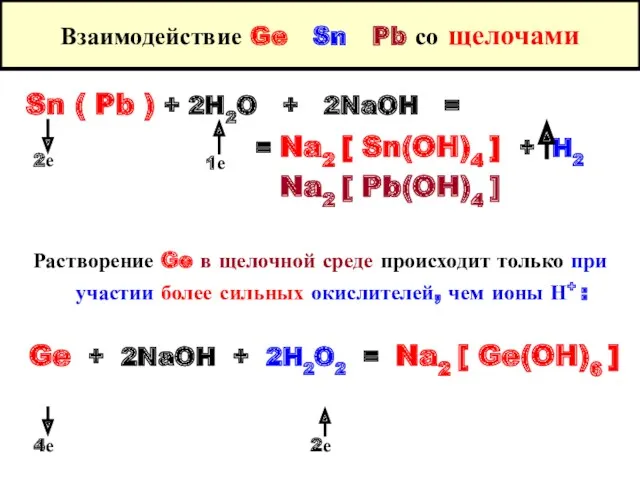
- 11. Взаимодействие Ge Sn Pb со щелочами Sn ( Pb ) + 2H2O + 2NaOH = =
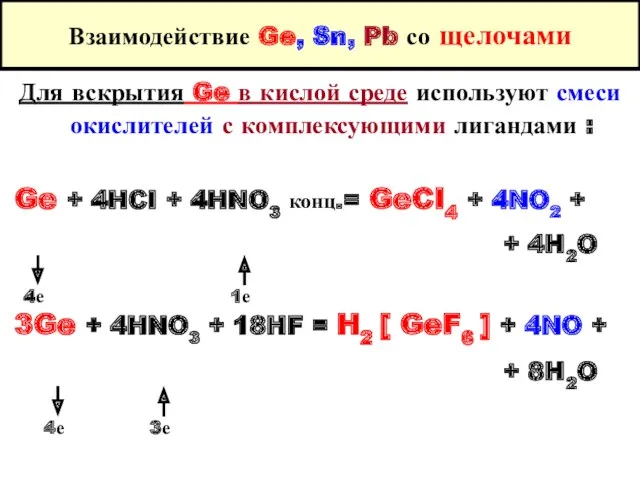
- 12. Взаимодействие Ge, Sn, Pb со щелочами Для вскрытия Ge в кислой среде используют смеси окислителей с
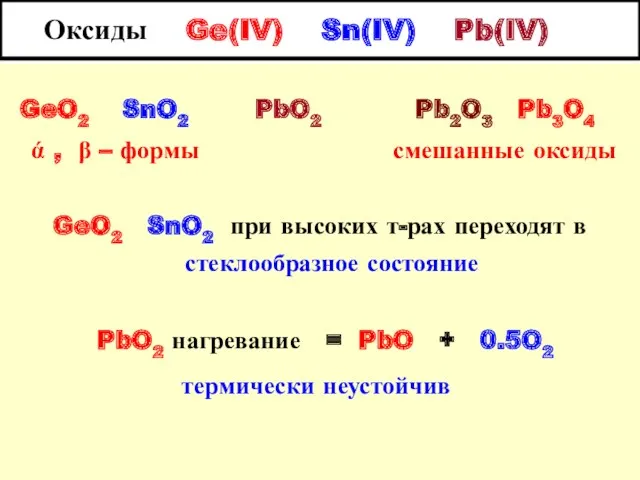
- 13. Оксиды Ge(IV) Sn(IV) Pb(IV) GeO2 SnO2 PbO2 Pb2O3 Pb3O4 ά , β – формы смешанные оксиды
- 14. Гидроксиды Ge(IV) Sn(IV) Pb(IV) Малорастворимые кислоты М(ОН)4 лучше представлять в форме гидратированных оксидов : ( МО2
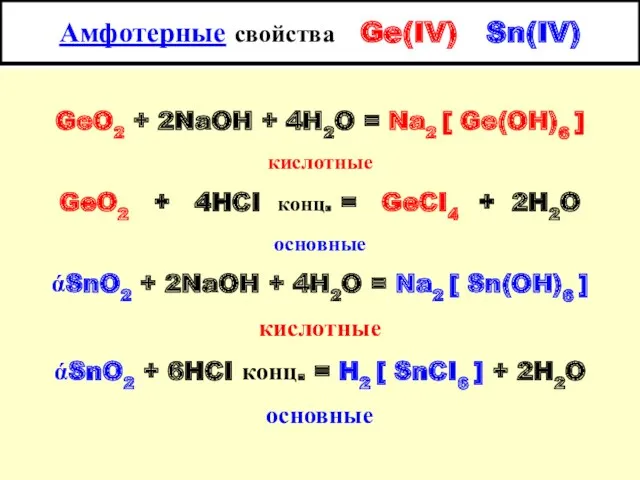
- 15. Амфотерные свойства Ge(IV) Sn(IV) GeO2 + 2NaOH + 4H2O = Na2 [ Ge(OH)6 ] кислотные GeO2
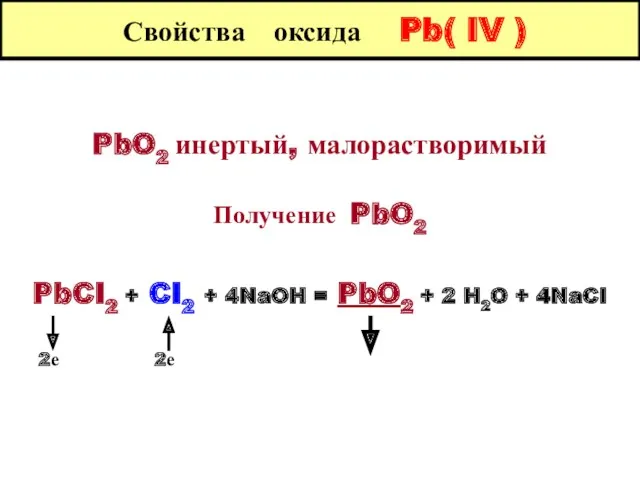
- 16. Свойства оксида Pb( IV ) PbO2 инертый, малорастворимый Получение PbO2 PbCI2 + CI2 + 4NaOH =
- 17. Устойчивость соединений Ge(IV) Sn(IV) Pb(IV) Общая тенденция для р – элементов : cверху вниз по группе
- 18. Устойчивость соединений Ge(IV) Sn(IV) Pb(IV) Оксиды Pb(IV) являются сильными окислителями : PbO2 + 4H+ + 2e
- 19. Устойчивость соединений Ge(IV) Sn(IV) Pb(IV) Ge(IV) Sn(IV) не проявляют заметных окислительных свойств : GeO2 + 4H+
- 20. Восстановительные свойства Ge(II) Sn(II) Pb(II) Восстановительные свойства уменьшаются в ряду : Ge2+ > Sn2+ > Pb2+
- 21. Восстановительные свойства Ge(II) Sn(II) Pb(II) В щелочной среде : [ Sn(OH)6 ]2- + 2e = [
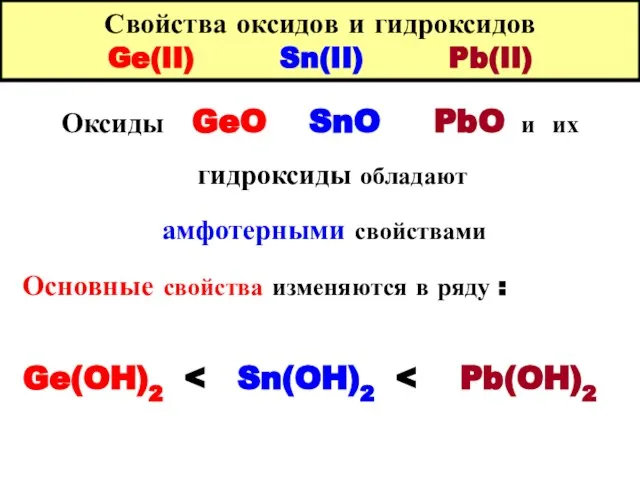
- 22. Свойства оксидов и гидроксидов Ge(II) Sn(II) Pb(II) Оксиды GeO SnO PbO и их гидроксиды обладают амфотерными
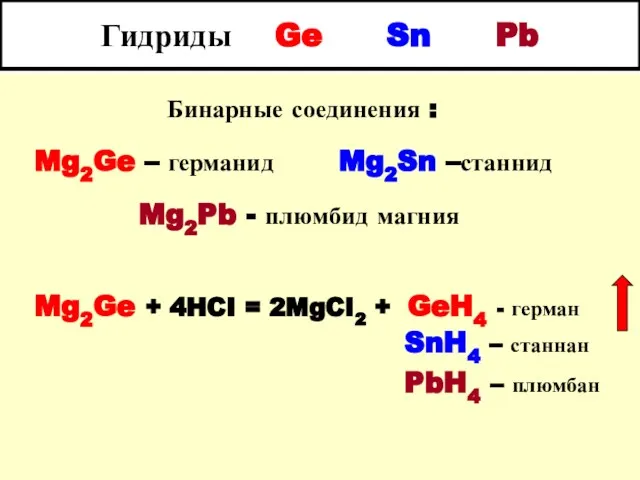
- 23. Гидриды Ge Sn Pb Бинарные соединения : Mg2Ge – германид Mg2Sn –станнид Mg2Pb - плюмбид магния
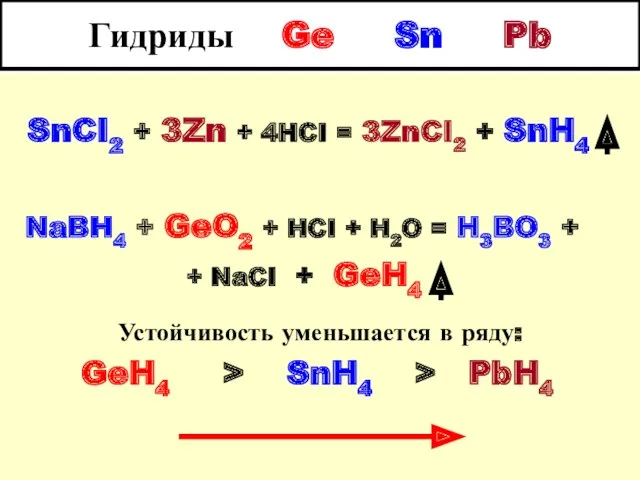
- 24. Гидриды Ge Sn Pb SnCI2 + 3Zn + 4HCI = 3ZnCI2 + SnH4 NaBH4 + GeO2
- 25. Способность к образованию связей Э - Э Связь Есвязи , кДж/м C -- C 356 Si
- 26. Получение Ge Sn Pb Исходные вещества – минералы : касситерит - SnO2 сульфиды – GeS PbS
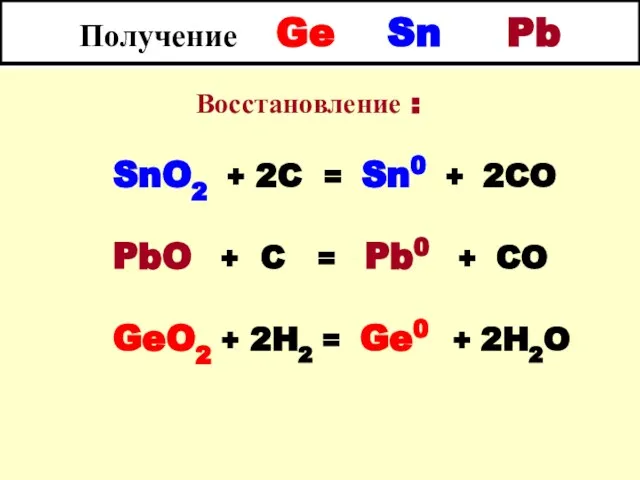
- 27. Получение Ge Sn Pb Восстановление : SnO2 + 2C = Sn0 + 2CO PbO + C
- 28. Галогениды Ge Sn Pb Известны все галогениды за исключением PbBr4 и PbJ4 PbCI4 устойчив только при
- 29. Галогениды Ge Sn Pb Гидролиз тетрахлоридов : CCI4 не гидролизуется SiCI4 + 3H2O = H2SiO3 +
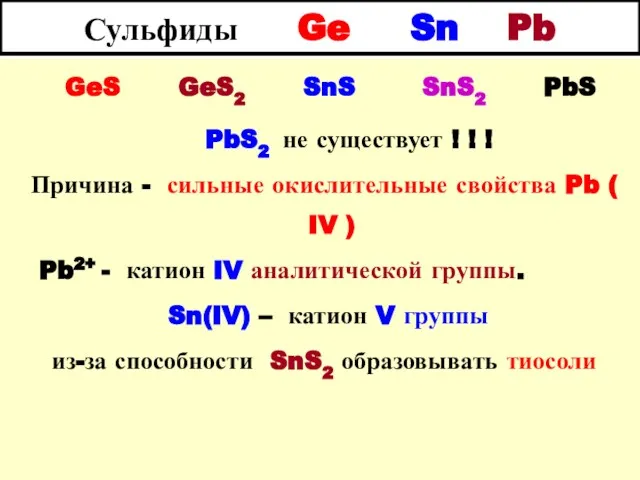
- 30. Сульфиды Ge Sn Pb GeS GeS2 SnS SnS2 PbS PbS2 не существует ! ! ! Причина
- 31. Сульфиды Ge Sn Pb Растворимость сульфидов катионов IV и V групп очень мала , они осаждаются
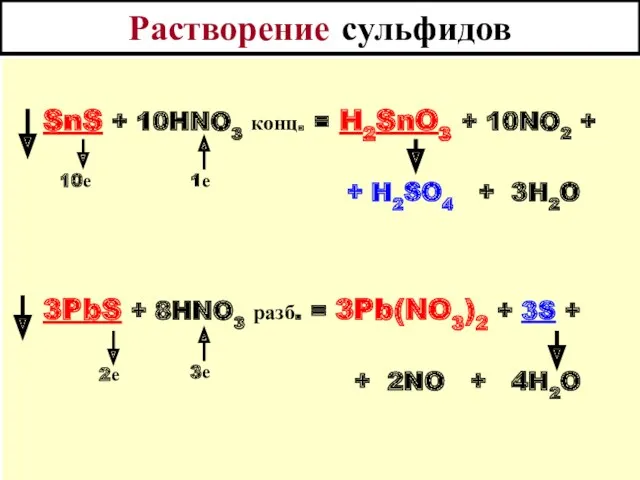
- 32. Растворение сульфидов SnS + 10HNO3 конц. = H2SnO3 + 10NO2 + + H2SO4 + 3H2O 3PbS
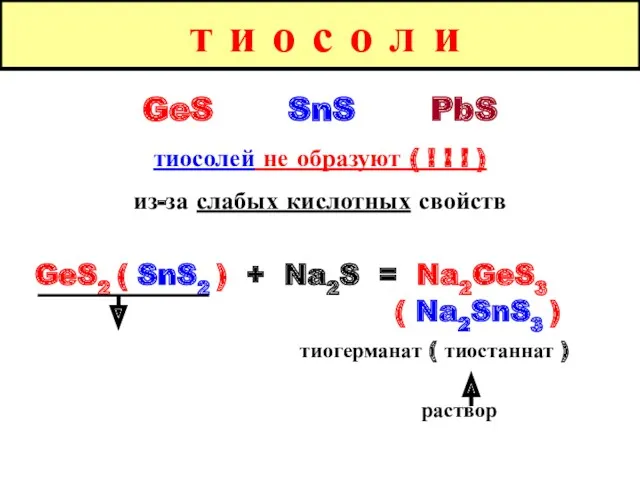
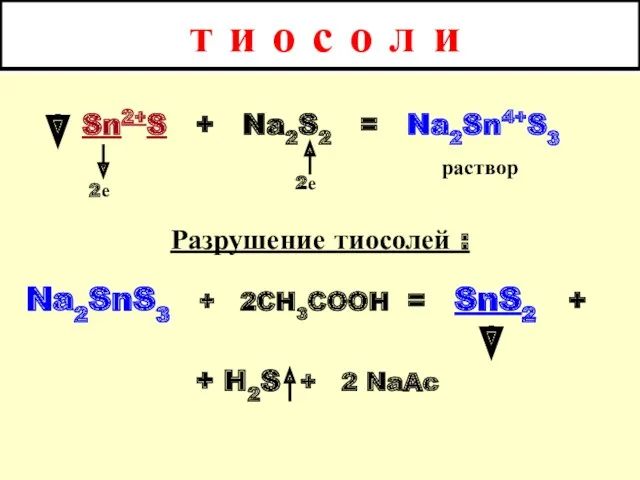
- 33. т и о с о л и GeS SnS PbS тиосолей не образуют ( ! !
- 34. т и о с о л и Sn2+S + Na2S2 = Na2Sn4+S3 раствор Разрушение тиосолей :
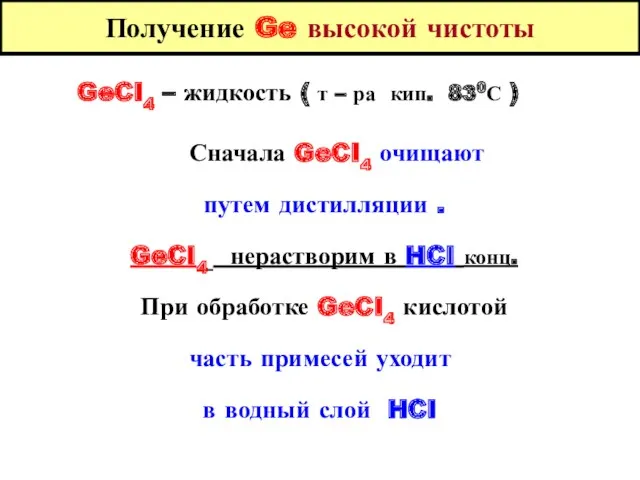
- 35. Получение Ge высокой чистоты GeCI4 – жидкость ( т – ра кип. 830С ) Сначала GeCI4
- 36. Получение Ge высокой чистоты Выcоко чистый GeCI4 подвергают гидролизу : GeCI4 ( ж ) + 2H2O
- 38. Скачать презентацию

















 Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Отрицательное влияние азотных минеральных удобрений на почву
Отрицательное влияние азотных минеральных удобрений на почву Предмет органической химии. Основные положения теории химического строения органических соединений
Предмет органической химии. Основные положения теории химического строения органических соединений Бета-окисление жирных кислот
Бета-окисление жирных кислот Аммиак
Аммиак Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Характеристика элементов VIII-В группы. Семейство железа
Характеристика элементов VIII-В группы. Семейство железа Химические реакции
Химические реакции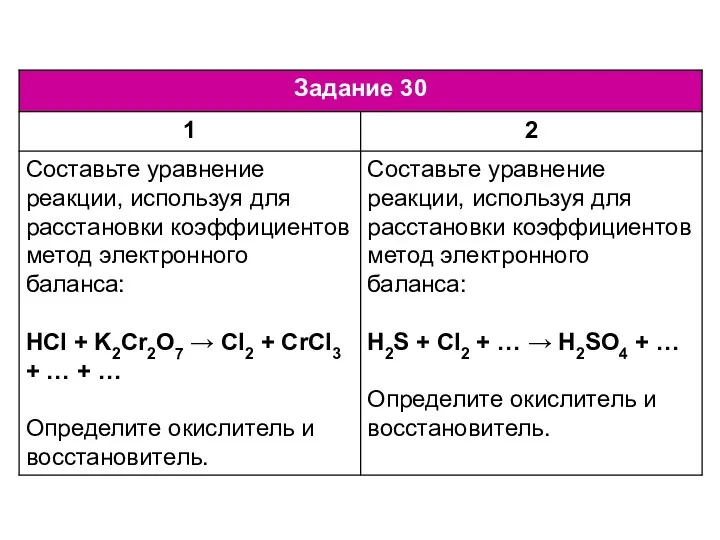 ЕГЭ по химии. Задание 30-34
ЕГЭ по химии. Задание 30-34 Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Природный и искусственный камень
Природный и искусственный камень Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях
Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях Электролитическая диссоциация
Электролитическая диссоциация Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Молекулалық орбиталдың негіздері ТФП 315
Молекулалық орбиталдың негіздері ТФП 315 АТФ Аденозинтрифосфат
АТФ Аденозинтрифосфат Растворы
Растворы Фенолы. Классификация и изомерия
Фенолы. Классификация и изомерия Properties of Atoms and the Periodic Table
Properties of Atoms and the Periodic Table Кевлар. Структура кевлара
Кевлар. Структура кевлара XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Первичная переработка нефти
Первичная переработка нефти 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva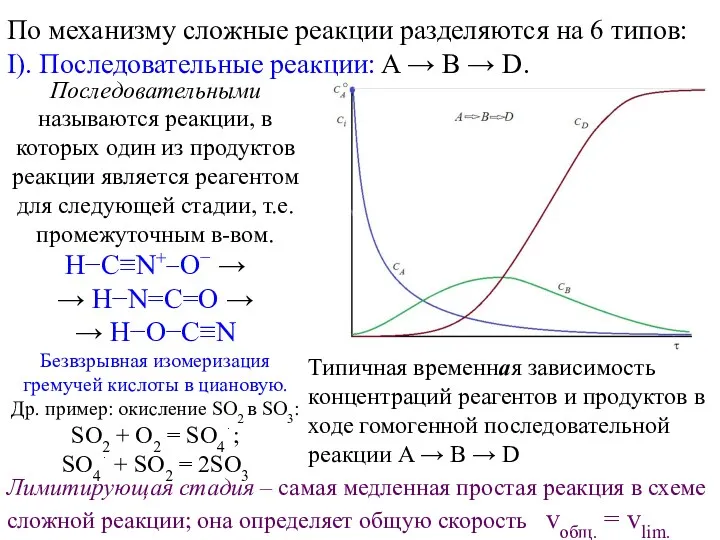 Сложные реакции по механизму
Сложные реакции по механизму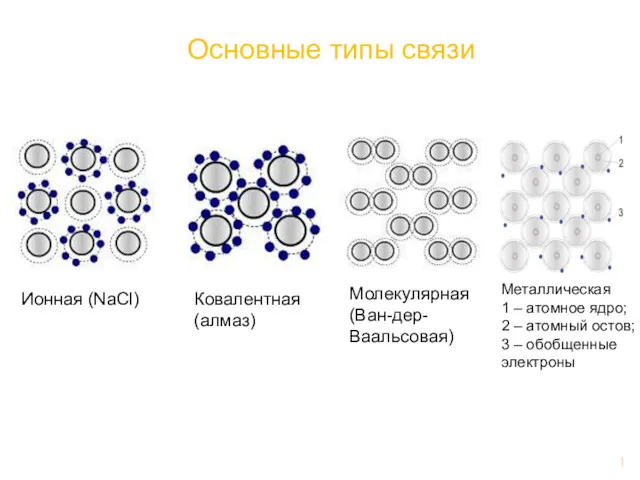 Основные типы связи
Основные типы связи Метал конструкциялық материалдар
Метал конструкциялық материалдар Химическая термодинамика
Химическая термодинамика