Содержание
- 2. ПОНЯТИЕ Карбоновыми кислотами называются кислородсодержащие органические вещества, молекулы которых содержат карбоксильную группу , связанную с углеводородным
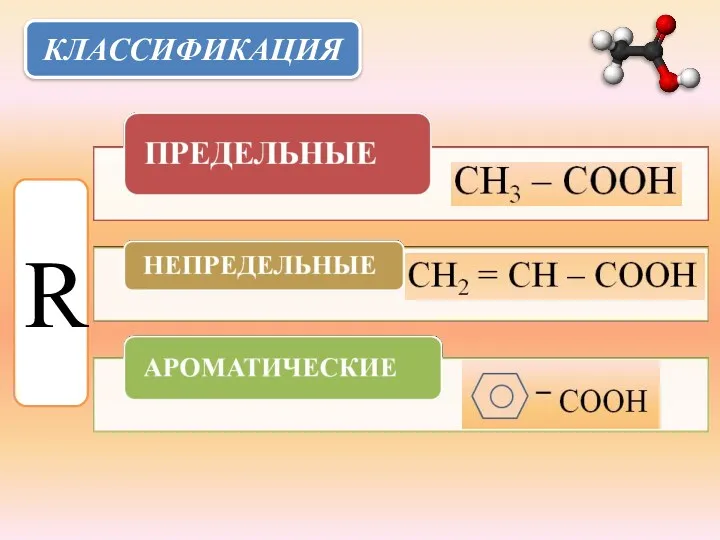
- 3. КЛАССИФИКАЦИЯ R
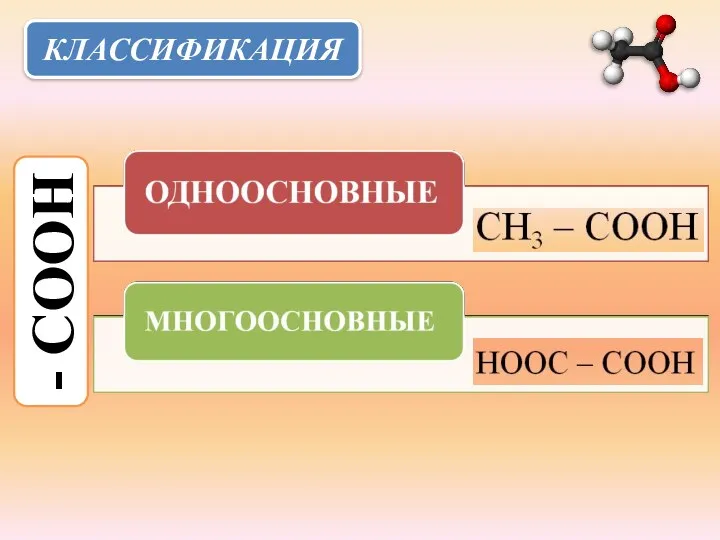
- 4. КЛАССИФИКАЦИЯ - СООН
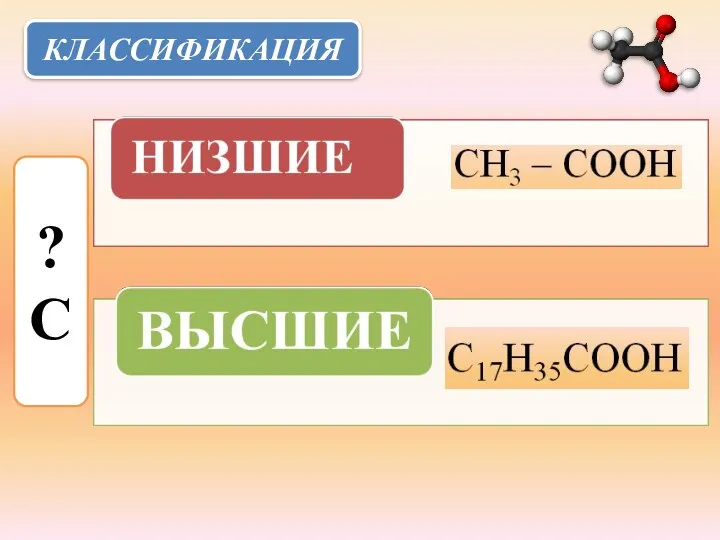
- 5. КЛАССИФИКАЦИЯ ? С
- 6. ГОМОЛОГИЧЕСКИЙ РЯД Задание: Составьте структурные и молекулярные формулы первых четырёх представителей гомологического ряда предельных одноосновных карбоновых
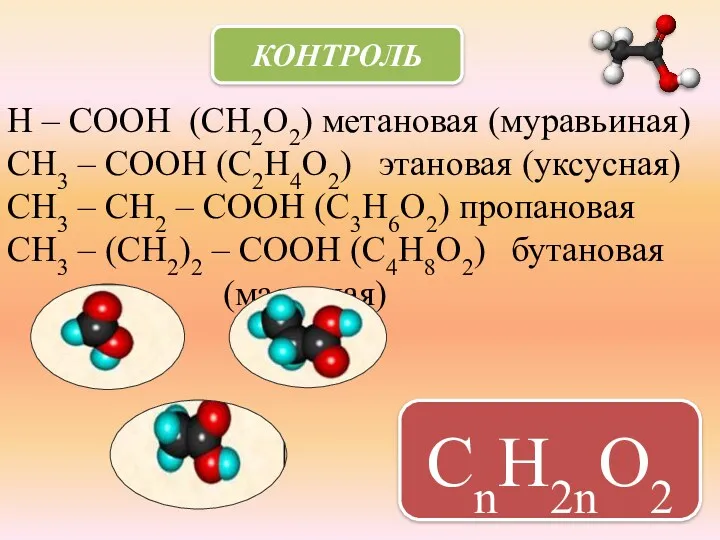
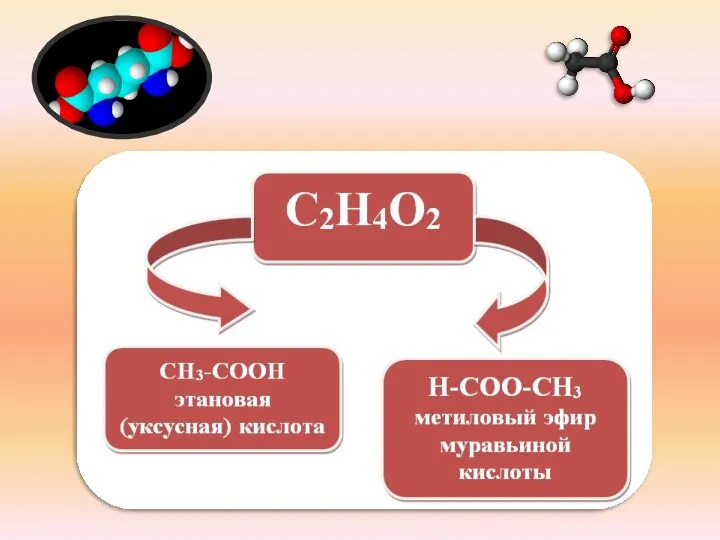
- 7. Н – СООН (СН2О2) метановая (муравьиная) СН3 – СООН (С2Н4О2) этановая (уксусная) СН3 – СН2 –
- 8. ИЗОМЕРИЯ И НОМЕНКЛАТУРА Какой вид изомерии характерен для предельных карбоновых кислот? С какого представителя начинается данный
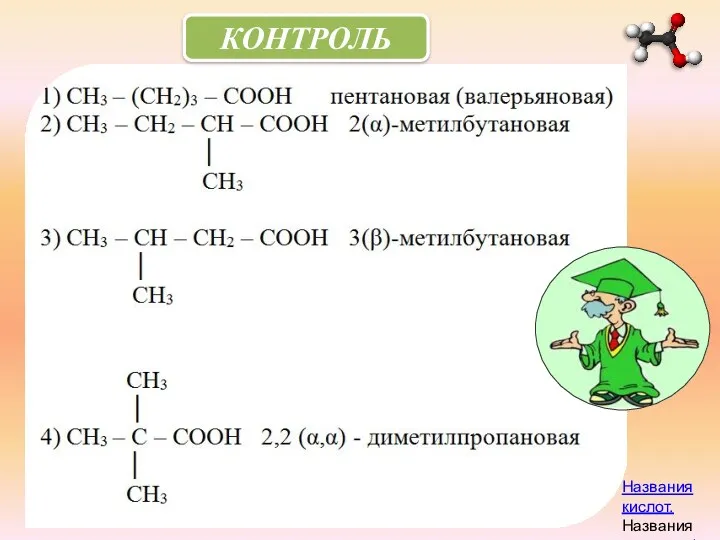
- 9. КОНТРОЛЬ Названия кислот.Названия кислот.ppt
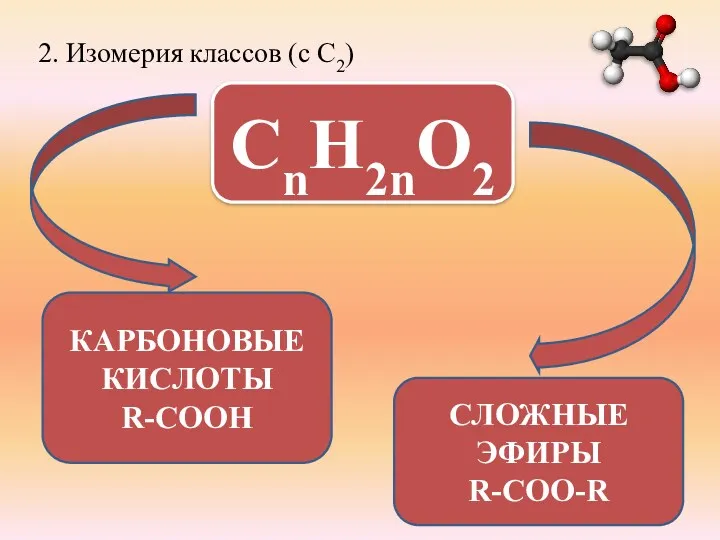
- 10. 2. Изомерия классов (c C2) СnH2nO2 КАРБОНОВЫЕ КИСЛОТЫ R-COOH СЛОЖНЫЕ ЭФИРЫ R-COO-R
- 12. Домашнее задание: § 27, стр. 117-118 упр.16
- 13. Карбоновые кислоты Урок №24 Физические и химические свойства
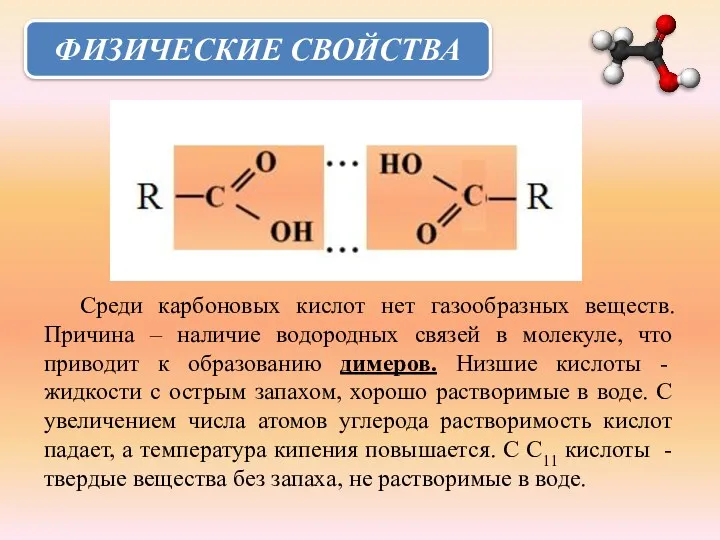
- 14. ФИЗИЧЕСКИЕ СВОЙСТВА Среди карбоновых кислот нет газообразных веществ. Причина – наличие водородных связей в молекуле, что
- 15. ХИМИЧЕСКИЕ СВОЙСТВА Каков состав неорганических кислот? Почему неорганические кислоты обладают общими химическими свойствами? Как называются производные
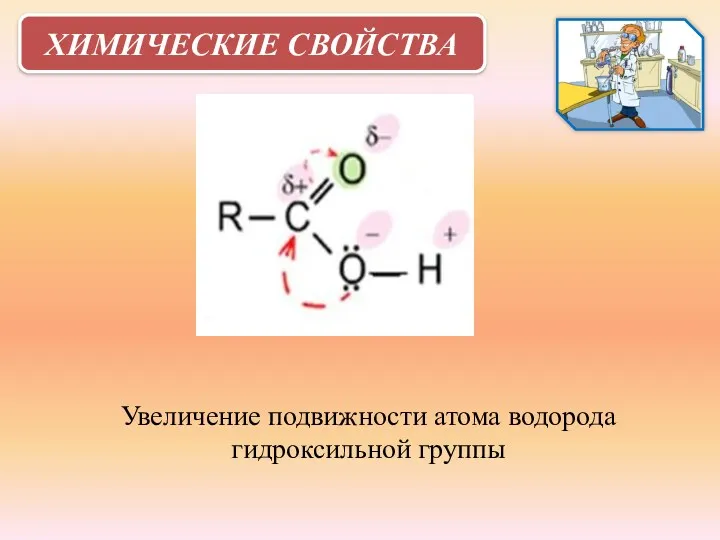
- 16. ХИМИЧЕСКИЕ СВОЙСТВА Увеличение подвижности атома водорода гидроксильной группы
- 17. ХИМИЧЕСКИЕ СВОЙСТВА Общие свойства карбоновых кислот. Вопрос: как можно обнаружить кислоту? Действие на индикатор (слабые электролиты)
- 18. ХИМИЧЕСКИЕ СВОЙСТВА 3.Взаимодействие с основными оксидами. Составьте уравнение взаимодействия оксида меди (II) с уксусной кислотой. Дайте
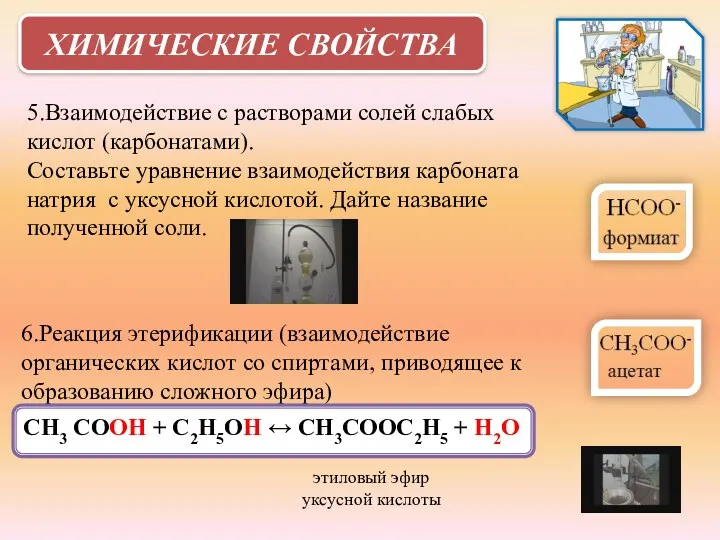
- 19. ХИМИЧЕСКИЕ СВОЙСТВА 5.Взаимодействие с растворами солей слабых кислот (карбонатами). Составьте уравнение взаимодействия карбоната натрия с уксусной
- 20. ХИМИЧЕСКИЕ СВОЙСТВА 7. Замещение в радикал (с С2) в α-положение, Ркрасн. CH3 COOH + Cl2 ?
- 21. ХИМИЧЕСКИЕ СВОЙСТВА ВЫВОД: Карбоновые кислоты сходны по химическим свойствам с неорганическими кислотами, так как способны замещать
- 22. Карбоновые кислоты Урок №25 Отдельные представители. Способы получения.
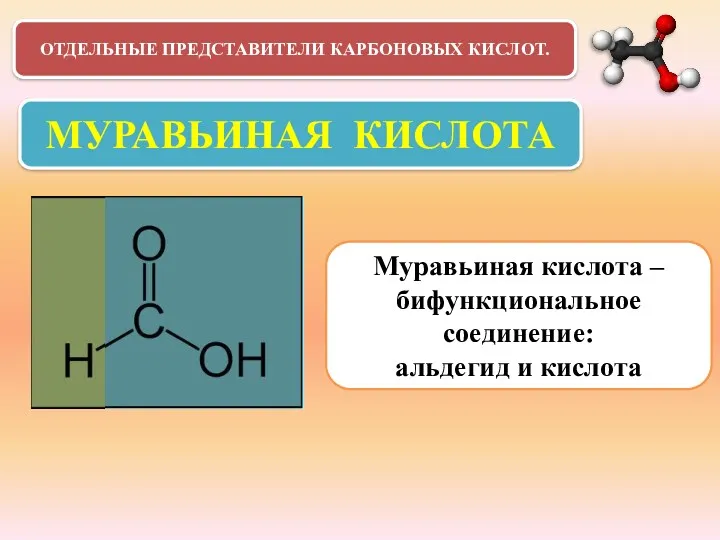
- 23. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ КАРБОНОВЫХ КИСЛОТ. МУРАВЬИНАЯ КИСЛОТА Муравьиная кислота –бифункциональное соединение: альдегид и кислота
- 24. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ КАРБОНОВЫХ КИСЛОТ. 1. Окисление оксидом серебра (реакция «серебряного зеркала») 2. Окисление раствором перманганата калия
- 25. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ КАРБОНОВЫХ КИСЛОТ. Высшие предельные кислоты (ВЖК) Соли ВЖК В жёсткой воде (Са2+) мыло утрачивает
- 26. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ КАРБОНОВЫХ КИСЛОТ. Непредельные карбоновые кислоты Присоединение будет происходить против правила Марковникова олеиновая кислота
- 27. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ КАРБОНОВЫХ КИСЛОТ. Задание: составьте уравнения присоединения к акриловой (пропеновой) кислоте: а) водорода б) брома
- 28. СПОСОБЫ ПОЛУЧЕНИЯ КАРБОНОВЫХ КИСЛОТ. Окисление алканов, спиртов, альдегидов: 2. Из солей карбоновых кислот (л/б способ)
- 30. Скачать презентацию














 Параметры токсичности продуктов горения материала. (Задача 3)
Параметры токсичности продуктов горения материала. (Задача 3) Соли, как производные кислот и оснований. Их состав и номенклатура
Соли, как производные кислот и оснований. Их состав и номенклатура Химическая связь
Химическая связь Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Строительное материаловедение. (Лекции 1-2)
Строительное материаловедение. (Лекции 1-2) Физико-химические свойства алкенов
Физико-химические свойства алкенов Промышленные типы месторождений железа
Промышленные типы месторождений железа Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах Атом. Химический элемент. Изотопы. Простые и сложные вещества
Атом. Химический элемент. Изотопы. Простые и сложные вещества Алкадиены
Алкадиены Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Коррозия и защита полимерных строительных материалов
Коррозия и защита полимерных строительных материалов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Натуральный каучук
Натуральный каучук Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ Марганец. Железо
Марганец. Железо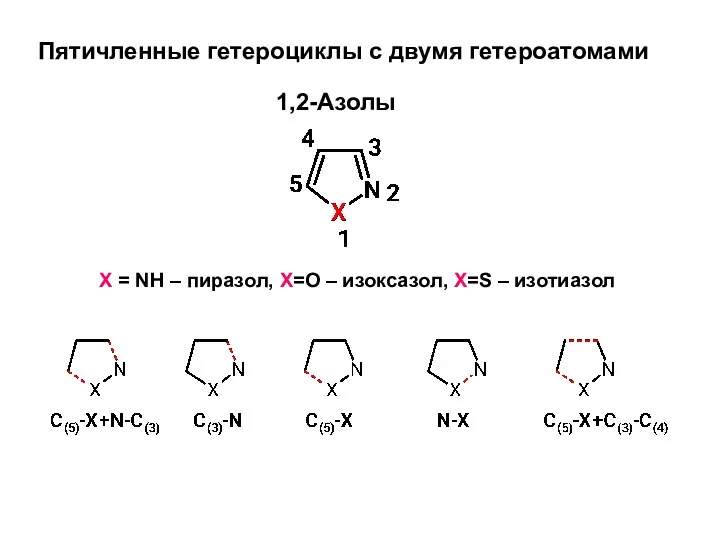 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Химический элемент цинк
Химический элемент цинк Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Классификация минералов
Классификация минералов Аминокислоты
Аминокислоты Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Химическая кинетика
Химическая кинетика Сульфидтер. Аз еруші сульфидтер
Сульфидтер. Аз еруші сульфидтер Крохмаль. Структурна формула крохмалю
Крохмаль. Структурна формула крохмалю ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли