Содержание
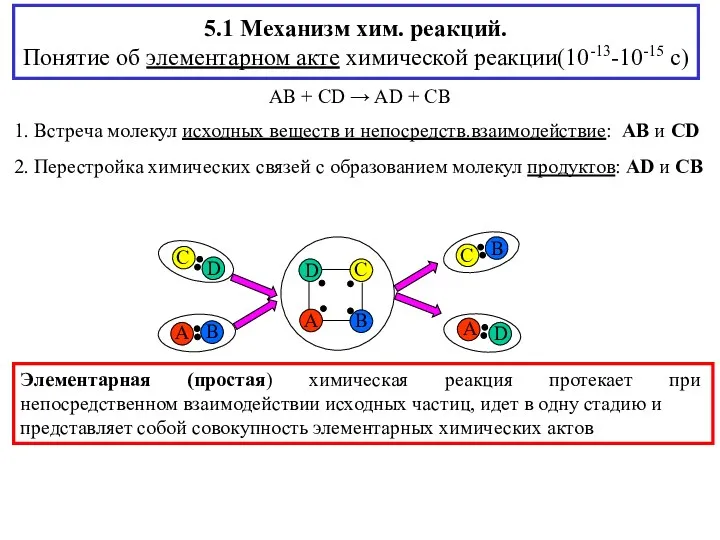
- 2. 5.1 Механизм хим. реакций. Понятие об элементарном акте химической реакции(10-13-10-15 с) AB + CD → AD
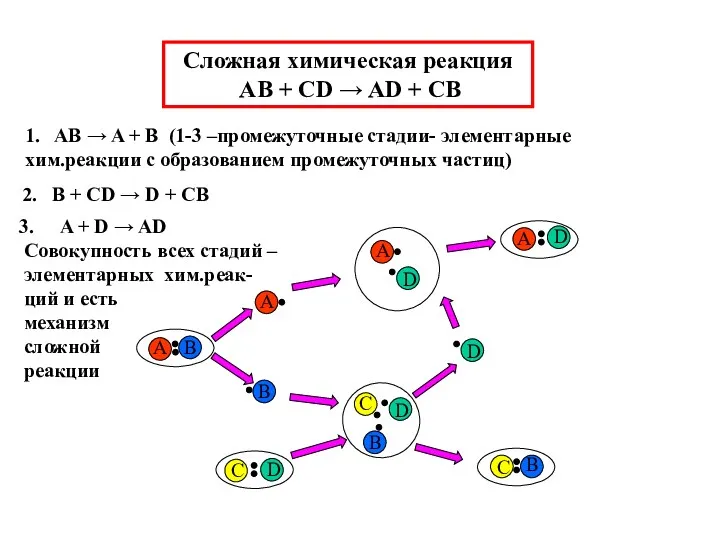
- 3. Сложная химическая реакция AB + CD → AD + CB 1. AB → A + B
- 4. Частицы, участвующие в элементарной химической реакции: Молекулы 2 NO + O2 → 2 NO2 Макромолекулы (~102
- 5. 5.2 Элементарная(одностадийная) химическая реакция-непосредственное взаимодействие исходных веществ-совокупность элементарных хим.актов νAA + νBB → νDD Понятие молекулярности
- 6. Скорость элементарной(простой) реакции число элементарных актов(r) в единицу времени t в единице реакционного объёма V (определить
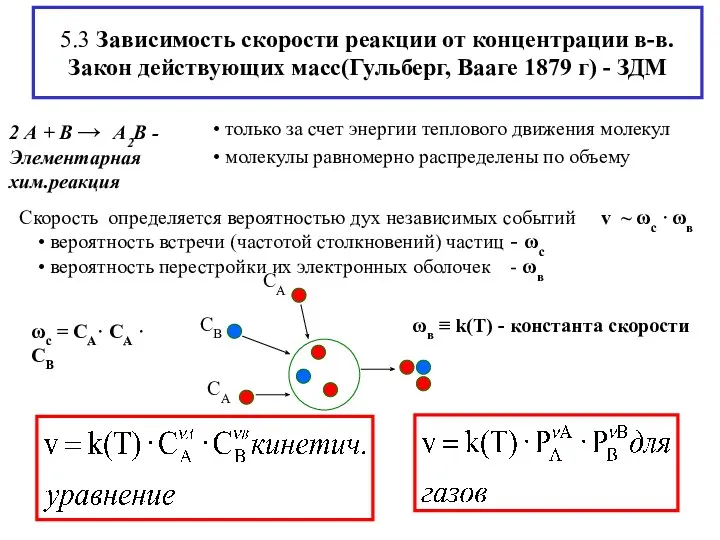
- 7. 5.3 Зависимость скорости реакции от концентрации в-в. Закон действующих масс(Гульберг, Вааге 1879 г) - ЗДМ ωс
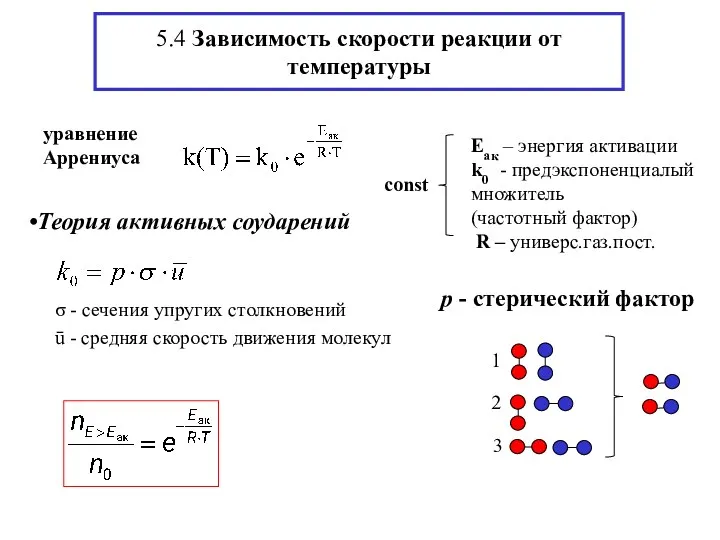
- 8. 5.4 Зависимость скорости реакции от температуры Теория активных соударений
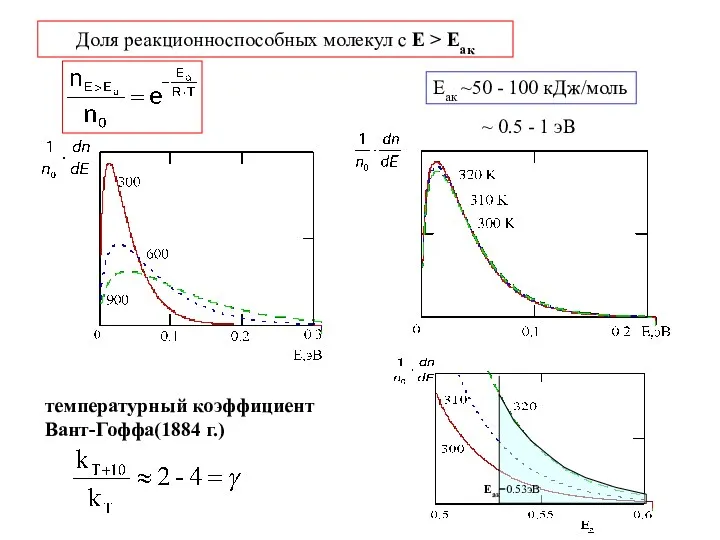
- 9. Доля реакционноспособных молекул с Е > Еак
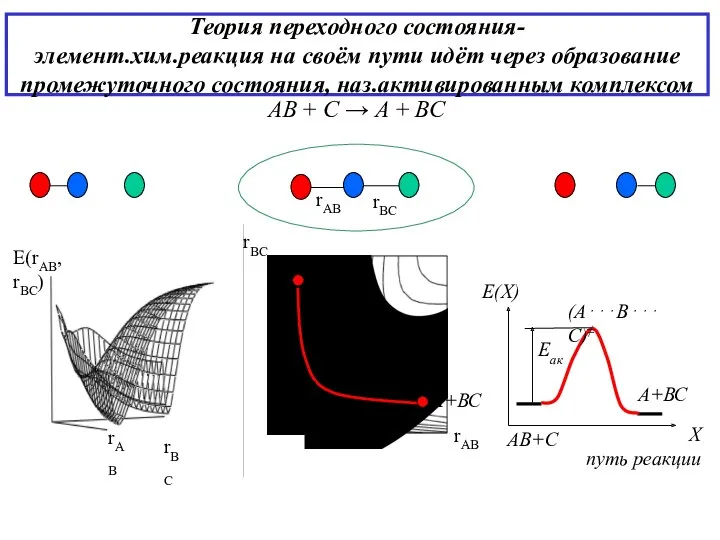
- 10. Теория переходного состояния- элемент.хим.реакция на своём пути идёт через образование промежуточного состояния, наз.активированным комплексом
- 11. 5.5 Формальная кинетика. Сложные химические реакции νAA + νBB → νDD Общая скорость сложных многостадийных реакций
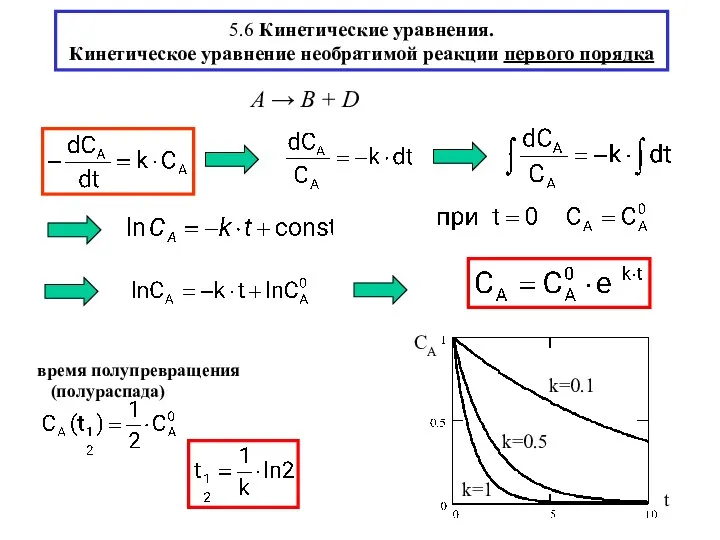
- 12. 5.6 Кинетические уравнения. Кинетическое уравнение необратимой реакции первого порядка
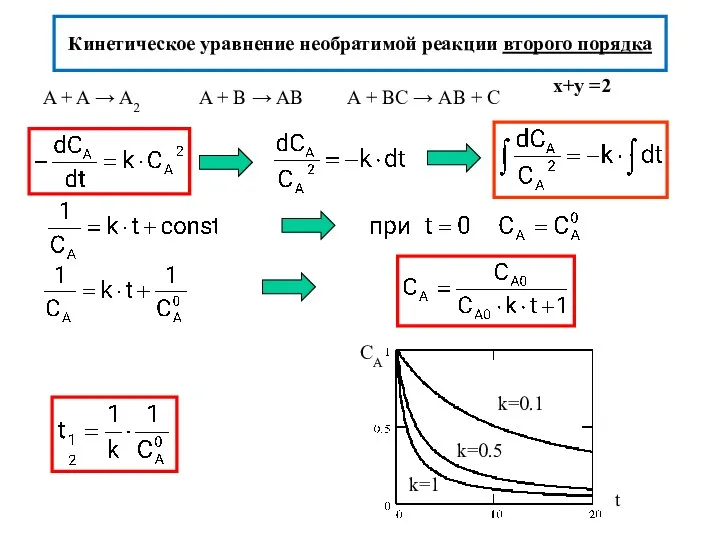
- 13. Кинетическое уравнение необратимой реакции второго порядка
- 14. 5.7 Цепной механизм химической реакции Цепные реакции(особый класс сложных многостадийных реакций) - ряд регулярно повторяющихся элементарных
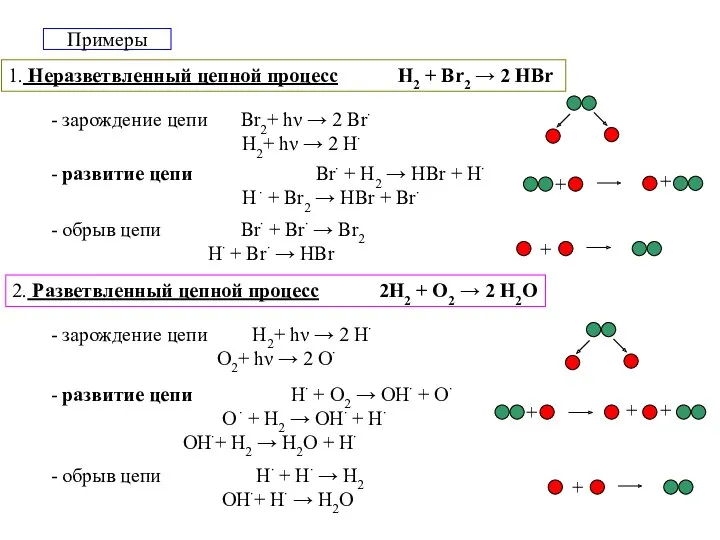
- 15. Примеры 1. Неразветвленный цепной процесс H2 + Br2 → 2 HBr 2. Разветвленный цепной процесс 2H2
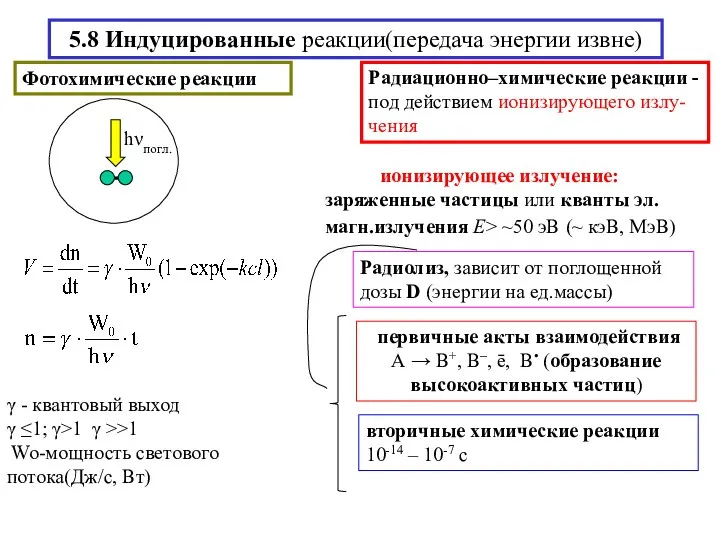
- 16. 5.8 Индуцированные реакции(передача энергии извне)
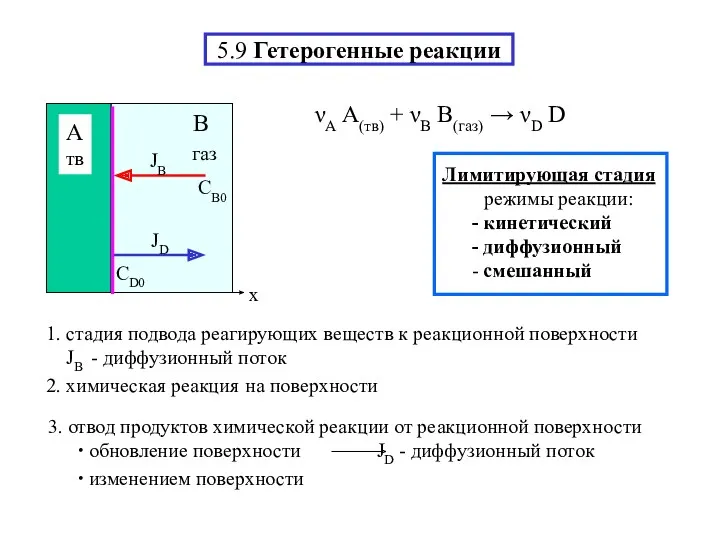
- 17. 5.9 Гетерогенные реакции νА A(тв) + νВ B(газ) → νD D 2. химическая реакция на поверхности
- 18. Диффузионный режим – З-ны диффузии (J - диффузионный поток) νА A(тв) + νВ B(газ) → νD
- 19. 5.10 Катализ ингибиторы, ферменты Гомогенный катализ – реагенты и катализатор в одной фазе А + В
- 20. Гетерогенный катализ Реагирующие вещества и катализатор находятся в разных фазах. Реакция на границе раздела фаз. А2
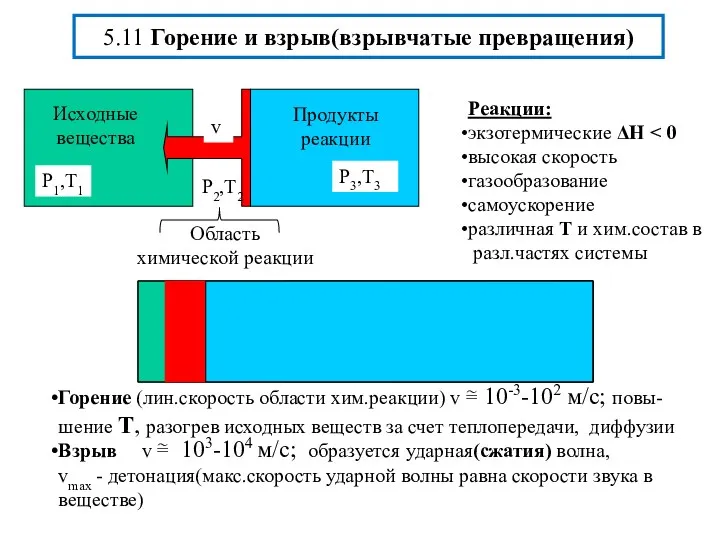
- 21. 5.11 Горение и взрыв(взрывчатые превращения)
- 23. Скачать презентацию








 Nucleic acids
Nucleic acids Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Заттардың агрегаттық күйі
Заттардың агрегаттық күйі Нефть. Состав. Свойства. Переработка
Нефть. Состав. Свойства. Переработка Относительная атомная масса
Относительная атомная масса Общая характеристика авиационных материалов, тенденции их развития
Общая характеристика авиационных материалов, тенденции их развития Газообразные вещества
Газообразные вещества Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Медь
Медь Вирощування кристалів солей
Вирощування кристалів солей Углерод и его свойства
Углерод и его свойства Сплавы и их свойства. Легирующие добавки
Сплавы и их свойства. Легирующие добавки Элементарные частицы вещества
Элементарные частицы вещества Фосфор и его соединения
Фосфор и его соединения Емдік өсімдіктерден жасалған экстракттың химиялық құрамы мен қасиеттері
Емдік өсімдіктерден жасалған экстракттың химиялық құрамы мен қасиеттері Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Растворение. Растворы
Растворение. Растворы Строение атома
Строение атома Спирты
Спирты Строение вещества. Химическая связь
Строение вещества. Химическая связь Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Теория электролитической диссоциации
Теория электролитической диссоциации Сахароза
Сахароза Азот
Азот Экспресс-методы решения задач по химии
Экспресс-методы решения задач по химии Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы