Содержание
- 2. ТИПЫ ЗАДАЧ Связь физико-химических величин (ФХВ) для 1 компонента − через количество вещества; доли. Расчеты по
- 3. ТИПЫ ЗАДАЧ Комбинированные задачи - зима Нестандартные задачи - весна
- 4. МАТЕМАТИЧЕСКИЕ АСПЕКТЫ РЕШЕНИЯ ЗАДАЧ ПО ХИМИИ -проценты, - дроби, -степени -корни, -пропорции, -уравнения, -системы, -логарифмы -углы
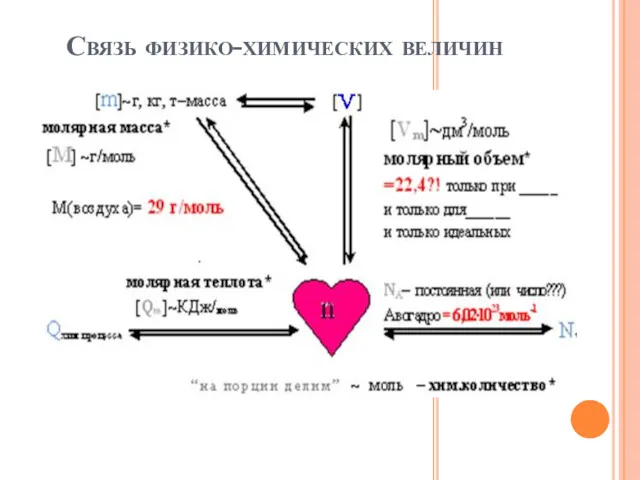
- 5. Связь физико-химических величин
- 6. P ∙ V = n ∙ R ∙ T (пора вставать на работу) - уравнение Клапейрона-Менделеева
- 7. НИ ДНЯ БЕЗ РЕШЁННОЙ ЗАДАЧИ!!! ?2 Какое число атомов содержится в 1 г алмаза? ?3Какая масса
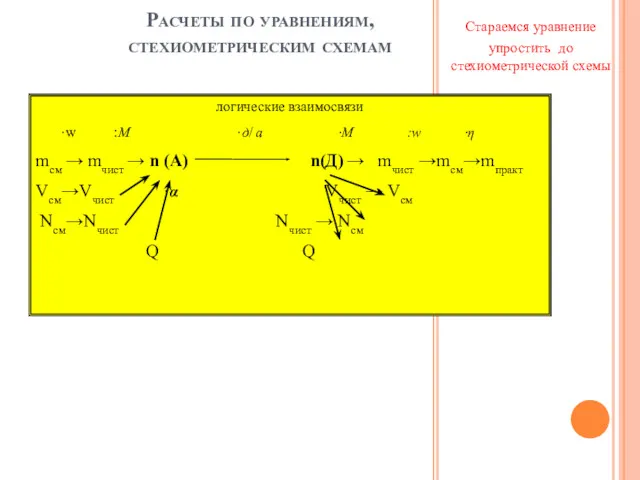
- 8. Расчеты по уравнениям, стехиометрическим схемам Стараемся уравнение упростить до стехиометрической схемы
- 9. ПЗ 1.Какая масса осадка выпадет при взаимодействии 9,8 г фосфорной кислоты с гидроксидом стронция? ПЗ 2.
- 10. ПЗ 4. Молярная теплота сгорания водорода -142,2 КДж/моль. Какой объем кислорода необходим, чтобы при сжигании водорода
- 11. ПЗ 6. Какова массовая доля серной кислоты, если в процессе ее полного взаимодействия её с оксидом
- 12. Суббота Введение в химию 15 сентября в 12-00 (501 ауд) Органическая химия 15 сентября в 10-00
- 13. СОСТАВ РАСТВОРА
- 14. РАСТВОРЫ приготовление, смешение, выпадение осадка при охлаждении Сколько воды надо добавить к 50 г 15%-ного раствора
- 15. Какую массу кристаллической соды необходимо растворить в 200 г воды, чтобы при добавлении данного раствора в
- 16. Смешали 300 г 50%-ного раствора гироксида натрия и 500 мл 20%-ного раствора (плотность 1,1 г/см3) Какова
- 17. В каком соотношении масс необходимо взять 10%-ный раствор сульфата меди и медного купороса, чтобы получить 30%-ный
- 18. Определите концентрацию раствора фосфорной кислоты, полученного сливанием 200 мл 0,3-молярного р-ра и 300 мл 0,6-молярного р-ра.
- 19. Какая масса осадка образуется при охлаждении 250 г 30%-ного раствора сульфата калия до 20 C0, если
- 20. Приготовили 200 г насыщенного при 60 0С раствора сульфата меди. Какая масса медного купороса выкристаллизуется из
- 22. Скачать презентацию

















 Состав, строение и свойства стекла и хрусталя
Состав, строение и свойства стекла и хрусталя Колоїдний захист
Колоїдний захист Свойства химических элементов и закономерность их изменения
Свойства химических элементов и закономерность их изменения Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Закон сохранения массы вещества
Закон сохранения массы вещества Электролиз
Электролиз Протолитические равновесия в растворах электролитах
Протолитические равновесия в растворах электролитах Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Производство синтетической нефти
Производство синтетической нефти Алкены. Пропилен C₃H₆
Алкены. Пропилен C₃H₆ Хімічний зв’язок. Типи хімічного зв’язку
Хімічний зв’язок. Типи хімічного зв’язку Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Азотсодержащие соединения
Азотсодержащие соединения Классификация химических реакций, протекающих с изменением состава веществ
Классификация химических реакций, протекающих с изменением состава веществ Химические свойства неорганических соединений
Химические свойства неорганических соединений Виды химической связи
Виды химической связи Общая характеристика неметаллов
Общая характеристика неметаллов p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Соединения железа
Соединения железа Химическая связь
Химическая связь Карбоновые кислоты
Карбоновые кислоты Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Открытие бензола
Открытие бензола Водород. Положение в периодической системе
Водород. Положение в периодической системе Лихеоиндикация. Экологические аспекты переработки полимеров
Лихеоиндикация. Экологические аспекты переработки полимеров Чистые вещества и смеси
Чистые вещества и смеси