Содержание
- 2. Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями: Порядковый номер, номер периода ,
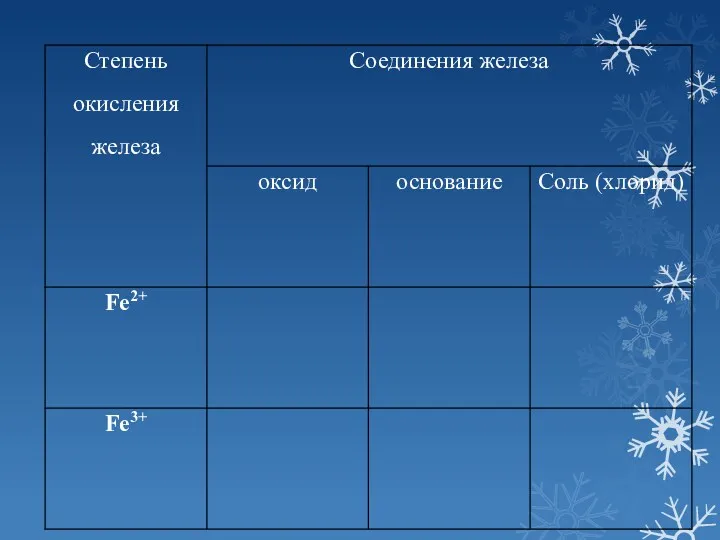
- 4. СЕГОДНЯ НА УРОКЕ: 1. Оксиды и гидроксиды железа +2 и +3, их характер 2. Получение гидроксидов
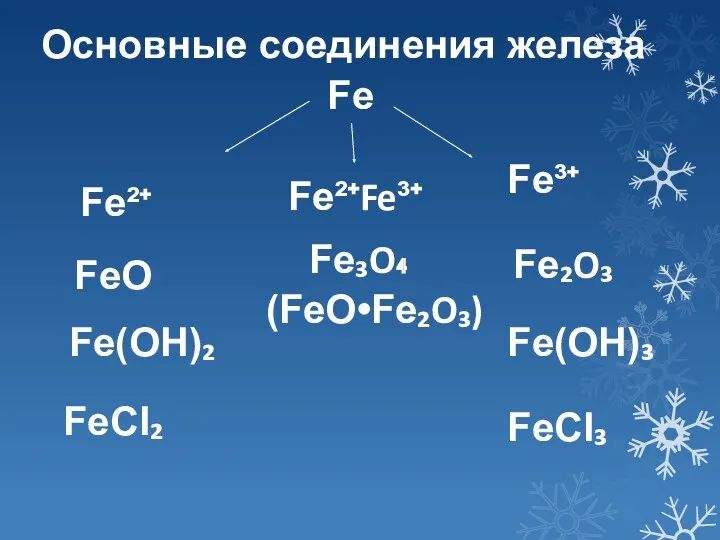
- 6. Fe Fe²⁺ Fe³⁺ FeO Fe(OH)₂ FeCI₂ Fe₂O₃ Fe(OH)₃ FeCI₃ Основные соединения железа Fe²⁺Fe³⁺ Fe₃O₄ (FeO•Fe₂O₃)
- 7. Экспериментальная Соблюдайте ПТБ!
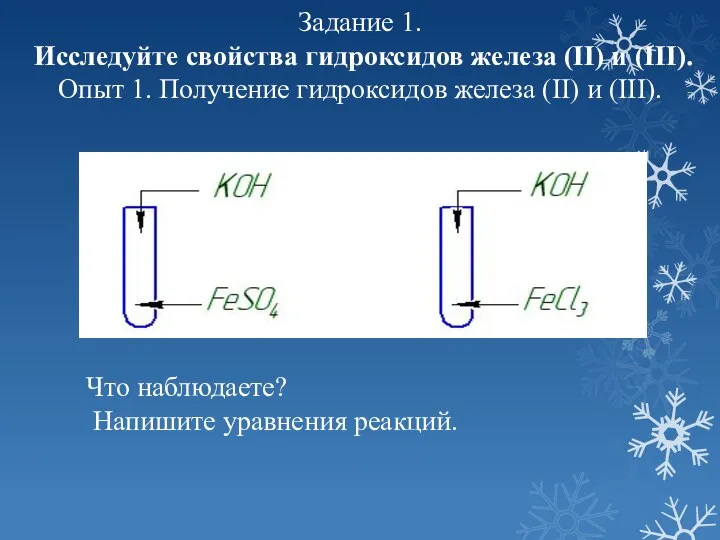
- 8. Задание 1. Исследуйте свойства гидроксидов железа (II) и (III). Опыт 1. Получение гидроксидов железа (II) и
- 9. Получение гидроксидов железа FeSO4 + 2NaOH = Fe(OH)₂↓ +2NaCI FeCI₃ + 3NaOH = Fe(OH)₃↓ + 3NaCI
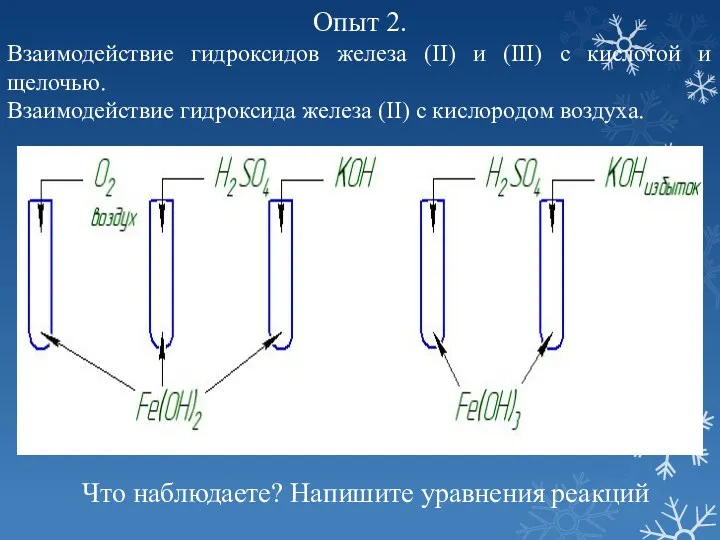
- 10. Опыт 2. Взаимодействие гидроксидов железа (II) и (III) с кислотой и щелочью. Взаимодействие гидроксида железа (II)
- 11. Качественные реакции на ионы Fe²⁺ и Fe³⁺ Fe³⁺ реактив – роданид калия KSCN Fe³⁺ реактив –
- 12. Биологическая Железо входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо -белковых комплексов, которые
- 13. Токсичность железа Избыточная доза железа – 200мг и выше может вызвать отравление Железо занимает 5 –е
- 14. Генетические связи Fe ПРОЙДИТЕ, СОСТАВИВ СООТВЕТСТВУЮЩУЮ СХЕМУ РЕАКЦИЙ, ОТ ОДНОГО УКАЗАННОГО В ЗАДАНИИ ВЕЩЕСТВА К ДРУГОМУ:
- 15. СЕГОДНЯ Я УЗНАЛ… Я УДИВИЛСЯ… ТЕПЕРЬ Я УМЕЮ… Я ХОТЕЛ БЫ…
- 17. Скачать презентацию










 Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Виды коррозии
Виды коррозии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Нуклеин қышқылдары
Нуклеин қышқылдары Ртуть. Использование ртути
Ртуть. Использование ртути Художественная обработка камня
Художественная обработка камня Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Кристаллическое состояние вещества
Кристаллическое состояние вещества Биохимия нуклеиновых кислот
Биохимия нуклеиновых кислот Химические чистящие средства
Химические чистящие средства Химические вещества как строительные и поделочные материалы
Химические вещества как строительные и поделочные материалы Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9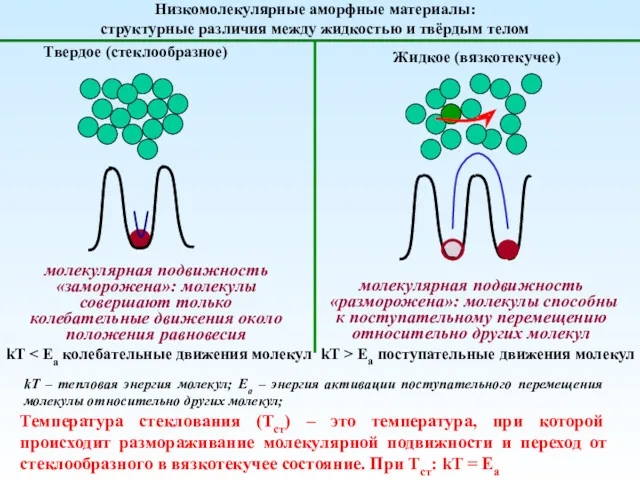 Механика полимеров
Механика полимеров Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Химические реакции. Условия необходимые для протекания химических реакций?
Химические реакции. Условия необходимые для протекания химических реакций? Петрография
Петрография Смоги и их влияние на человека
Смоги и их влияние на человека Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Качественные реакции на функциональные группы. Классификация функциональных групп
Качественные реакции на функциональные группы. Классификация функциональных групп Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Металлы. Общая характеристика
Металлы. Общая характеристика Минералогия литофильных редких элементов. Бор
Минералогия литофильных редких элементов. Бор Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД)