Содержание
- 2. Функциональная группа – это атом или группа атомов неуглеводородного характера, которые определяют принад-лежность соединения к определённому
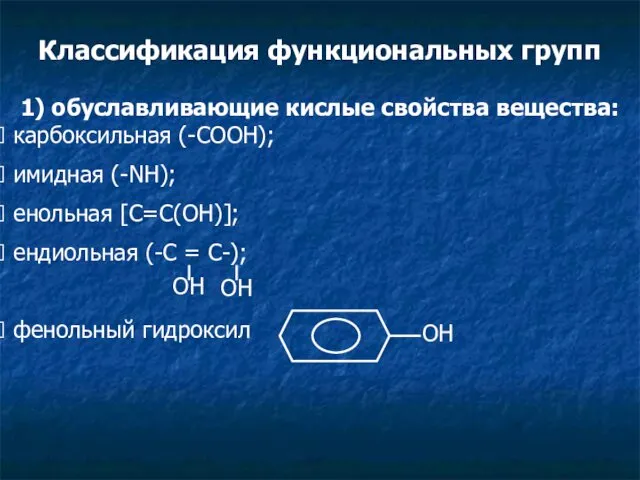
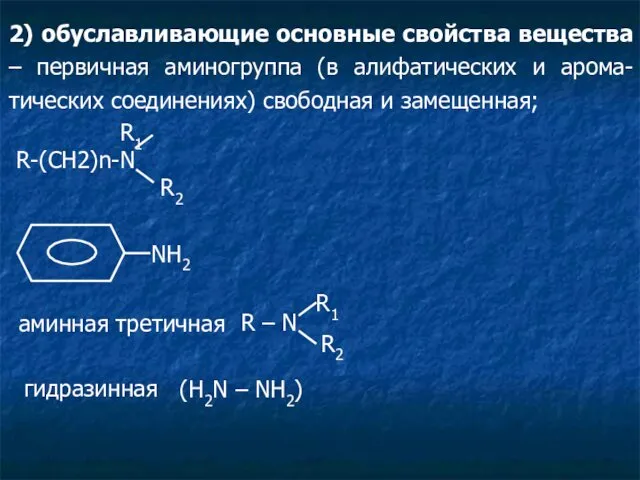
- 3. Классификация функциональных групп 1) обуславливающие кислые свойства вещества: карбоксильная (-СООН); имидная (-NH); енольная [C=C(OH)]; ендиольная (-С
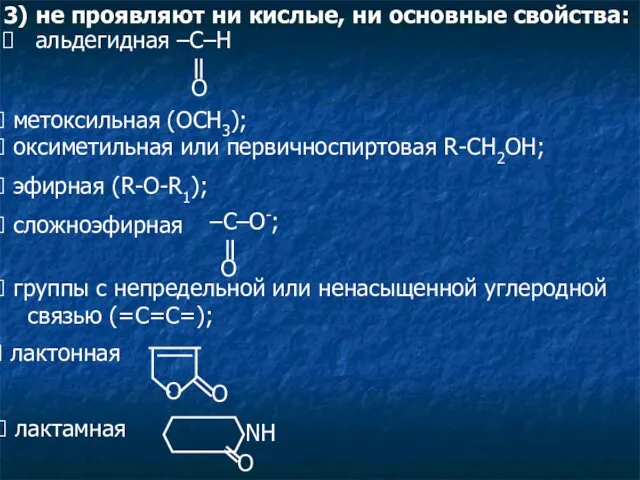
- 5. 3) не проявляют ни кислые, ни основные свойства: метоксильная (ОСН3); оксиметильная или первичноспиртовая R-CH2OH; эфирная (R-O-R1);
- 6. C2H5OH + CH3COOH C2H5О – C – CH3 + H2O КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ФУНКЦИОНАЛЬНЫЕ ГРУППЫ I.
- 7. II. Гидроксильная группа – фенольная. Лекарственные средства, содержащие фено-льную группу: салициловая кислота; ацетилсалициловая кислота; салицилат натрия;
- 8. III. Карбонильная группа – альдегидная. Лекарственные средства: глюкоза; раствор формальдегида. Реакция «серебряного зеркала» AgNO3 + 3NH4OH
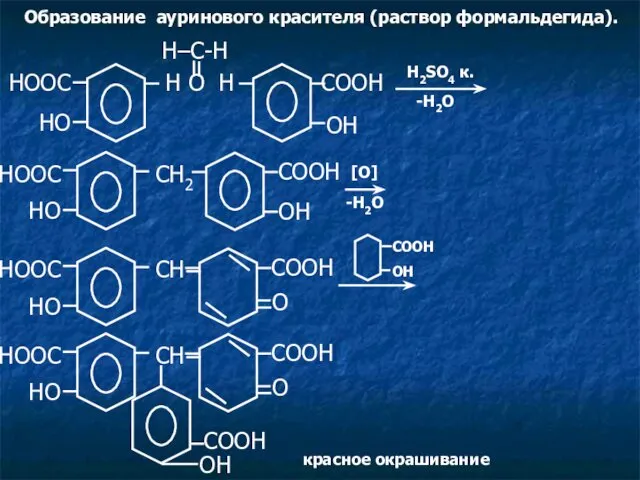
- 9. Образование ауринового красителя (раствор формальдегида). HOOC CH HO O COOH OH COOH красное окрашивание
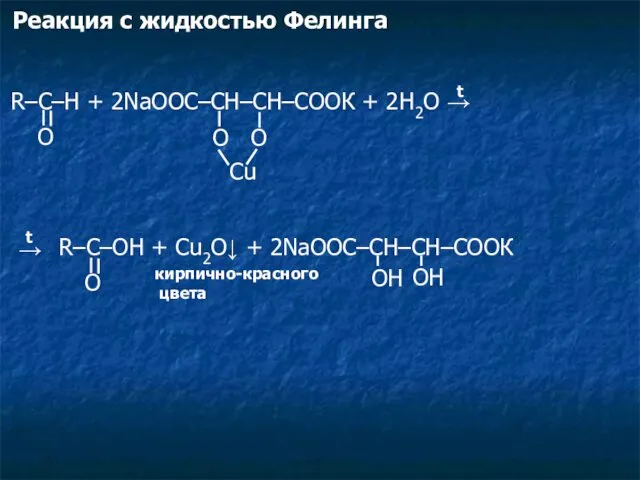
- 10. Реакция с жидкостью Фелинга R–C–H + 2NaOOC–CH–CH–COOК + 2H2O → O O O Cu t O
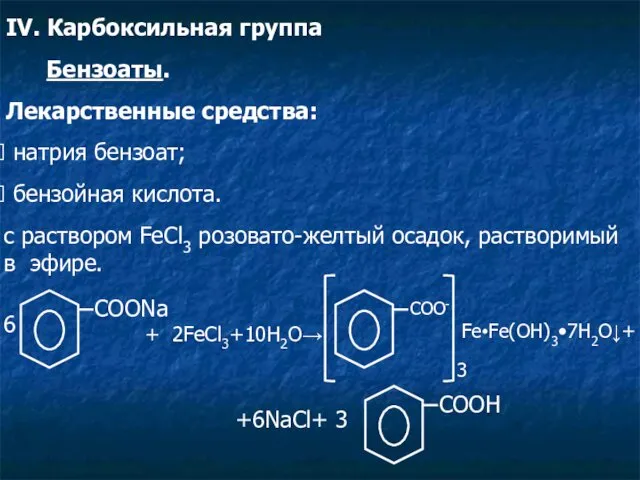
- 11. IV. Карбоксильная группа Бензоаты. Лекарственные средства: натрия бензоат; бензойная кислота. c раствором FeCl3 розовато-желтый осадок, растворимый
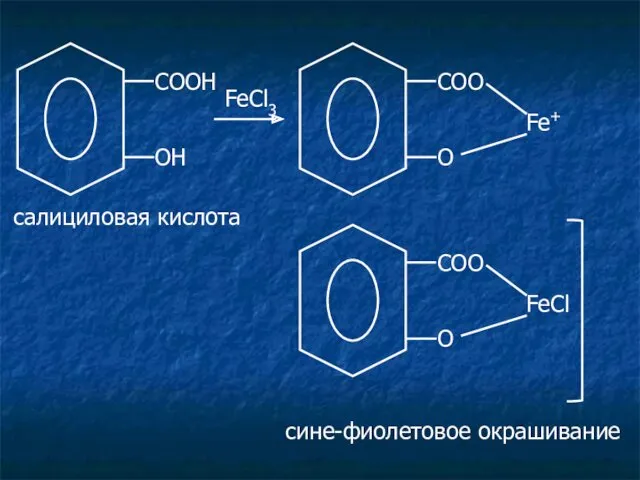
- 12. Салицилаты. Лекарственные средства: салициловая кислота; натрия салицилат. c раствором FeCl3 появляется сине-фиолетовое или красное окрашивание, сохраняется
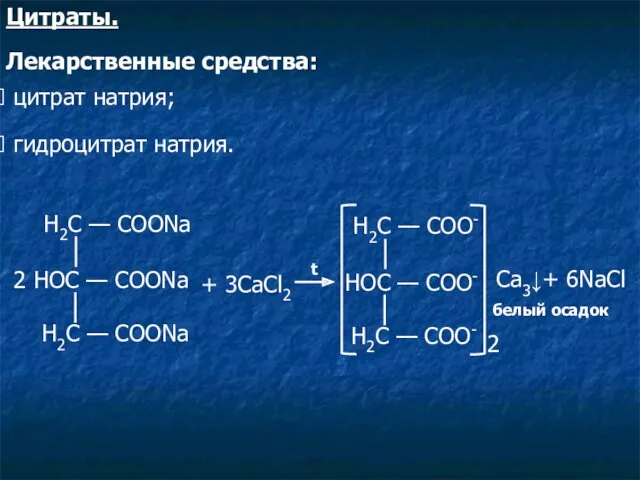
- 14. Н2С — СООNa 2 НOС — СООNa Н2С — СООNa + 3CaCl2 t Н2С — СОО-
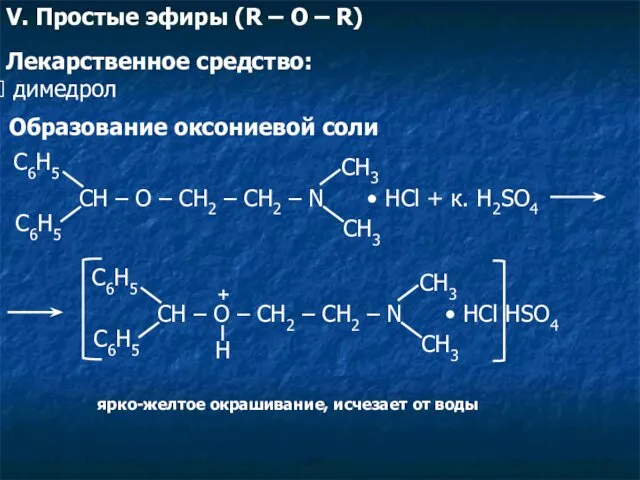
- 15. V. Простые эфиры (R – O – R) Лекарственное средство: димедрол Образование оксониевой соли CH –
- 16. VI. Амины ароматические первичные (R – NH2) Лекарственные средства: анестезин; новокаин; стрептоцид; норсульфазол; сульфацил натрия; натрия
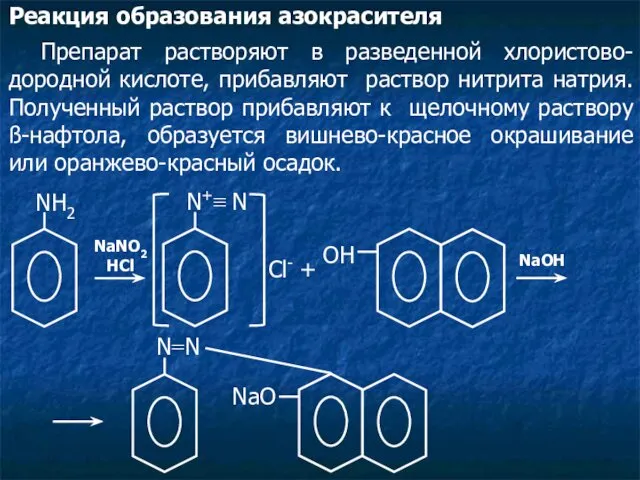
- 17. Реакция образования азокрасителя Препарат растворяют в разведенной хлористово-дородной кислоте, прибавляют раствор нитрита натрия. Полученный раствор прибавляют
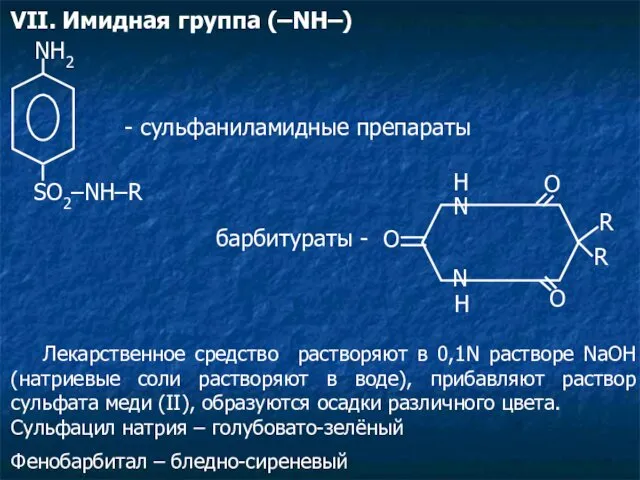
- 18. VII. Имидная группа (–NH–) NH2 SO2–NH–R - сульфаниламидные препараты O N N O R R O
- 19. МЕТОД НЕВОДНОГО ТИТРОВАНИЯ Классификация растворителей Амфитропные или амфотерные: H2O, CH3OH, C2H5OH и другие. Эти растворители играют
- 20. 3) Протофильные или основные: NH3, H2N-NH2, H2N(CH2)2NH2, HCON(CH3)2 и другие вещества основного характера. Молекулы протофильных растворителей
- 21. Преимущество метода кислотно-основного титрования в неводных средах состоит и в том, что он позволяет определять соли
- 22. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ОСНОВАНИЙ И ИХ СОЛЕЙ. HClO4 + CH3COOH → ClO4- + CH3COOH2+ кислота основание ион
- 23. Реакция нейтрализации сопровождается образо-ванием молекул того растворителя, в среде которого протекает данная реакция. 1) HClO4 +
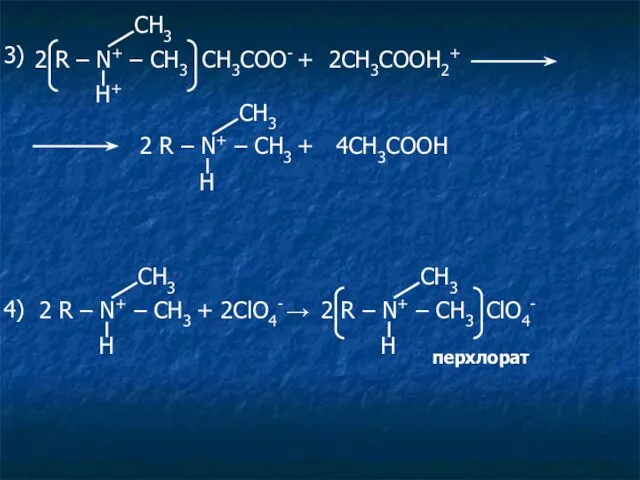
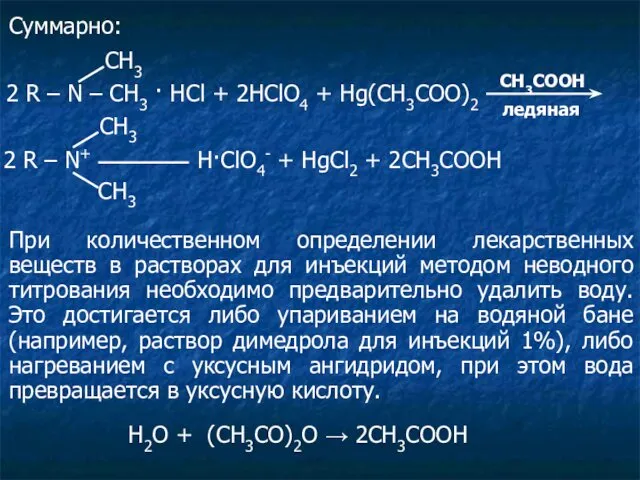
- 24. 2 R – N+ – CH3 CH3COO- + 2CH3COOH2+ Н+ СН3 3) Н СН3 2 R
- 25. Суммарно: 2 R – N – CH3 · HCl + 2HClO4 + Hg(CH3COO)2 СН3 CH3COOH ледяная
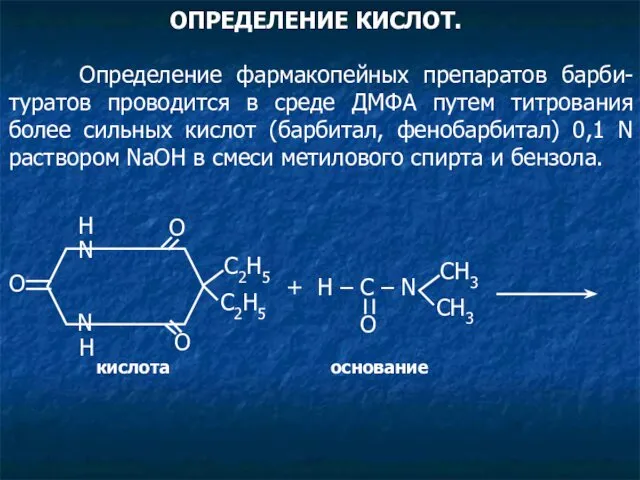
- 26. ОПРЕДЕЛЕНИЕ КИСЛОТ. Определение фармакопейных препаратов барби-туратов проводится в среде ДМФА путем титрования более сильных кислот (барбитал,
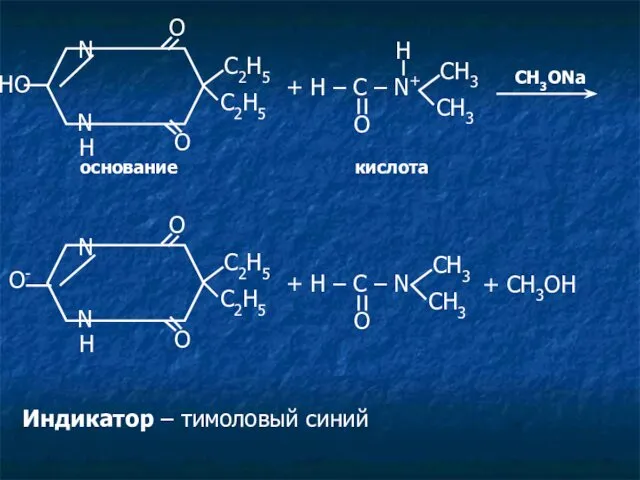
- 27. HO N N O С2Н5 O H С2Н5 + H – C – N+ O СН3
- 29. Скачать презентацию











 Номенклатура органических веществ
Номенклатура органических веществ Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Целлюлоза. Строение
Целлюлоза. Строение Водородная связь
Водородная связь Автомобильные бензины
Автомобильные бензины Химиялық элемент оттегі
Химиялық элемент оттегі Химические свойства солей
Химические свойства солей Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма)
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма) Карбоновые кислоты
Карбоновые кислоты Коллоидные ПАВ
Коллоидные ПАВ Топливо. Классификация
Топливо. Классификация Минералды тыңайтқыштар
Минералды тыңайтқыштар Кремний и его соединения
Кремний и его соединения Оксиды и гидроксиды
Оксиды и гидроксиды Алюминий и его сплавы
Алюминий и его сплавы Классификация опасных грузов
Классификация опасных грузов Stirring in liquid media
Stirring in liquid media Смещение химического равновесия
Смещение химического равновесия Аминокислоты
Аминокислоты Степень окисления. Подготовка к контрольной работе
Степень окисления. Подготовка к контрольной работе La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons
La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Уход за волосами
Уход за волосами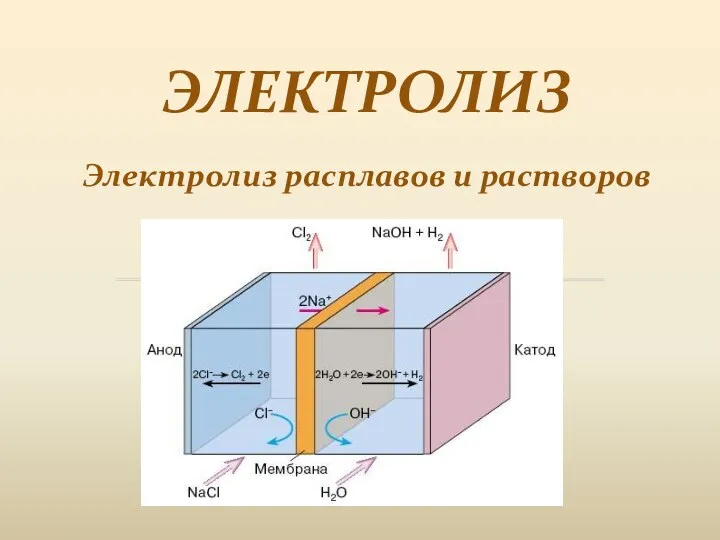 Электролиз. Электролиз расплавов и растворов
Электролиз. Электролиз расплавов и растворов