Содержание
- 2. Ответьте на вопросы: 1) Где находится кремний в таблице Д. И. Менделеева? 2) Какое строение имеет
- 3. Кремний: 1) Элемент 3-го периода IV группы главной подгруппы. 2) Si +14 )2)8)4 1s²2s²2p63s²3p² 3) Содержание
- 4. Химические свойства кремния: 1) С кислородом: Si + O2 → SiO2 2) С металлами: Si +
- 5. Оксид кремния (IV): Второе название – кремнезем; Кристаллический кремнезем существует в виде минерала кварца и его
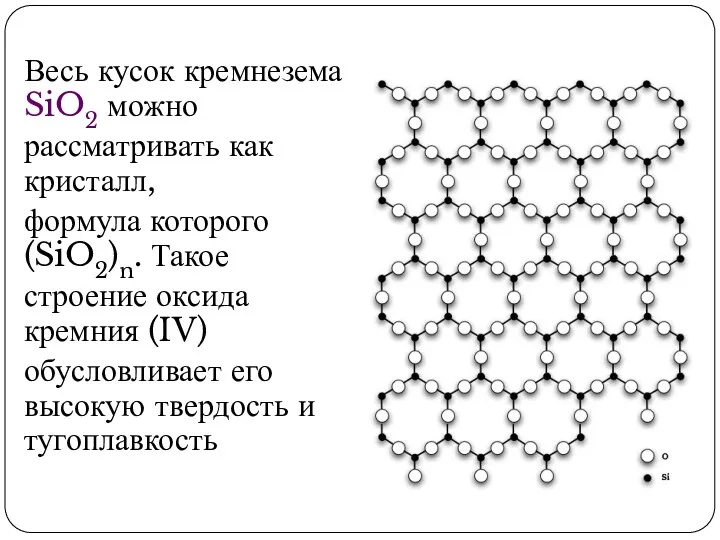
- 6. Весь кусок кремнезема SiO2 можно рассматривать как кристалл, формула которого (SiO2)n. Такое строение оксида кремния (IV)
- 7. Химические свойства оксида кремния (IV): Относится к кислотным оксидам: 1. При сплавлении его с твердыми щелочами,
- 8. 2. Реагирует со щелочами в растворе (образует ортосиликаты). SiO2 + 4NaOH ?Na4SiO4+ 2H2O 3. Взаимодействует только
- 9. Кремниевая кислота и ее соли: H2SiO3 — кислота очень слабая, в воде мало растворима. Соли –
- 10. Применение кремния и его соединений: сырьё для металлургических производств. карборунд по твердости уступает лишь алмазу, его
- 11. Соединения кремния в живой природе Дают Прочность стеблям растений Защитные покровы животным Гладкость и прочность костям
- 12. Цветное стекло получают при помощи добавления в стекло оксидов металлов: Железистые соединения окрашивают стекло в цвета
- 14. Скачать презентацию










 Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах
Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах Рідкі кристали
Рідкі кристали 20230205_okislitelno-vosstanovitelnye_reaktsii
20230205_okislitelno-vosstanovitelnye_reaktsii Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості 20230306_oksidy
20230306_oksidy Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Аммиак. Физические и химические свойства аммиака
Аммиак. Физические и химические свойства аммиака Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения? Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Растворы. Концентрация растворов
Растворы. Концентрация растворов Соли как производные кислот и оснований
Соли как производные кислот и оснований Водород. Свойства водорода
Водород. Свойства водорода Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Аммиак
Аммиак Суды тазарту әдістері
Суды тазарту әдістері Основания
Основания Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Одноосновные ненасыщенные кислоты
Одноосновные ненасыщенные кислоты Периодическая таблица химических элементов
Периодическая таблица химических элементов Оксиды. Определение
Оксиды. Определение Производство чугуна и стали
Производство чугуна и стали Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Тепловой эффект химической реакции
Тепловой эффект химической реакции Значення хімічних процесів у природі
Значення хімічних процесів у природі Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі