Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості презентация
Содержание
- 2. Мета. Поглибити уявлення про гомологічні ряди вуглеводнів – алкани, алкени, алкіни, арени. Ознайомити з природою кратного
- 3. Види сполучень атомів Карбону між собою 1. Сполучення простими ковалентними зв’язками: – С – С –
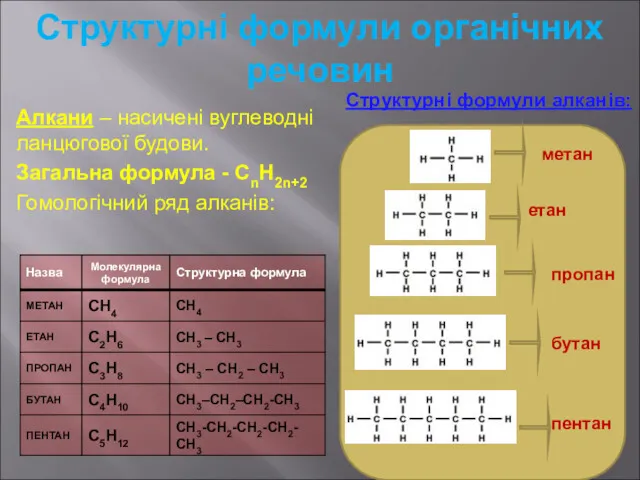
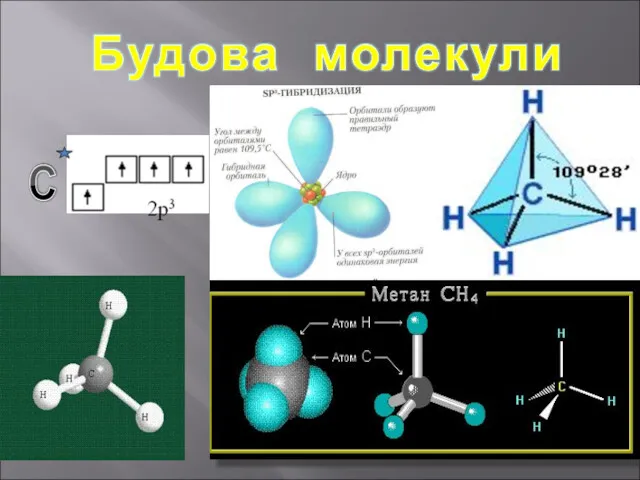
- 4. Структурні формули органічних речовин Алкани – насичені вуглеводні ланцюгової будови. Загальна формула - СnH2n+2 Гомологічний ряд
- 6. Фізичні властивості метану: Метан (СН4) - газ; без кольору; без запаху; майже не розчиняється у воді;
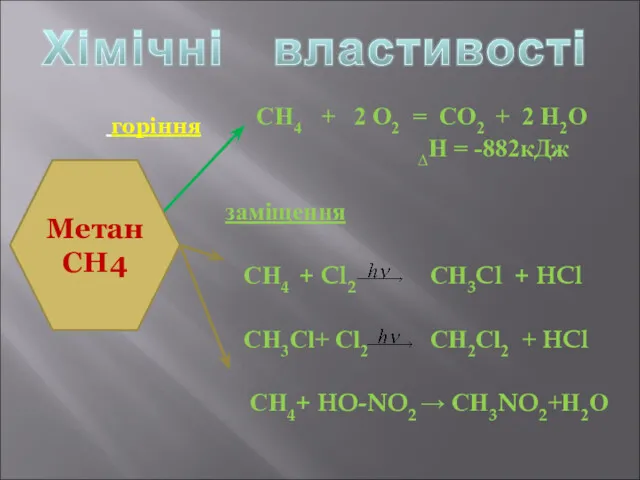
- 7. СН4 + 2 О2 = СО2 + 2 Н2О ∆Н = -882кДж заміщення СН4 + Cl2
- 8. Ненасичені вуглеводні – органічні сполуки, що мають кратні зв’язки між атомами Карбону (подвійні – С =
- 9. загальна формула кратні зв'язки тип гібридизації кут між напрямами зв'язку Алкени Алкіни CnH2n CnH2n-2 sp2 sp
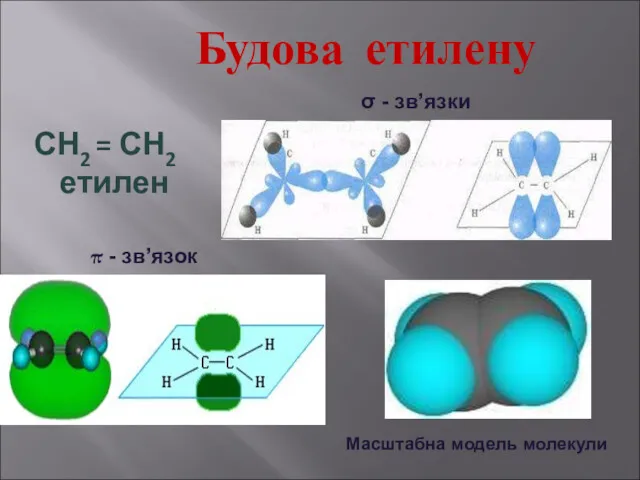
- 10. Будова етилену СН2 = СН2 етилен σ - зв’язки π - зв’язок Масштабна модель молекули
- 11. Фізичні властивості етилену С2Н4 безбарвний газ; добре розчинний в органічних розчинниках; tплавл = - 169,2 ̊С;
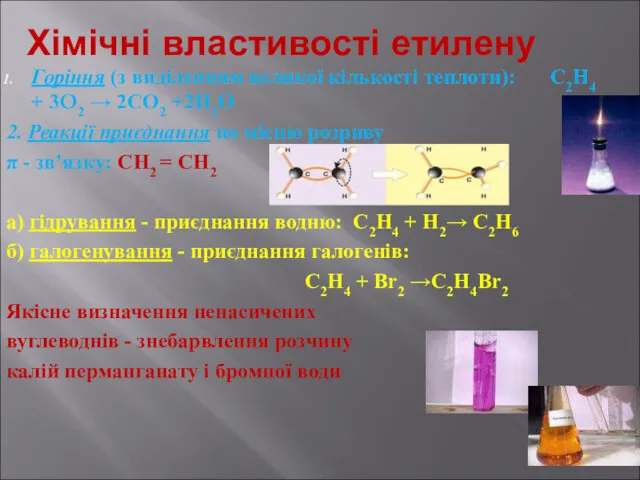
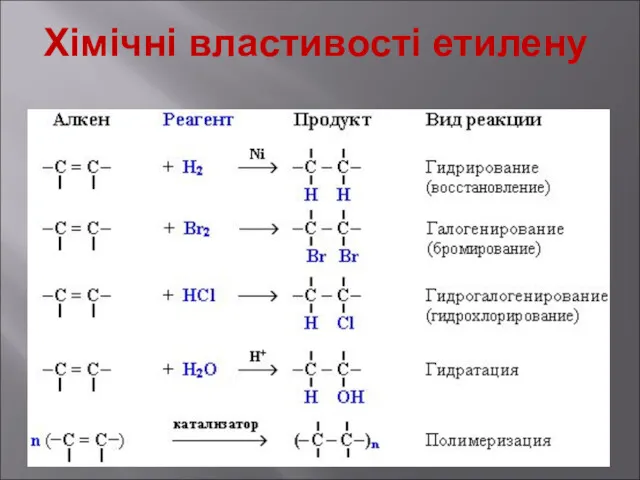
- 12. Хімічні властивості етилену Горіння (з виділенням великої кількості теплоти): С2Н4 + 3O2 → 2СО2 +2Н2О 2.
- 13. Хімічні властивості етилену
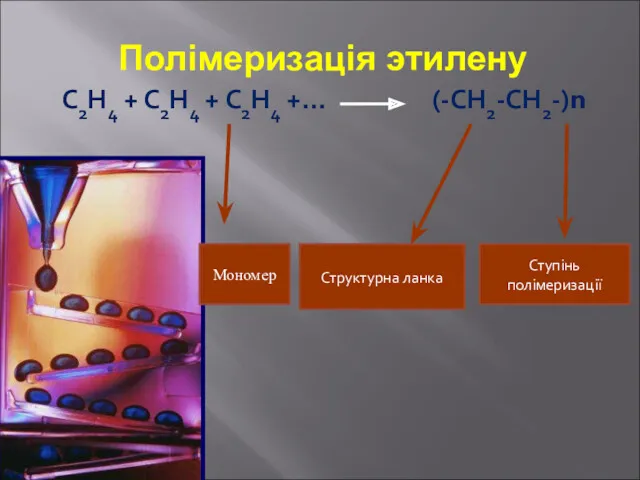
- 14. Полімеризація этилену С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n Структурна ланка Ступінь полімеризації Мономер
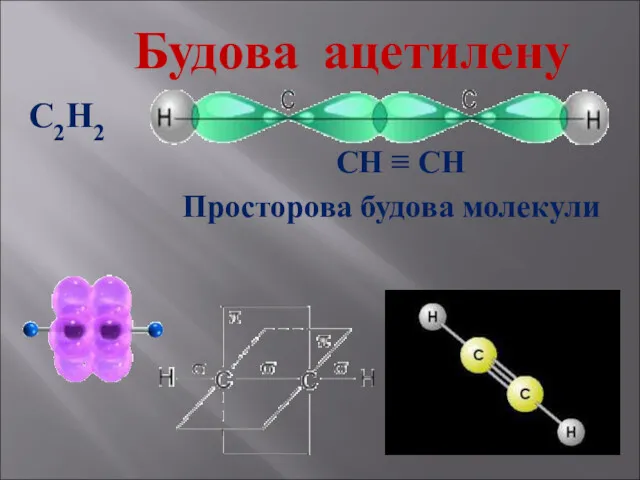
- 15. Будова ацетилену С2Н2 СН ≡ СН Просторова будова молекули
- 16. Фізичні властивості С2Н2 безбарвний газ; майже без запаху; малорозчинний у воді, але під тиском добре розчиняється
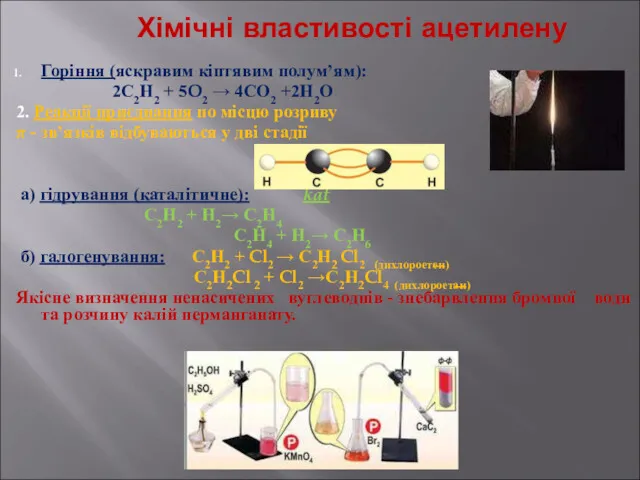
- 17. Хімічні властивості ацетилену Горіння (яскравим кіптявим полум’ям): 2С2Н2 + 5O2 → 4СО2 +2Н2О 2. Реакції приєднання
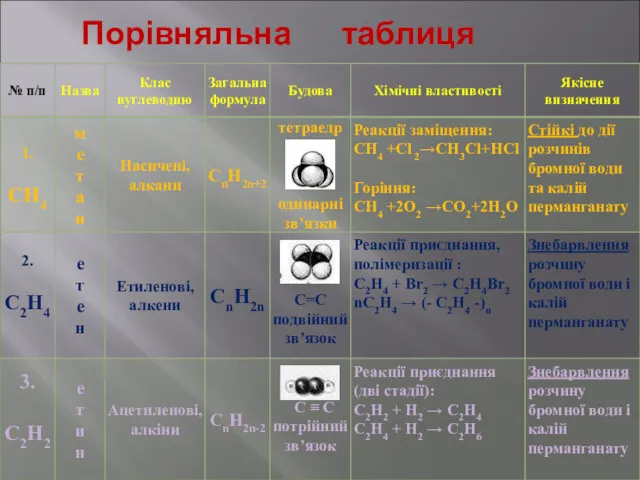
- 18. Порівняльна таблиця
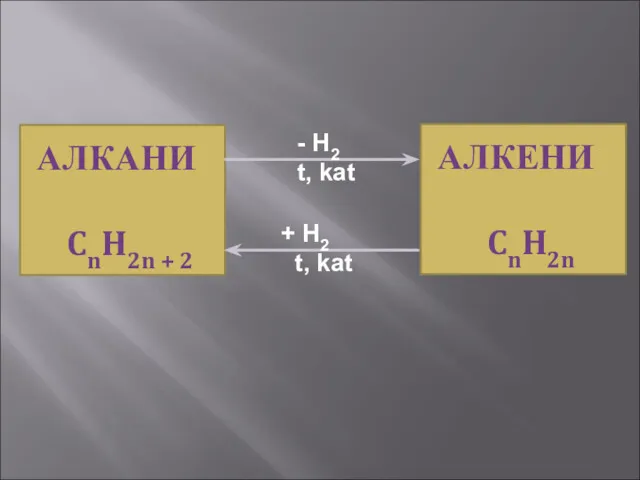
- 19. АЛКАНИ CnH2n + 2 H2 t, kat + H2 t, kat АЛКЕНИ CnH2n
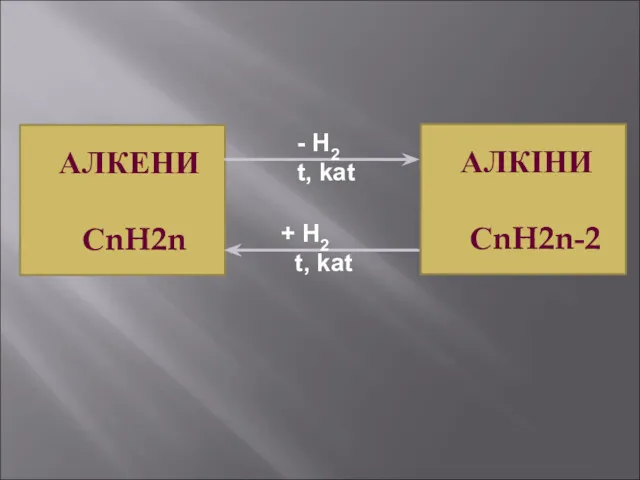
- 20. АЛКЕНИ СnH2n H2 t, kat + H2 t, kat АЛКІНИ СnH2n-2
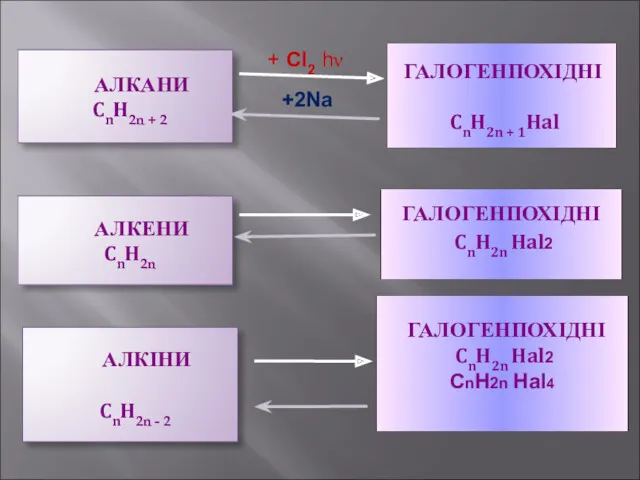
- 21. АЛКАНИ CnH2n + 2 + Cl2 hν +2Na АЛКЕНИ CnH2n АЛКІНИ CnH2n - 2
- 22. Ароматичні вуглеводні Структурна формула бензену Арени – ненасичені вуглеводні із загальною формулою CnH2n-6, молекули яких, містять
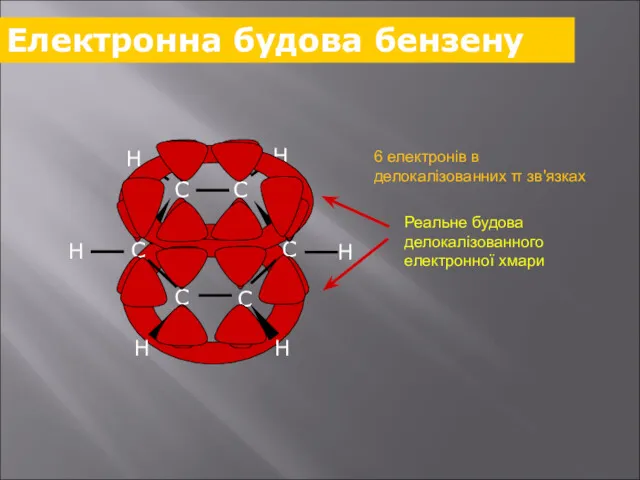
- 23. Електронна будова бензену 6 електронів в делокалізованних π зв'язках
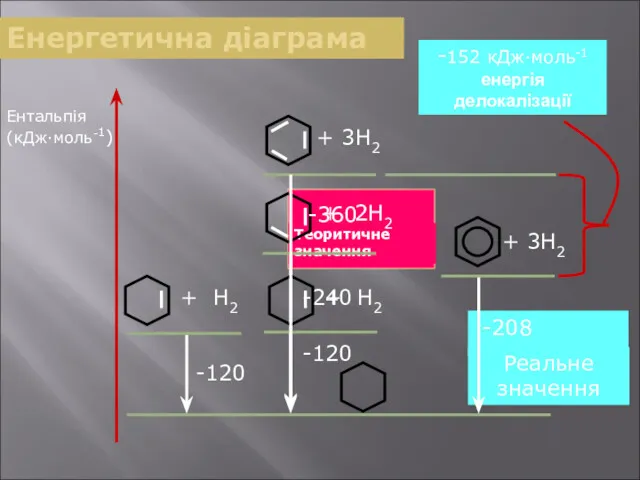
- 24. Енергетична діаграма Ентальпія (кДж∙моль-1) -120 -208 -152 кДж∙моль-1 енергія делокалізації
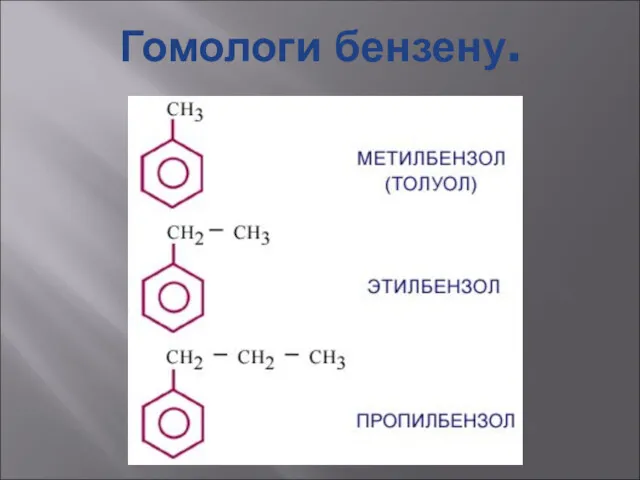
- 25. Гомологи бензену.
- 26. Отримання бензену. Бензен є першим представником аренів. Його можна отримати трімерізаціей ацетилену. Бензол отримують при переробці
- 27. Физические свойства бензола. Бензен: безбарвна рідина, з різким характерним запахом, легше води, розчиняється у воді, розчинний
- 28. Химические свойства бензола. Бензол горить. Полум'я бензолу кіптяве з-за високого вмісту карбону в молекулі. Через особливого
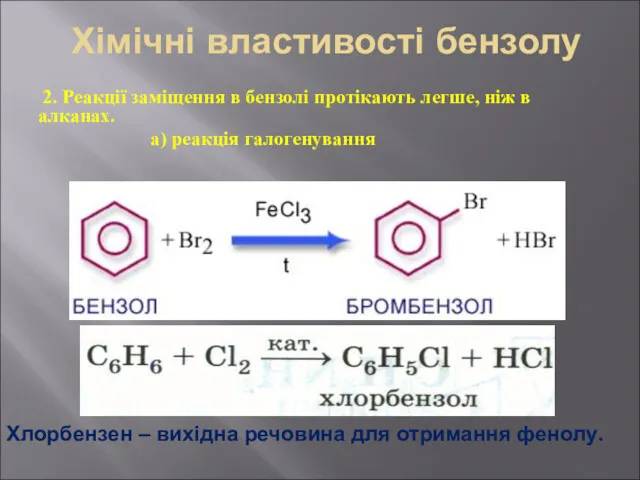
- 29. Хімічні властивості бензолу 2. Реакції заміщення в бензолі протікають легше, ніж в алканах. а) реакція галогенування
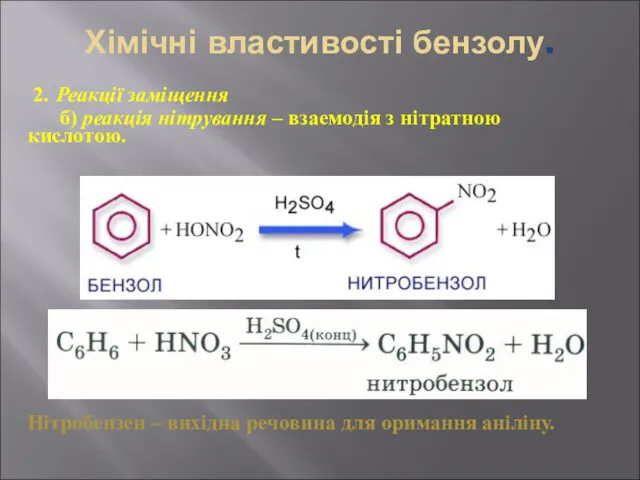
- 30. Хімічні властивості бензолу. 2. Реакції заміщення б) реакція нітрування – взаемодія з нітратною кислотою. Нітробензен –
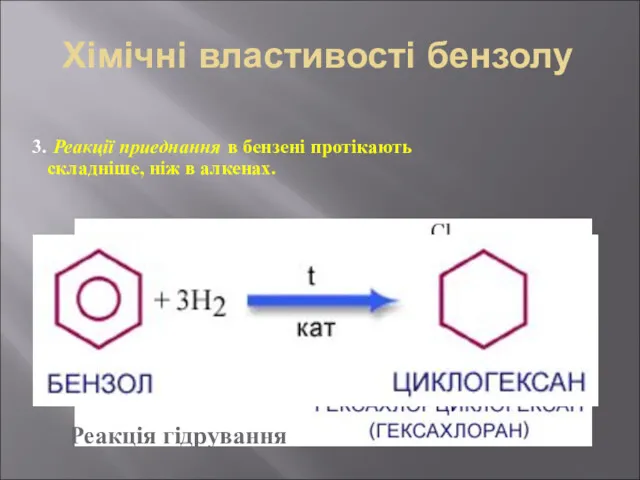
- 31. Хімічні властивості бензолу 3. Реакції приеднання в бензені протікають складніше, ніж в алкенах. Реакція гідрування
- 32. Хімічні властивості бензолу Незважаючи на високу ненасиченість молекули бензолу (за складом), він не дає характерних, якісних
- 34. Скачать презентацию












 Аминокислоты. Производные карбоновых кислот,
Аминокислоты. Производные карбоновых кислот, Materials. Metals non-metals
Materials. Metals non-metals Строение атома
Строение атома Строение и свойства металлов Физические и механические свойства металлов
Строение и свойства металлов Физические и механические свойства металлов Кислотно-основное титрование
Кислотно-основное титрование Apa în natură. Resursele de apă
Apa în natură. Resursele de apă Элементы второй группы главной подгруппы
Элементы второй группы главной подгруппы Реакции щелочно-земельных металлов (Группа 2) – Mg, Ca
Реакции щелочно-земельных металлов (Группа 2) – Mg, Ca Металлы и неметаллы
Металлы и неметаллы Марганец и его соединения
Марганец и его соединения Алкины
Алкины Фтор (Fluorum), F
Фтор (Fluorum), F Оксиды, свойства и способы получения
Оксиды, свойства и способы получения Минералы и горные породы
Минералы и горные породы Природный газ
Природный газ Кристаллография, кристаллохимия, минералогия
Кристаллография, кристаллохимия, минералогия Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза d997-13229e5e
d997-13229e5e Химические элементы. Типы связей
Химические элементы. Типы связей Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Конструкционные материалы
Конструкционные материалы Классификация веществ по характеру связи
Классификация веществ по характеру связи Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Геология полезных ископаемых
Геология полезных ископаемых Азотная кислота и ее соли. Физические свойства
Азотная кислота и ее соли. Физические свойства